人参低聚肽对急性酒精中毒大鼠的保护作用研究
刘 睿,陈启贺,任金威,徐 腾,李 林,杜 倩,乌 兰,刘欣然,李 勇
(北京大学公共卫生学院营养与食品卫生学系,北京 100191)
急性酒精中毒(acute alcoholism,AAI)俗称醉酒,是指因短时间内摄入过量酒精或酒类饮料引起的中枢神经系统由兴奋转为抑制的状态,按程度可分为兴奋期、共济失调期和昏睡期,又可称为急性乙醇中毒。急性酒精中毒可能造成肝脏、心脑血管等多系统损伤,严重者甚至可危及生命。据统计,急性酒精中毒已成为节假日里发病率最高的3种疾病之一,且发病年龄段多集中在25~45岁,因此寻找方便有效的防治措施有着重要的意义[1-2]。在所有因饮酒导致的疾病中,酒精性肝病(alcoholic liver disease,ALD)最为常见,ALD指因酒精损伤肝细胞而引起的一系列疾病,临床常见的有酒精性脂肪肝、酒精性肝炎和酒精性肝硬化。在我国酒精性肝病已成为仅次于病毒性肝炎的第二大肝病病因,发病率也呈逐年上升趋势。但目前除控制酒精摄入外尚无ALD特异治疗方法,临床上使用糖皮质激素或丙基硫氧嘧啶治疗ALD,但是这些药物在应用中仍有争议。急性肝损伤是许多肝脏疾病的初始环节和共同途径,因此通过功能性食品在急性肝损伤早期避免或缓解对肝脏的损害,防治ALD的发生,成为当今研究的新趋势[3-6]。
人参在我国已有四千多年的药用历史,我国的人参属五加科、人参属的多年生草本植物,主要产于吉林省,是闻名遐迩的“东北三宝”之一。研究发现,人参具有抗氧化、抗疲劳、抗肿瘤、增强免疫力、改善记忆力等作用[7],其中人参的抗氧化作用已经在动物实验和人体研究中得到证实,而关于人参的抗炎作用则报道较少[8-10]。人参低聚肽(ginseng oligopeptides,GOP)是利用生物酶解技术从人参中得到的小分子生物活性肽,主要是由分子量很小但活性很高的短肽分子组成。研究发现,低聚肽可以有效提高蛋白质的吸收利用率,要比单个氨基酸的吸收更为有效,但现有研究多集中于体外研究,且大部分针对人参蛋白,对其功能研究较少报道[7,11]。
本研究拟采用大鼠急性酒精中毒模型,探讨人参低聚肽对急性酒精中毒和早期肝损伤的保护作用,并对其可能的作用机制进行进一步的探索,为人参低聚肽在作为保护机体免受酒精伤害和抗酒精性肝损伤的功能性因子的保健食品及药品的开发方面提供实验研究基础。
1 材料和方法
1.1 样品
人参低聚肽(GOP),淡黄色固体粉末,由吉林肽谷生物工程有限责任公司提供。GOP是利用生物酶解技术从吉林人参中得到的小分子生物活性肽的混合物,相对分子质量分布为:<180(占71.36%)、180~500(占20.16%)、500~1 000(占5.87%)、1 000~2 000(占1.97%)、>2 000(占0.64%)。质量分数为95.42%,氨基酸总量占3.94%。乳清蛋白,由北京中柏公司提供,其蛋白含量为78%。
1.2 主要试剂和仪器
主要试剂:无水乙醇(分析纯);丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)检测试剂盒,英科新创(厦门)科技有限公司;乙醇脱氢酶(ADH)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)试剂盒,北京安迪华泰科技有限公司。
主要仪器:Adventurer TM通用型分析天平,美国奥豪斯国际贸易有限公司;Eppendorf高速冷冻离心机,德国艾本德股份公司;电热恒温水浴锅,北京天林恒泰科技有限公司;FSH-2A可调高速电动匀浆机,金坛市金南仪器厂;日本奥林巴斯株式会社全自动生化仪AU400,英科新创(厦门)科技有限公司;352型酶标仪,赛默飞世尔科技(中国)有限公司;GNP-9080型隔水式恒温培养箱,上海创奕科教设备有限公司。
1.3 实验动物
SPF级雄性SD大鼠,适应期结束时,体重200±20g,由北京大学医学部实验动物中心提供。饲养地点为北京大学医学部实验动物科学部,动物实行分笼饲养,每笼3只,实验期间自由饮水、进食。动物饲养实验室符合国标SPF级,温度范围为22±2℃,相对湿度为50%~60%,昼∶夜明暗交替时间为12 h∶12 h。
1.4 实验方法
1.4.1动物分组及用药 按体重将实验动物随机分为7组,1组为正常对照组,其余6组为模型组:即1个模型对照组、1个乳清蛋白对照组(0.25g/kg BW)和4个人参低聚肽组(0.062 5、0.125 0、0.250 0、0.500 0g/kg BW,分别对应GOP 1、GOP 2、GOP 3和GOP 4组)。每日经口灌胃给予受试样品,受试样品给予时间30d。空白对照组和模型对照组给予蒸馏水,乳清蛋白组和人参低聚肽组给予相应浓度受试物,灌胃量为1mL/100g,人参低聚肽和乳清蛋白溶液均用蒸馏水配制。动物每周称重2次,按体重调整受试样品剂量。给予受试样品结束后将模型对照组及各样品组一次性灌胃给予50%乙醇17.5mL/kg BW(7g/kg BW),空白对照组给予蒸馏水。实验期间观察实验动物的一般情况,包括毛色、精神状态、日常活动情况等。
1.4.2翻正反射 模型组以翻正反射是否消失或恢复为指标观察大鼠的醉酒与醒酒情况。将大鼠背向下轻置于动物笼内,如果大鼠保持背向下的姿势30s以上,则认为翻正反射消失,即为醉酒;当翻转反射消失的大鼠能够自主从背向下的姿势翻转过来时,为翻正反射恢复,即为醒酒。实验过程中记录灌酒后翻转反射消失的动物只数、翻转反射消失时间及翻转反射恢复时间,从翻转反射消失到翻正反射恢复的这段时间则为翻转消失持续时间[12]。
1.4.3乙醇代谢酶检测 大鼠灌酒后,禁食16h经股动脉采血后处死,分离血清及血浆并留取肝脏,进行各项指标的检测。在冰浴剥离肝脏,除去脂肪组织,用预冷的生理盐水漂洗组织至无血色,称取相同部位组织适量,制成匀浆,3 000r/min低温离心10min,取上清,检测肝组织乙醇脱氢酶(ADH)的活性。
1.4.4血生化指标检测 血液3 000r/min离心10min后,分离血清,采用全自动生化分析仪检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的含量。
1.4.5炎症因子水平检测 血液3 000r/min离心10min后,分离血清,用 ELISA 法检测血清中肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-1β(IL-1β)水平。
1.5 统计方法

2 结果与分析
2.1 人参低聚肽对SD大鼠翻正反射的影响
给予受试样品的30d内,各组大鼠的毛色、精神状态和粪便等均正常,无明显的差异。酒精灌胃后模型对照组大鼠出现了明显的酒精中毒现象,如反应迟钝、嗜睡、活动减少、精神萎靡,有些大鼠表现极度活跃、狂躁,随后转为安静状态、嗜睡、精神萎靡等;人参低聚肽干预组大鼠精神状态明显较模型对照组好,在高剂量组表现得尤为明显。由表1可知,实验各组体重无明显差异(P>0.05)。与模型对照组相比,人参低聚肽干预组大鼠翻正反射消失只数减少,翻正反射消失的比率明显降低,GOP 4组与模型对照组相比差异具有统计学意义(P<0.05)。人参低聚肽干预组翻正反射消失的时间明显长于模型对照组,恢复时间明显短于模型对照组。
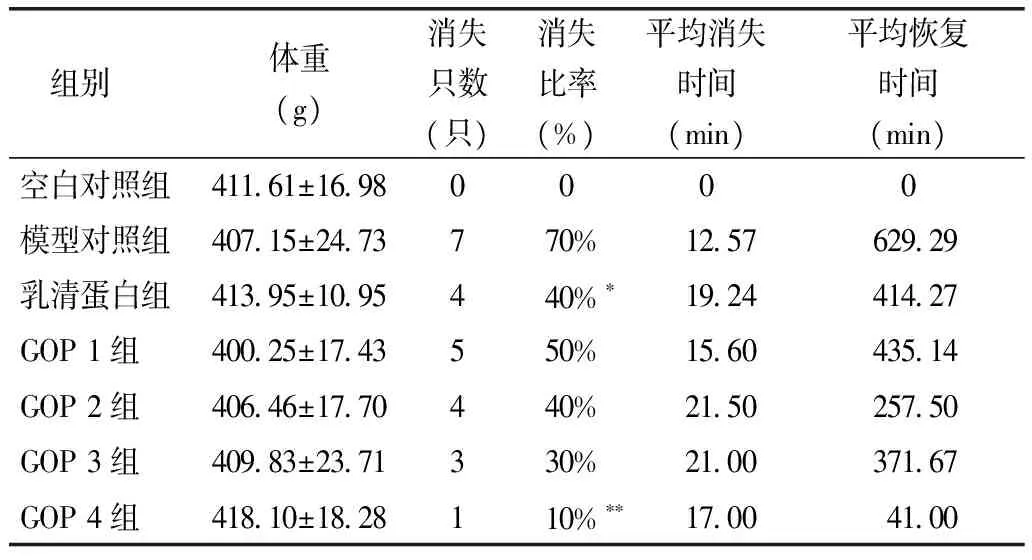
表1 人参低聚肽对SD大鼠翻正反射的影响(n=10)
注:**与模型对照组相比,P<0.01
2.2 人参低聚肽对SD大鼠血清生化指标的影响
血清ALT、AST水平是评价早期肝损伤的常用指标。由表2可知,模型对照组大鼠血清ALT、AST较空白对照组明显升高(P<0.05),人参低聚肽各组血清ALT、AST含量较模型对照组则显著降低(P<0.05),人参低聚肽各组与乳清蛋白组相比无明显差异(P>0.05)。
与空白对照组相比,模型对照组大鼠血清TC、HDL-C、LDL-C含量显著降低(P<0.05),血清TG含量明显升高(P<0.05);与模型对照组相比,人参低聚肽各组大鼠血清TC、TG、HDL-C和LDL-C含量与模型对照组均无统计学差异(P>0.05);与乳清蛋白组相比,人参低聚肽各组TG含量显著降低(P<0.05),其余指标与乳清蛋白组相比无明显差异(P>0.05)。
2.3 人参低聚肽对SD大鼠肝组织乙醇代谢酶的影响
如附图所示,与空白对照组相比,模型对照组大鼠肝脏ADH含量明显降低,人参低聚肽组除GOP1组外,其他3组大鼠ADH含量均较空白对照组高,差异具有统计学意义(P<0.05);与模型对照组相比,人参低聚肽各组ADH含量平均值均高于模型对照组,其中GOP2、GOP3和GOP4组与模型对照组相比,差异具有显著性(P<0.05);与乳清蛋白对照组相比,除GOP1组ADH含量降低外,其他3组ADH含量均明显升高(P<0.05)。在人参低聚肽各剂量组,GOP1、GOP2、GOP3组随着剂量的增加,大鼠ADH含量也明显增加,在GOP3组(剂量为0.25g/kgBW时)达到最高值,GOP4组ADH含量较GOP3组降低,但仍高于GOP1和GOP2组。

表2 人参低聚肽对SD大鼠血清生化指标的影响
注:a与空白对照组相比,P<0.05;a*与空白对照组相比,P<0.001;b与模型对照组相比,P<0.05;b*与模型对照组相比,P<0.001;c与乳清蛋白组相比,P<0.05;c*与乳清蛋白组相比,P<0.001

附图 人参低聚肽对SD大鼠肝脏ADH含量的影响注:a与空白对照组相比,P<0.05;a*与空白对照组相比,P<0.001;b与模型对照组相比,P<0.05;b*与模型对照组相比,P<0.001;c与乳清蛋白对照组相比,P<0.05;c*与乳清蛋白对照组相比,P<0.001
2.4 人参低聚肽对SD大鼠血清炎症因子水平的影响
SD大鼠血清中炎症因子TNF-α、IL-1β、IL-6水平如表3所示,与空白对照组相比,模型对照组血清TNF-α、IL-1β、IL-6水平显著升高(P<0.001),人参低聚肽各组除血清TNF-α水平较空白对照组高外,血清IL-1β和IL-6水平均低于空白对照组,差异具有显著性(P<0.001);与模型对照组和乳清蛋白对照组相比,人参低聚肽4个干预组大鼠血清TNF-α、IL-1β、IL-6水平均明显降低(P<0.05),差异具有统计学意义。
3 讨论
动物实验是目前研究急性酒精中毒最常用的方法,但尚无统一的动物醉酒模型。结合国内外以往报道,应保证在实验动物可以承受的范围内,尽量加大灌胃酒精剂量,以观察动物急性酒精中毒的表现。本研究在总结以往研究经验基础上,通过预实验的观察探讨,实验时按照50%乙醇17.5mL/kg BW(7g/kg BW)的剂量灌胃,造成SD大鼠急性酒精中毒模型。单纯的蛋白质摄入增加可能会对脂代谢指标有一定的影响,因此本研究设置了乳清蛋白组作为对照来排除因单纯提高蛋白质的摄入量而引起的假阳性结果。乳清蛋白在消化过程中可产生多种生物活性多肽,研究证实其具有提高免疫力、抗疲劳、抗氧化、降血脂等多种功效[13-14]。

表3 人参低聚肽对SD大鼠血清TNF-α、IL-1β和IL-6含量的影响
注:a与空白对照组相比,P<0.05;a*与空白对照组相比,P<0.001;b与模型对照组相比,P<0.05;b*与模型对照组相比,P<0.001;c与乳清蛋白组相比,P<0.05;c*与乳清蛋白组相比,P<0.001
急性酒精中毒分为兴奋期、共济失调期和昏睡期三个阶段,其中昏睡期最容易发生危险,也是最能检验解酒药物是否有效的时期。翻正反射消失表明大鼠开始进入昏睡期,因此国内外研究均把翻正反射消失作为评价醉酒的首要方法[15-16]。在本研究中,给予动物酒精灌胃后,模型对照组有70%的动物都陷入了昏睡期,人参低聚肽干预后组陷入昏睡期的老鼠明显减少,GOP4组仅有1只陷入昏睡期,且较模型对照组明显延迟了醉酒时间,提前了醒酒时间,表明长期服用吉林人参低聚肽能减少醉酒的机率,缩短醉酒时间。
当肝细胞受损时,血清中ALT和AST含量将明显升高[17]。由结果可知,与空白对照组相比,模型对照组大鼠血清ALT、AST水平显著升高(P<0.05),说明模型对照组出现了急性肝损伤;而GOP干预能够显著降低大鼠血清 ALT、AST水平((P<0.05或P<0.01),说明人参低聚肽对酒精诱导的大鼠急性肝损伤有保护作用。酒精性肝病患者中脂类代谢异常十分常见,大量乙醇在体内的脱氢氧化会导致三羧酸循环障碍和脂肪酸氧化减弱,并降低肝脏运出脂肪的能力,从而影响脂肪代谢,致使脂肪在肝细胞内沉积[4,18-19]。本研究中模型对照组大鼠血清TG含量较空白对照组显著升高(P<0.05),说明酒精摄入造成了大鼠甘油三酯水平的增高,但人参低聚肽各组大鼠血清TC、TG、HDL-C和LDL-C含量与模型对照组相比均无明显变化(P>0.05),因此尚不能认为人参低聚肽可以有效地预防酒精引起的体内血脂水平的升高,还需进一步研究证实。
机体摄入的酒精90%在肝脏代谢,首先由肝细胞内的乙醇脱氢酶(ADH)氧化为乙醛,再由乙醛氧化为乙酸,乙酸进一步分解为水和二氧化碳排出体外。乙醛不但可直接损失肝细胞、抑制三羧酸循环、引起脂质过氧化反应,还可抑制细胞的分化及损伤组织的再生与修复,促进肝纤维化的形成[4,20]。本研究结果表明,人参低聚肽干预组ADH活性显著高于模型对照组(P<0.05),GOP2、GOP3和GOP4 三组大鼠ADH含量均高于空白对照组和乳清蛋白对照组(P<0.05),此外,在4个人参低聚肽剂量组中,GOP3组(即0.25g/kg BW剂量组)ADH含量明显干预其他3组。这表明人参低聚肽干预加快了乙醇的氧化,从而减轻了酒精代谢产物乙醛对机体的急性损害,且0.25g/kgBW剂量的人参低聚肽可能更有利于提高肝脏乙醇代谢酶的活性,但还需进一步进行验证。
炎症反应是酒精性肝炎的主要特征之一。酒精摄入可引起调节炎症反应相关的许多基因表达,导致炎性因子合成、释放,使炎症细胞对炎症刺激过度反应产生大量的炎症介质如TNF-α、IL-1β和IL-6等,其中TNF-α是ALD发生发展过程中重要的促炎因子,与炎症反应、脂质代谢和细胞死亡都密切相关[21-23]。本研究发现,与对照组相比,人参低聚肽能够明显降低血清中TNF-α、IL-1β、IL-6的水平(P<0.05),因此可以推断人参低聚肽可在一定程度上改善酒精引起的血清炎症反应。
综上所述,本研究通过建立大鼠急性酒精中毒模型,设立空白对照组、模型对照组和乳清蛋白组作为对照组,探讨人参低聚肽对急性酒精中毒的保护作用及其可能机制。研究表明,人参低聚肽可有效降低醉酒大鼠翻正反射消失的比率,降低酒精引起的血清ALT、AST的升高,提高肝脏乙醇脱氢酶活性,抑制酒精导致的血清炎症因子水平的升高,从而起到保护肝细胞与改善肝功能的作用,这对早期防治酒精性肝病和保护机体免受急性酒精中毒的伤害有重要意义。
但是仍有许多问题有待进一步探讨。其一,动物模型目前并没有统一定论,干预方式各不相同,最终模型可能涉及酒精性脂肪肝、酒精性肝炎、肝硬化等,动物模型并不稳定,因此需要寻找适宜的动物模型来研究功能性食品对急性酒精中毒的防治作用有着重要的意义;其二,目前关于人参低聚肽的研究相对较少,本研究表明,人参低聚肽具有提高性功能、抗疲劳、增强机体免疫力[7]等作用。根据目前的研究结果,笔者会继续优化剂量设置,进行更深入的研究,如在体外实验中进一步验证人参低聚肽对酒精性肝损伤的保护作用机制。此外,也需要人群研究进一步证实其对酒精性肝损伤的改善效果及适宜剂量。◇
[1]王艳艳.七味姜黄方对小鼠急性酒精中毒的干预研究[D].成都中医药大学,2012.
[2]Lee S,Guo WJ,Tsang A,et al.Associations of cohort and socio-demographic correlates with transitions from alcohol use to disorders and remission in metropolitan China[J].Addiction,2009,104(8):1313-1323.
[3]中华医学会肝病学分会脂肪肝和酒精性肝病学组.酒精性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):167-170.
[4]刘玉兰.整合肝肠病学[M].人民卫生出版社,2014.
[5]Powers MS,Chester JA.Effects of stress,acute alcohol treatment,or both on pre-pulse inhibition in high-and low-alcohol preferring mice[J].Alcohol,2014,48(2):113-122.
[6]蔡夏夏,鲍雷,王楠,等.膳食5’-核苷酸对酒精性肝损伤大鼠肠道菌群的影响[J].食品科学,2015,36(15):212-216.
[7]何丽霞,刘睿,任金威,等.吉林人参低聚肽的免疫调节作用[J].科技导报,2015,33(18):62-67.
[8]Mahdy Hassanzadeh D,Hedayatollah F,Morteza M,et al.The effects of panax ginseng on lipid profile,pro-oxidant:antioxidant status and high-sensitivity C reactive protein levels in hyperlipidemic patients in Iran[J].International Journal of Preventive Medicine,2013,4(9):1045-1051.
[9]Demir I,Kiymaz N,Gudu BO,et al.Study of the neuroprotective effect of ginseng on superoxide dismutase(SOD)and glutathione peroxidase(GSH-Px)levels in experimental diffuse head trauma[J].Acta Neurochirurgica,2013,155(5):913-922.
[10]Hyeong-Geug K,Sa-Ra Y,Hye-Jung P,et al.Antioxidant effects of Panax ginseng C.A.Meyer in healthy subjects:a randomized,placebo-controlled clinical trial.[J].Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2011,49(9):2229-2235.
[11]李勇.肽临床营养学[M].北京大学医学出版社,2012.
[12]林兵,于永超,陈禹,等.玉米肽对急性酒精中毒大鼠的作用研究[J].中国食物与营养,2014,20(4):66-68.
[13]Powers MS,Chester JA.Effects of stress,acute alcohol treatment,or both on pre-pulse inhibition in high-and low-alcohol preferring mice[J].Alcohol,2014,48(2):113-122.
[14]蒲玲玲,郭长江.乳清蛋白的组成及其主要保健功能[J].中国食物与营养,2011,17(6):68-70.
[15]Van Skike CE,Botta P,Chin VS,et al.Behavioral effects of ethanol in cerebellum are age dependent:potential system and molecular mechanisms[J].Alcohol Clin Exp Res,2010,34(12):2070-2080.
[16]Liang J,Li Q,Lin B,et al.Comparative studies of oral administration of marine collagen peptides from Chum Salmon(Oncorhynchus keta)pre-and post-acute ethanol intoxication in female Sprague-Dawley rats[J].Food Funct,2014,5(9):2078-2085.
[17]Jayakumar T,Ramesh E,Geraldine P.Antioxidant activity of the oyster mushroom,pleurotus ostreatus,on CCl 4-induced liver injury in rats[J].Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2006,44(12):1989-1996.
[18]Abid R,Mahmood R,Santosh K H.Hypolipidemic and antioxidant effects of ethanol extract of Cassia fistula fruit in hyperlipidemic mice[J].Pharm Biol,2016:1-8.
[19]沈峰.FibroScan联合CK-18评估脂肪性肝病的全国多中心临床研究[D].上海交通大学,2014.
[20]卿笃信.酒精代谢酶与酒精性肝病的关系研究进展[J].国外医学(生理、病理科学与临床分册),2003,23(3):310-313.
[21]Hoek JB,Pastorino JG.Ethanol,oxidative stress,and cytokine-induced liver cell injury[J].Alcohol,2002,27(1):63-68.
[22]Kiyoshi T,Shizuo A.TLR signaling pathways[J].Seminars in Immunology,2004,16(1):3-9.
[23]Egan LJ,Lars E,Greten FR,et al.IκB-kinaseβ-dependent NF-κB activation provides radioprotection to the intestinal epithelium[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(8):2452-2457.
[24]林兵,于永超,陈禹,等.胶原多肽对亚急性酒精中毒大鼠的保护作用研究[J].中国食物与营养,2015,21(2):69-72.

