糖原累积症合并高脂血症性胰腺炎致区域性门脉高压1例报告
张 娟, 沈沪佳, 王 超, 陈茂培, 徐 馨, 郑苏苏, 林佳佳, 景楚瑜, 张雪霞, 张博恒, 李 蕾*
1. 复旦大学附属中山医院肝肿瘤内科,上海 200032 2. 复旦大学附属中山医院消化内科,上海 200032
糖原累积症(glycogen storage disease, GSD)是一类遗传性糖代谢障碍疾病。GSD典型临床表现为反复低血糖、高脂血症、高乳酸血症、高尿酸血症,并存在患者生长发育落后和青春期延迟等现象。高脂血症(特别是高三酰甘油血症),与急性胰腺炎以及复发性胰腺炎的密切联系已被国内外广泛证实[1]。胰腺炎反复发作可累及脾静脉,造成静脉血管受压;同时炎症侵蚀造成血管痉挛、内膜损害和血流瘀滞,引起脾静脉血栓形成,造成脾胃区静脉系统压力升高,导致胃底静脉曲张,引发上消化道出血等一系列并发症。本研究为对GSD合并高脂血症性胰腺炎(hyperlipidemic pancreatitis,HLP)所致的区域性门脉高压(regional portal hypertension, RPH)患者进行临床分析,以提高临床医师对GSD合并HLP所致的RPH的认识。
1 病例资料
1.1 病 史 患者,男性,25岁,因“反复呕血、黑便5 d”于2017年4月17日入院。患者于2017年4月14日晚餐后无明显诱因突发呕血1次,伴呕吐胃内容物,轻微上腹部不适,数次黑便(呕血及黑便量均记忆不清),无头晕、头痛,无黑朦、晕厥,无胸闷、胸痛,无腹痛、腹泻,无皮肤巩膜黄染、精神行为异常等,未予重视,未行特殊处理。第2日于室外活动过程中再发呕血1次(量不详),伴一过性黑朦,遂于外院急诊就诊。血常规提示,血红蛋白57 g/L,予补液、禁食、抑酸、止血等治疗,输注(B+)悬浮红细胞4 U及冰冻血浆200 mL,后呕血症状未再出现。2017年4月17日复查血常规提示,血红蛋白71 g/L;电子胃镜示“浅表性胃炎,胃底静脉曲张”(图1);腹部彩超示“肝、脾肿大,胆囊结石”,考虑胃底静脉曲张破裂出血,建议转诊我院进一步检查及治疗。自发病以来,患者精神、睡眠稍差,遵医嘱禁食,后半流质饮食,粪便由黑转黄,小便无特殊,体质量近期未见明显改变。
患者既往于1997年9月(4周岁)因发现腹部膨隆于当地医院就诊,查体发现肝脾大,B超检查提示肝脾大,肝功能检查提示总胆红素/直接胆红素正常,凝血酶原时间延长。1998年2月4日为进一步明确病因于复旦大学附属儿科医院就诊。实验室检查:血常规示血红蛋白108 g/L、白细胞6.8×109/L、中性粒细胞百分比60%、淋巴细胞百分比40%、血小板168×109/L;尿粪常规正常;生化检查示谷氨酸氨基转移酶49 U/L、天冬氨酸氨基转移酶<40 U/L、蛋白电泳正常、血胆固醇正常、肾功能正常;空腹血糖3.5 mmol/L(3.9~5.8 mmol/L),葡萄糖耐量实验提示空腹3.8 mmol/L(3.9~5.8 mmol/L)、1 h 5.0 mmol/L(6.6~9.3 mmol/L)、1.5 h 5.5 mol/L(5.5~7.7 mmol/L)。1998年2月21日再次复查,血生化示谷氨酸氨基转移酶91 U/L、天冬氨酸氨基转移酶101 U/L;B超示肝肿大、损伤(符合代谢性疾病),肝上界位于第4肋间,斜径10.3 cm、肋下长8.9 cm、剑突下长8.9 cm;肝穿刺病理结果:免疫组化示HbsAg(-)、HbcAg(-)、HCV-NS5(-);电镜检查显示肝细胞质内大量糖元颗粒,其他细胞器减少,线粒体有异形,部分细胞核内亦可见糖原颗粒,肝窦旁星状细胞可见,伴少量胶原纤维。电镜所见与光镜形态相符,故明确诊断为GSD。之后不规律服用生玉米粉,无其他用药及治疗。
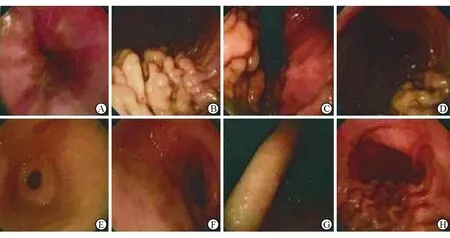
图1 该例患者胃镜检查结果
胃底黏膜粗大,见曲张静脉、表面血泡. A:食管齿状线;B:胃体上部大弯;C:胃底;D:胃底;E:幽门口;F:十二指肠球部;G:胃角;H:胃体下部
患者有痛风史数年,口服别嘌醇及碳酸氢钠治疗。患者有高三酰甘油血症数年,规律服用非诺贝特治疗。患者于2014年12月8日行连续肾脏替代疗法(continuous renal replacement therapy,CRRT)及降脂治疗,血生化显示三酰甘油4.61 mmol/L,2015年10月6日为16.80 mmol/L、2016年4月27日为9.60 mmol/L,分别于南京军区总院及江阴市人民医院就诊,明确诊断为急性重症HLP,予以禁食、抑酸、补液、抑制胰酶分泌、抗感染、CRRT及对症支持治疗后好转。患者系G1P1足月顺产儿,无窒息抢救史。否认家族中有类似疾病,未婚未育。
1.2 体格检查 患者体质量48 kg 、身高163 cm;入院体温37.0℃、脉搏80次/min、呼吸20次/min、血压111/66 mmHg(1 mmHg=0.133 kPa)。体型消瘦,贫血貌,神志清晰,精神尚可,自主体位,查体合作。全身皮肤较苍白,无黄染,未见皮疹及出血点,无肝掌、蜘蛛痣。双肺叩诊清音,听诊呼吸音清,未闻及干湿性啰音。心前区无隆起,心界不大,心率80次/min,律齐,未闻及病理性杂音。腹部平软,无压痛和反跳痛,肝肋下5 cm,边缘柔软,脾肋下未及,肝肾区无叩击痛,肠鸣音4次/min。左侧膝关节肿胀,皮温稍高,有压痛,双下肢无浮肿,足背动脉搏动可,神经系统检查(-),外生殖器发育正常。
1.3 实验室检查 血常规提示,红细胞计数2.55×1012/L、血红蛋白72 g/L、血小板计数213×109/L、白细胞计数4.00×109/L、中性粒细胞百分比51.9%、红细胞沉降率为46 mm/h。尿常规提示,蛋白;粪常规正常,粪隐血阴性。肝功能提示,总胆红素13.3 μmol/L、直接胆红素5.7 μmol/L、总蛋白65 g/L、白蛋白41 g/L、球蛋白24 g/L、白球比值1.7、丙氨酸氨基转移酶29 U/L、天冬氨酸氨基转移酶24 U/L、碱性磷酸酶80U/L、γ-谷氨酰转肽酶127 U/L、总胆汁酸2.0 μmol/L、乳酸脱氢酶91 U/L、胆碱酯酶7474 U/L、尿素 3.6 mmol/L、肌酐50 μmol/L、尿酸752 μmol/L、高敏C反应蛋白42.7 mg/L、乳酸6.70 mmol/L。糖代谢检查显示,葡萄糖3.6 mmol/L、糖化白蛋白8.2%,糖化血红蛋白4.7%;脂代谢检查显示,总胆固醇6.30 mmol/L、三酰甘油 9.02 mmol/L、低密度脂蛋白胆固醇2.87 mmol/L、非高密度脂蛋白胆固醇5.49 mmol/L、高密度脂蛋白胆固醇0.81 mmol/L、载脂蛋白A-I 1.37 g/L、载脂蛋白B 1.61 g/L、载脂蛋白E 140 mg/L、脂蛋白(a)44 mg/L。凝血功能检查显示,凝血酶原时间12.2 s、凝血酶原时间比值为1.11、国际标准化比值 1.11、凝血酶时间15.0 s、活化部分凝血活酶时间22.3 s、纤维蛋白原5 280 mg/L、D-二聚体 0.19 mg/L。心脏标志物、电解质、肝硬化、乙肝标志物指标未提示异常。
1.4 CT检查 CT检查(图2)示,食管下段及胃底见扩张扭曲静脉,肠系膜上静脉部分属支迂曲扩张,胰尾区见一囊性灶(约23 mm×28 mm),增强无明显强化,稍压迫脾静脉,提示RPH伴食管胃底静脉曲张、肝右叶血管瘤、胆囊结石、双肾囊肿。肝脾超声示:脾门处脾静脉透声差,提示血流缓慢或可疑栓子;脂肪肝,肝右叶实质占位,提示血管瘤;胆囊结石,胆囊内胆泥淤积;双肾囊肿。
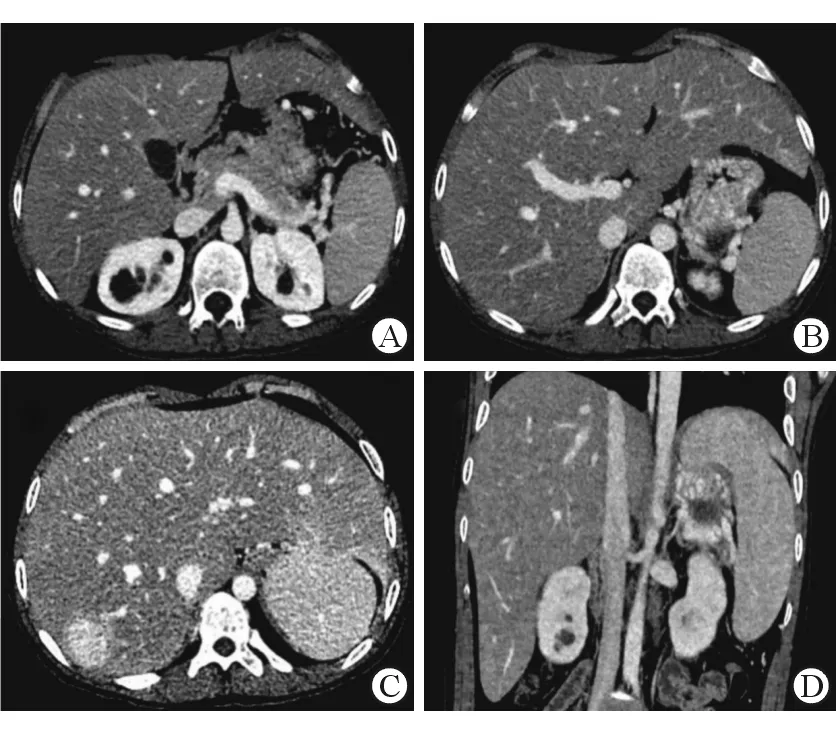
图2 CT示区域性门脉高压伴食管胃底静脉曲张
A:胰尾区脾静脉稍受压;B:胃底静脉曲张;C:食管下段及脾门见扩张扭曲静脉;D:肠系膜上静脉部分属支迂曲扩张,胰尾区一囊性灶,大小约23 mm×28 mm,增强无明显强化,压迫脾静脉
1.5 诊治经过 目前诊断为急性上消化道出血(胃底静脉曲张破裂),RPH,肝GSD,胰腺假性囊肿,高脂血症,肝右叶血管瘤,胆囊结石,双肾囊肿,痛风。患者入院后已无活动性出血,继续半流质饮食,并予抑酸、保肝、升糖等对症支持治疗,考虑患者反复胰腺炎发作引起脾脏血管阻塞致RPH、胰腺假性囊肿进一步加重RPH,导致胃底静脉曲张破裂。经我院普外科会诊及讨论,有行外科手术治疗的指征,综合患者情况,与家属商议后决定拟行贲门周围血管离断术+脾切除手术治疗。2017年6月29日患者于我院普外科进行复诊并手术,探查腹腔无明显腹腔积液,肝脏增大,胃周血管增粗,脾肿大约25 cm×15 cm×10 cm、与周围重度黏连而分离困难,遂行贲门周围血管离断术,逐支缝扎胃短血管分支,分离结扎胃体部至贲门下方。患者术后恢复,出院。出院至末次随访,患者无呕血、黑便。
2 讨 论
GSD是一组由于先天性酶缺陷所造成的代谢性疾病,其共同的生化特征是糖原代谢异常。GSD多属分解代谢缺陷,使糖原异常堆积。根据酶缺陷不同及发现的时间顺序,GSD分为14型,其中Ⅰ、Ⅲ、Ⅳ、Ⅸ型以肝脏病变为主,Ⅰ、Ⅲ、Ⅳ型的肝脏受损严重,Ⅱ、Ⅴ、Ⅶ型以肌肉受损为主。患者症状的轻重取决于糖原转化为葡萄糖的障碍程度。各亚型临床表现不同,预后差异也大。Ⅰ型根据酶缺乏的不同分为3个亚型,Ⅰa型即葡萄糖-6-磷酸酶缺乏;Ⅰb型即葡萄糖-6-磷酸微粒体转化酶T1缺乏;Ⅰc型即无机磷酸盐微粒体转化酶T2缺乏。其中Ⅰa型较为常见,又被称为Gierke病,为常染色体隐性遗传,具体位点位于17q21的G6PC基因(glucose-6-phosphatase-a gene),最常见的基因突变为G6Pase基因外显子5核苷酸位点727处纯合子型 G的单个碱基突变(G727T)[2]。GSDⅠa型临床上常以肝脏肿大、生长发育落后、低血糖、抽搐、反复鼻衄、腹泻、呕吐等症状为首发症状[3],亦有以腹痛、腹胀为主的急性胰腺炎症状入院者。GSDⅠa型患者至成人期可能发生肝腺瘤、高脂血症、胰腺炎、胆囊结石、动脉粥样硬化、肾结石、痛风性关节炎、结节瘤、出血性胃炎等疾病[4-6]。基因检测突变位点和肝活检酶学测定可以确诊该病。患者有易饥饿的低血糖症状,生长较同龄人缓慢,体检显示肝脏明显增大,同时存在高脂血症、高尿酸血症、肝功能异常、急性胰腺炎、胆囊结石、痛风性关节炎并发症,结合肝穿刺结果临床上可明确诊断为GSDⅠ型。
GSD Ⅰa型患者肝内葡萄糖-6-磷酸酶缺乏,易造成糖原分解障碍,导致肝脏不能将糖原、乳酸、氨基酸转化为葡萄糖,引起空腹低血糖。而低血糖则可抑制胰岛素分泌,脂肪组织摄取葡萄糖减少,脂肪合成减少。胰岛素敏感的脂蛋白脂酶由于胰岛素不足而活性低下,使脂肪组织释放大量的脂肪酸,从而导致血浆三酰甘油升高[7-9]。目前,高脂血症已成为除胆源性和酒精性外的第3种常见胰腺炎诱因,约占急性胰腺炎总数的25.6%。HLP一般在排除其他致病原因(如胆源性、酒精性、药物性、自身免疫性及ERCP术后等)后可明确诊断,实验室指标显示,三酰甘油>11.3 mmol/L或为5.65~11.30 mmol/L,且血清呈乳状。本例患者无饮酒、暴饮暴食、外伤手术、妊娠、服药等病史,且其胆囊结石为继急性HLP后发生,症状、体征及其他检查与胆源性胰腺炎不符,因此认为高三酰甘油血症是急性胰腺炎的主要病因。
脾静脉与胰腺体尾相邻,是胰腺炎最容易受侵犯的血管,反复发作的胰腺炎累及脾静脉,可导致脾静脉血管痉挛、内膜损害、管壁增粗和血流瘀滞;同时,胰腺炎时引起炎症因子IL-6、TNF-α、IL-1β等释放,可激活凝血系统,引起血小板和纤维蛋白积聚,形成脾静脉血栓,造成脾胃区静脉系统压力升高[10]。RPH又称脾胃区或左侧门脉高压,以胰源性RPH最为多见,主要由胰腺疾病导致脾静脉血栓形成或脾静脉压力增高,其中急慢性胰腺炎诱发者占60%~65%。RPH临床表现为消化道出血、脾大、脾功能亢进、腹腔积液和腹痛[11]。本例患者B超提示,脾门处脾静脉血流缓慢或可疑栓子,CT提示脾静脉受压及胰腺囊肿,而两者均可导致RPH,进而引起胃底静脉曲张。本例患者反复发作胰腺炎,胰腺炎症反复损伤脾静脉导致脾静脉栓塞和胰腺假性囊肿,导致RPH,引起胃底曲张静脉破裂出血。
对于GSD患者,积极的内科治疗包括食用生的、不加热的玉米粉(2 g/kg,q6h)。2002年,欧洲治疗联盟提出,GSD治疗的生化指标为餐前血糖大于3.4 mmol/L、尿酸/尿肌酐<0.06、血乳酸接近正常上界、静脉血剩余碱>-5 mmol/L及碳酸氢根大于20 mmol/L、血三酰甘油<6.0 mmol/L、体质指数(BMI)±2.0s[12]。本例患者在确诊GSD后不规律食用生玉米粉,生长发育仍缓慢,并长期存在高脂血症,用贝特类药物控制血脂,但没有规律随访且血脂不达标,导致HLP反复发作。针对RPH,临床上常采用外科脾切除术及侧支断流术,同时切断胃短静脉与冠状静脉侧支循环,对胃底静脉曲张可达到断流目的,以避免出血,进而治愈RPH。本例患者拟行脾切除术,但由于脾与周围重度黏连,分离困难,遂行贲门周围血管离断术。肝移植可以弥补肝酶的缺陷,改善GSD患者的代谢紊乱,改善生长迟缓,提高生活质量,是目前治疗GSD唯一有效的方法[13]。
GSD患者围术期应注意防止低血糖及维持体内代谢的平衡,防治酸中毒。有研究[14]报道,GSD患者术中、术后若不输注葡萄糖可导致患者糖代谢紊乱加重,发生低血糖及顽固型代谢性酸中毒。因此,应及时补充葡萄糖,升高血糖,以阻断GSD代谢紊乱的病理环节。切记盲目使用大量碳酸氢钠纠酸,因为大量碳酸氢钠可能导致患者出现高钠血症,从而造成内环境进一步紊乱。术中应给予足量的葡萄糖(6.6~9.8 mg·kg-1·min-1),以维持血糖平稳。另外,GSD患者多存在血小板凝集异常,出血是该疾病围术期常见的并发症。本例患者也存在反复鼻衄,多次检查均示凝血酶原时间延长,可考虑采用去氨加压素控制出血。此患者虽手术风险大,但手术是缓解患者症状和预防上消化道出血的最佳方案,通过贲门周围血管离断术,可使胃底食管静脉曲张好转,降低上消化道出血风险。
目前,国内外无GSD合并HLP致RPH的报道。有1例反复腹痛就诊的GSDⅠa患者死于HLP,尸检发现急性出血性胰腺炎,伴有十二指肠和十二指肠动脉腐蚀和慢性胰腺炎特征[15]。Herman[16]报道1例GSD伴急性胰腺炎患者。国内报道1例因腹胀腹痛就诊的GSD伴急性胰腺炎患者,入院时查三酰甘油11.8 mmol/L,排除胆源性及其他相关病因,诊断为HLP[17]。Rake等[6]进行的多中心研究对231例GSD Ⅰa患者的资料进行回顾性分析,发现98%的患者存在高三酰甘油血症、43%的患者有高胆固醇血症,其中有5例并发HLP。Vivatrat等[18]报道1例GSD合并家族性脂蛋白血症反复发作胰腺炎患者。因此,临床医师应提高对GSD患者合并HLP的认识。GSD患者需积极饮食治疗(生玉米淀粉),并长期随访血脂及其他生化指标,控制高脂血症,降低HLP的发病率;如HLP反复发作,应注意并避免RPH的发生。
[ 1 ] YASAV D, PITCHUMONI C S. Issues in hyperlipidemic pancreatitis[J].J Clin Gastroenterol,2003,36(1):54-62.
[ 2 ] OZEN H. Glycogen storage diseases: new perspectives[J]. World J Gastroenterol,2007,13(18):2541-2553.
[ 3 ] SANTOS B L, SOUZA C F, SCHULER-FACCINI L, et al. Glycogen storage disease type Ⅰ: clinical and laboratory profile[J]. J Pediatr (Rio J),2014,90(6):572-579.
[ 4 ] HOU J W, WANG T R. A 20-year follow-up of a male patient with type Ⅰa glycogen storage disease[J]. Chang Gung Med J,2003,26(4):283-287.
[ 5 ] VISSER G, RAKE J P, KOKKE F T, et al. Intestinal function in glycogen storage disease type Ⅰ[J]. J Inherit Metab Dis,2002,25(4):261-267.
[ 6 ] RAKE J P, VISSER G, LABRUNE P, et al. Glycogen storage disease type Ⅰ: diagnosis, management, clinical course and outcome. Results of the European Study on Glycogen Storage Disease Type Ⅰ (ESGSDⅠ) [J]. Eur J Pediatr,2002,161 Suppl 1:S20-S34.
[ 7 ] BLACKETT P R, WILSON D P, MCNEAL C J. Secondary hypertriglyceridemia in children and adolescents[J]. J Clin Lipidol,2015,9(5 Suppl):S29-S40.
[ 8 ] SEVER S, WEINSTEIN D A, WOLFSDORF J I,et al. Glycogen storage disease type Ⅰa: linkage of glucose, glycogen, lactic acid, triglyceride, and uric acid metabolism[J]. J Clin Lipidol,2012,6(6):596-600.
[ 9 ] DERKS T G, VANRIJN M. Lipids in hepatic glycogen storage diseases: pathophysiology, monitoring of dietary management and future directions[J]. J Inherit Metab Dis,2015,38(3):537-543.
[10] NADKARNI N A, KHANNA S, VEGE S S. Splanchnic venous thrombosis and pancreatitis[J]. Pancreas,2013,42(6):924-931.
[11] KOKLU S, COBAN S, YUKSEL O, et al. Left-sided portal hypertension[J]. Dig Dis Sci,2007,52:1141-1149.
[12] RAKE J P, VISSER G, LABRUNE P, et al. Guidelines for management of glycogen storage disease type Ⅰ- European Study on Glycogen Storage Disease Type Ⅰ(ESGSD Ⅰ) [J]. Eur J Pediatr,2002,161 Suppl 1:S112-S119.
[13] LYER S G, CHEN C L, WANG C C, et al. Long-term results of living donor liver transplantation for glycogen storage disorders in children[J]. Liver Transpl,2007,13(6):848-852.
[14] OSHITA A, ITAMOTO T, AMANO H, et al. Perioperative management of benign hepatic tumors in patients with glycogen storage disease type Ⅰa[J]. J Hepatobiliary Pancreat Surg,2008,15(2):200-203.
[15] MICHELS V V, BEAUDET A L. Hemorrhagic pancreatitis in a patient with glycogen storage disease type Ⅰ[J]. Clin Genet,1980,17(3):220-222.
[16] HERMAN T E. Type ⅠA glycogenosis with acute pancreatitis[J]. J Radiol,1995,76(1):51-53.
[17] 郭建斌,徐素珍.糖原累积症并发急性胰腺炎1例[J].实用医学杂志,2009,25(20):3391.
[18] VIVATRAT N, BARSHOP B A, JONES K L. Severe hypertriglyceridemia and recurrent pancreatitis in a girl with type Ⅰa glycogen storage disease and type Ⅲ hyperlipoproteinemia[J]. Am J Med Genet A,2009,149A(11):2557-2559.

