C4d联合外周血抗体对移植肾患者预后的预测价值
张 明, 顾 勇*, 陆福明, 瞿连喜, 何 军, 袁晓妮
1. 复旦大学附属华山医院肾脏科,上海 200040 2. 复旦大学附属华山医院泌尿外科,上海 200040 3. 苏州大学附属第一医院,江苏省血液研究所,苏州 215006
目前,诊断移植肾排异的金标准是移植肾病理检查,目前国际上主要采用BANFF和CCTT标准。研究[1-2]显示,C4d与外周血人类白细胞抗原(human leukocyte antigen, HLA)抗体紧密相关,但C4d阳性而HLA抗体阴性或单独HLA抗体阳性的患者预后如何目前仍无定论。部分肾移植排异患者中,其抗体非HLA抗体,而是其他抗体,如主要组织相容性复合体Ⅰ类相关链A (major histocompatibility complex class Ⅰ-related chain A,MⅠCA)抗体、血管紧张素受体抗体、内皮细胞抗体等。这些抗体是通过补体激活途径还是其他机制造成移植物损害,目前尚无定论。而这些抗体与C4d的关系如何及这些抗体与C4d均阳性对移植物肾功能是否有影响目前研究较少。
因此,本研究探讨了肾移植患者中,HLA抗体及MⅠCA抗体与C4d及病理形态的关系,以及C4d在两种抗体分别阳性时对移植肾功能的影响,以期更深入了解抗体介导的移植肾排异。
1 资料与方法
1.1 一般资料 选取2004年1月至2007年12月于复旦大学附属华山医院首次肾移植的患者。入选标准:血肌酐值较移植后基线值升高20%或以上,病理诊断为急性或慢性排异,术前抗体检测阴性,淋巴毒交叉配型实验<10%,有长期随访资料。排除标准:因肝功能不全、感染、肠道吸收不良、对服用免疫抑制药物不耐受或过敏等停用免疫抑制药物者。合并用药情况不限。共52例患者入选,患者及家属均知情同意并签署知情同意书。本研究经医院伦理委员会审核批准。
52例患者中,男性36例,女性16例;移植时平均年龄为(40.6±8.0)岁。原发疾病包括慢性肾小球肾炎30例,梗阻性肾病2例,多囊肾1例,慢性肾盂肾炎3例,病因不详16例。52例患者移植前替代治疗时间平均为(12.0±9.8)个月。患者术后采用三联免疫治疗,MMF+CsA+泼尼松25例、MMF+FK506+泼尼松27例。
1.2 方 法 所有入选患者在移植肾病理活检后采取外周血标本,分离血清后储存于-20℃冰箱待测。移植肾标本C4d染色采用间接免疫荧光法。内生肌酐清除率(GFR)采用CG公式,并计算每月GFR变化率:ΔGFR(%)=[(随访结束时GFR-随访开始时GFR)/随访开始时GFR/随访月数]×100。HLA抗体、MICA抗体采用免疫磁珠流式细胞仪液相芯片(Flow PRATM beads)检测,由美国One Lambda公司提供LABScreen○ R试剂,按照操作说明测定;用Luminex液相芯片分析平台及LABScreen○ R软件对检测结果进行分析。所有指标随访1年。
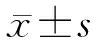
2 结 果
2.1 C4d与抗体的关系 C4d阳性者HLA抗体阳性率高于C4d阴性者(P<0.05);C4d阳性者与阴性者MⅠCA抗体阳性率差异无统计学意义(表1)。

表1 C4d与抗体的相关性 n(%)
*P=0.003与C4d(+)HLA抗体(-)相比
2.2 C4d、HLA抗体、MⅠCA抗体与病理形态的关系 急性病变中,C4d阳性者肾小球炎患者比例高于C4d阴性者(P<0.05);慢性病变中,C4d阳性者肾小球基底膜分层现象约高于C4d阴性者50%,但差异无统计学意义(表2)。急性病变中,HLA抗体阳性者血管炎患者比例高于HLA抗体阴性者(P<0.05);慢性病变中,HLA抗体阳性者动脉内膜增厚比例高于HLA抗体阴性者(P<0.05,表3)。MⅠCA阳性者与阴性者各病理形态患者比例差异无统计学意义(表4)。C4d、MⅠCA抗体均阳性或其中之一为阳性者病理类型与C4d、MⅠCA抗体均阴性者差异无统计学意义(表5)。
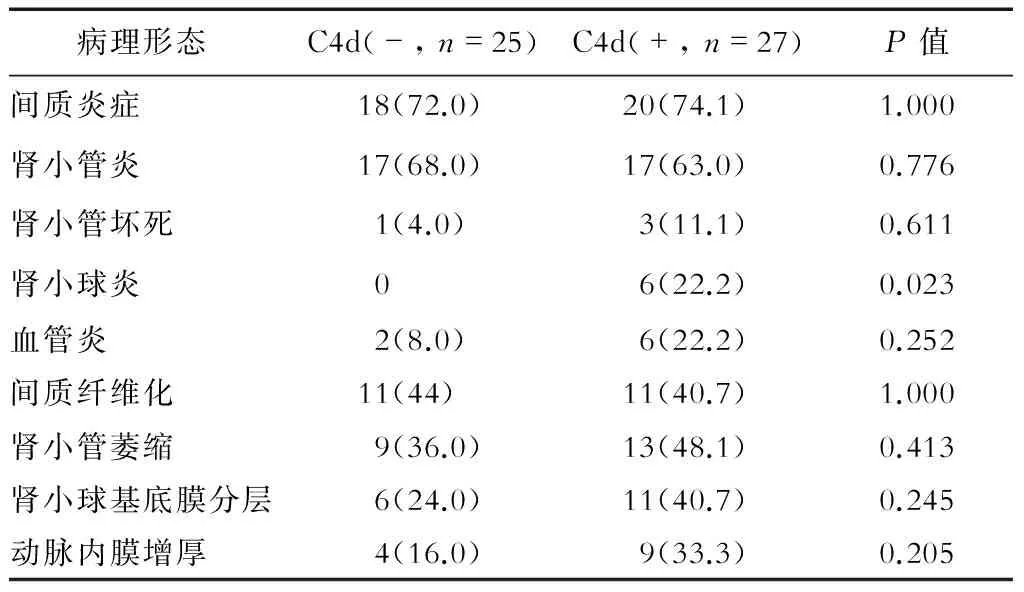
表2 C4d与病理形态的相关性 n(%)
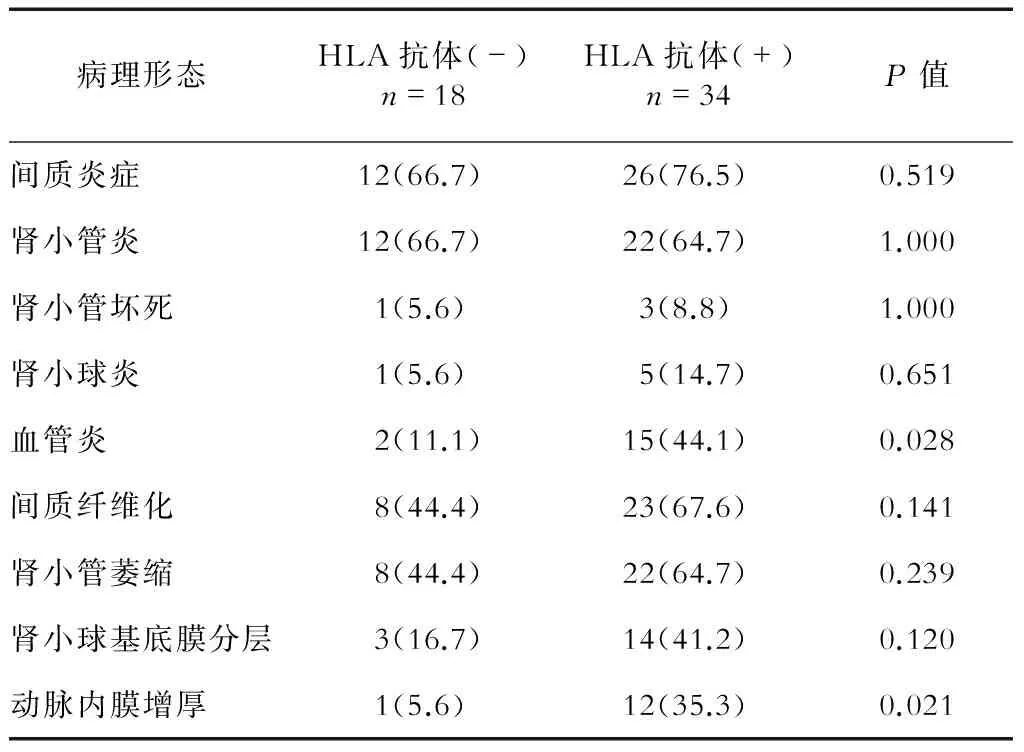
表3 HLA抗体与病理形态的相关性 n(%)
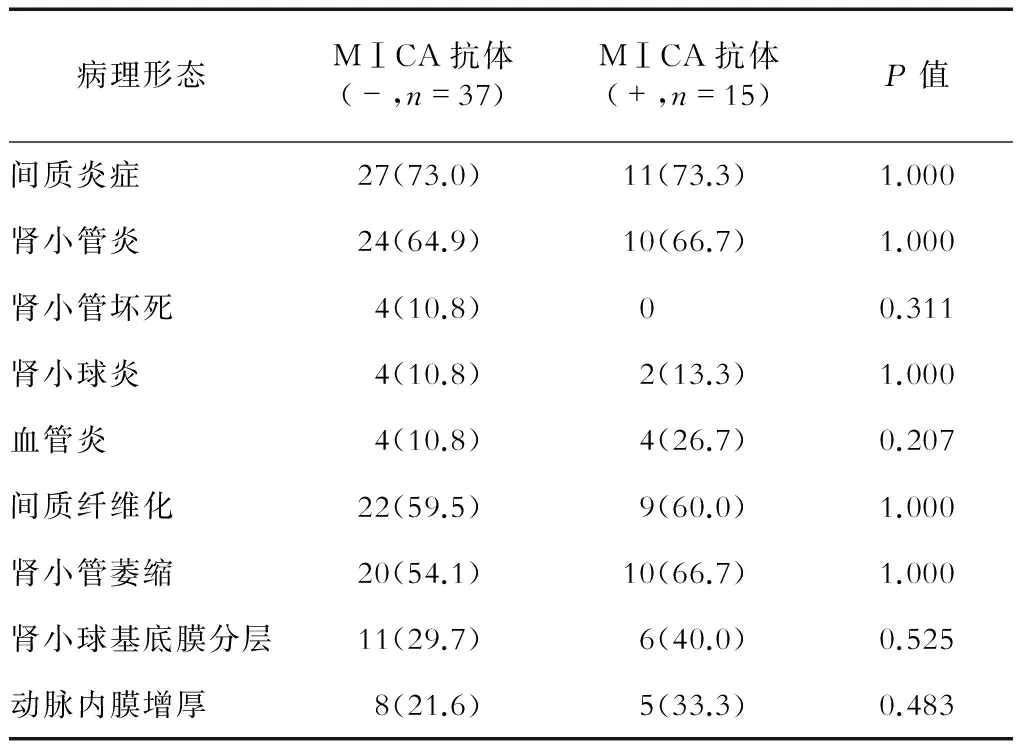
表4 MⅠCA抗体与病理形态的相关性 n(%)
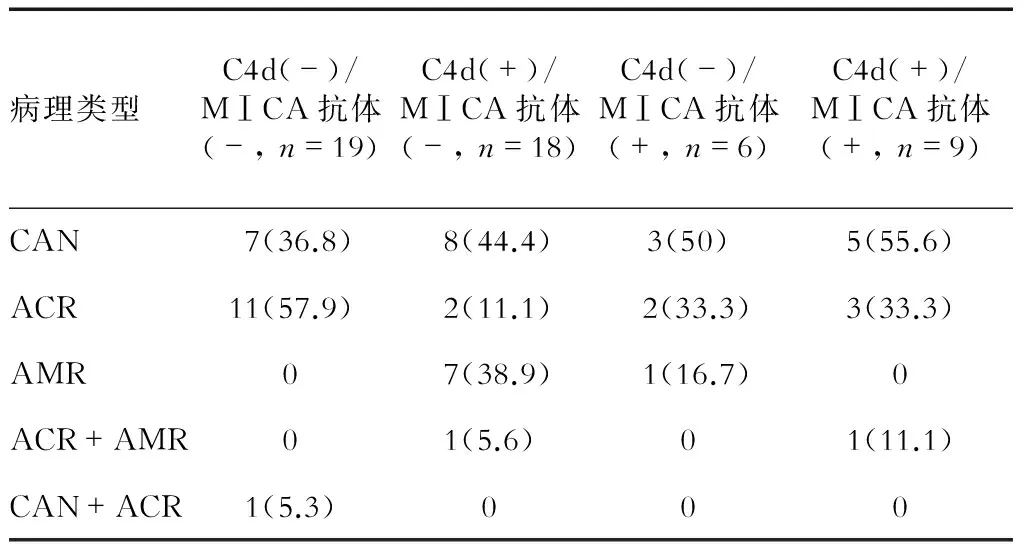
表5 C4d/MⅠCA抗体与病理类型的相关性 n(%)
CAN:慢性移植物肾病;ACR:急性细胞性排异;AMR:急性体液性排异
2.3 C4d、HLA抗体、MⅠCA抗体与GFR变化率的关系 C4d阳性者GFR下降[(-1.5±2.9)%]快于阴性者[(-0.65±2.4)%],但差异无统计学意义。C4d、HLA抗体均阳性或其中之一为阳性者GFR下降快于C4d、HLA抗体均阴性者(P<0.05);C4d、MⅠCA抗体均阳性或其中之一为阳性者GFR下降快于C4d、MⅠCA抗体均阴性者(P<0.05);C4d伴随外周血HLA或MⅠCA抗体阳性者较单独C4d阳性者GFR下降更明显(P<0.05,表6)。
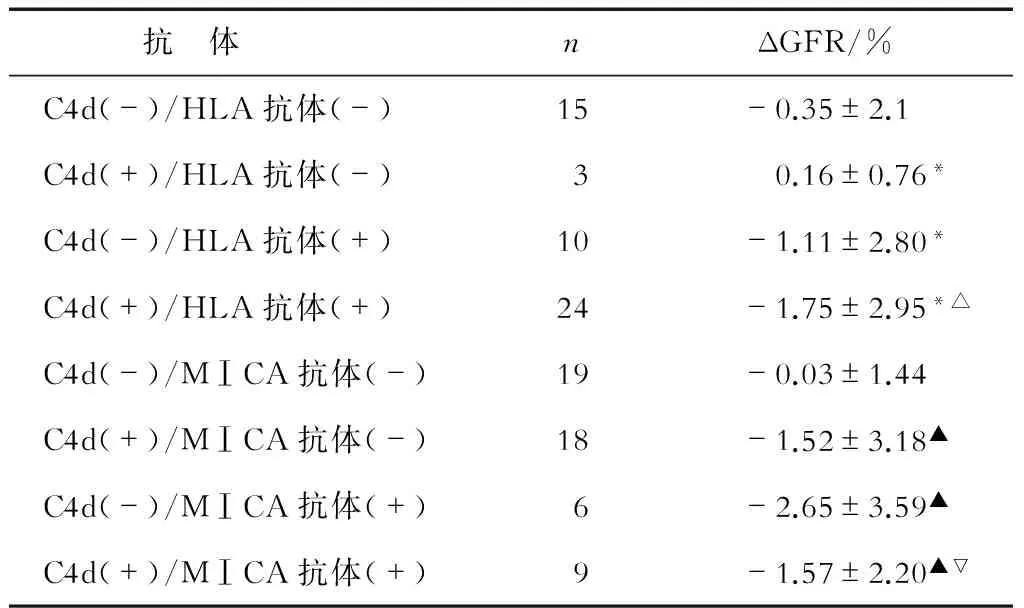
表6 C4d联合HLA抗体或MⅠCA抗体与GFR变化率的相关性
*P<0.05与C4d(-)/HLA抗体(-)者相比;△P<0.05与C4d(+)/HLA抗体(-)者相比;▲P<0.05与C4d(-)/MⅠCA抗体(-)者相比;▽P<0.05与C4d(+)/MⅠCA抗体(-)者相比
3 讨 论
C4d是补体经典激活途径活化产物C4b的裂解片段。C4d与内皮细胞紧密结合,因此可作为补体活化的标志。C4d在移植肾中沉积能独立表明受者体内发生了体液性同种异型反应,与移植肾体液性排异反应引起的各种组织病理学改变直接相关[1-4],故C4d被认为是抗原抗体反应的一个间接证据。由于补体由抗原抗体反应所激发,因此本研究探讨了C4d与HLA抗体、MⅠCA抗体的关系,以及三者对于移植肾功能的影响。
本研究肾移植患者中,C4d阳性者HLA抗体阳性率较C4d阴性者高,与以往研究[1-2]结论一致;但C4d阳性者MⅠCA抗体阳性率与C4d阴性者差异无统计意义,且MⅠCA抗体的存在与移植肾的病理类型的关系不明显。Zou等[3]的研究中,肾移植后MⅠCA抗体和和补体C4d的激活相关;而Alvarez等的研究[4]发现MⅠCA抗体阳性率在C4d阳性组(21%)与C4d阴性组(7.7%)差异无统计学意义。Chaudhuri等[5]的研究发现,肾移植患儿MⅠCA抗体阳性率为25%,且与急性体液性排异(AMR)和慢性体液性排异(CAMR)相关,但与C4d关系不明显。该现象的原因可能为MⅠCA的抗原性弱于HLA,激发的补体反应较弱,而传统的C4d测定方法较难检测出。Cai等[6]研究的975例肾移植患者中,44%患者因排异而肾脏失功,在这些患者血中检测出与C1q结合的MⅠCA抗体或HLA抗体,但只有部分MⅠCA抗体阳性的患者C4d阳性。此外,部分患者MⅠCA抗体可能是非致病性的,滴度较弱,且非针对供者,故补体不易被激活,与排异反应相关性不强。
本研究中,C4d阳性者肾小球炎患病率升高(P=0.023);C4d阳性者血管炎比例大于C4d阴性者,但差异无统计学意义。肾小球炎和血管炎均是急性体液性排异的一种病理形态。 Mauiyyedi等[7]发现,C4d阳性者有55%出现肾小球中性粒细胞浸润、20%出现肾小球坏死、25%出现血管炎,而C4d阴性者这些病变比例分别为4%、0、0。Nickeleit等[8]报道,C4d阳性者有57%出现肾小球炎、45%有血管炎表现。以往研究及本研究均反映了C4d和抗体介导的病理损害相关。本研究中,40%C4d阳性者出现基底膜分层,高于C4d阴性者(24%),但差异无统计学意义。目前,多数学者认为,在慢性体液性排异中,C4d和移植物肾病有关,而移植物肾病的病理表现主要为肾小球基底膜分层。 Herman等[9]在20例慢性移植物肾病活检标本中发现,50%有C4d阳性及移植物肾病改变。本研究中C4d阳性者和阴性者基底膜分层差异无统计学意义可能与样本量较小有关。
本研究中,HLA抗体阳性在移植肾急性病变中主要与血管炎,慢性病变中主要与小动脉内膜增厚相关。Alvarez-Márquez等[4]等发现,HLA-Ⅰ类抗体与血管内膜炎、纤维素样坏死有关。Sis等[10]报道,在慢性移植物肾病中,HLA-Ⅱ类抗体和移植物肾病有关。本研究虽然未区分HLA-Ⅰ类或Ⅱ类抗体,但发现HLA抗体与血管的急性和慢性病变相关。肾移植抗体的靶抗原主要在血管内皮细胞上,因而易导致血管病变。
本研究中,MⅠCA抗体阳性率与间质炎症、肾小球炎、肾小球坏死等急性病变,以及小管萎缩、间质纤维化等慢性表现差异均无统计学意义。因此推测在体液因素介导的排异中,可能以HLA抗体为主,MⅠCA抗体只在部分病例中起作用。而小样本研究可能导致结果偏倚,因此还需进一步扩大样本量证实MⅠCA抗体与病理形态的关系。
本研究还发现,单独C4d阳性与C4d阴性者相比,GFR的变化不甚明显。对于C4d和移植肾存活率的关系,有不少相反的报道。一项大型研究[11]将1 326次活检纳入分析,未发现C4d阳性与肾存活率的关系,但C4d阳性组患者免疫抑制强度较大,可能影响肾存活率。另有研究[12-13]认为,C4d阳性者肾脏存活率低。上述结论的差异可能与随访期有关,例如2007年一项研究[13-14]显示,部分C4d阳性肾移植患者没有病理学改变,但其长期转归没有定论。另一方面,目前设计的临床试验缺乏免疫抑制用药的随机对照,且医师会加强C4d阳性者的免疫抑制治疗。因此,C4d阳性与肾存活率的关系还需要前瞻性的随机对照试验来证实。
本研究以GFR变化率这个较敏感的指标反映移植肾功能的变化,发现单独C4d阳性与C4d阴性者GFR的变化不明显,而C4d联合HLA抗体或MⅠCA抗体阳性者GFR下降更明显。C4d阳性联合HLA、MⅠCA抗体阴性者GFR下降率不明显,说明外周血抗体的存在对移植肾长期存活率的预测作用优于单独C4d阳性。文献[15-16]报道,C4d阳性不仅在排异患者中出现,在程序性肾活检、ABO血型不相容的移植中也出现。因此,对于移植肾的预后,外周血抗体的预测作用可能更可靠。
综上所述,本研究发现,对于急性移植肾排异患者,伴HLA或MⅠCA抗体阳性较单独C4d阳性对移植肾的预后更有预测价值。然而,本研究为单中心小样本研究,且随访期较短,另外由于供体血标本未保存而无法检测供者特异性抗体(donor specific antibody,DSA)。因此,本研究存在一定的局限性,今后将扩大样本量,并对患者进行分层研究,以验证本研究结论。
[ 1 ] SERINSÖZ E, BOCK O, GWINNER W, et al. Local complement C3 expression is upregulated in humoral and cellular rejection of renal allografts[J]. Am J Transplant, 2005, 5(6): 1490-1494.
[ 2 ] MENGEL M, BOGERS J, BOSMANS J L, et al. Incidence of C4d stain in protocol biopsies from renal allografts: results from a multicenter trial[J] . Am J Transplant, 2005, 5(5): 1050-1060.
[ 3 ] ZOU Y, HEINEMANN F M, GROSSE-WILDE H, et al. Detection of anti-MICA antibodies in patients awaiting kidney transplantation, during the post-transplant course, and in eluates from rejected kidney allografts by Luminex flow cytometry[J]. Hum Immunol,2006, 67(3):230-237.
[ 5 ] CHAUDHURI A, OZAWA M, EVERLY M J, et al. The clinical impact of humoral immunity in pediatric renal transplantation[J]. J Am Soc Nephrol, 2013, 24(4): 655-664.
[ 6 ] CAI J, TERASAKI P I, ZHU D, et al. Complement-fixing antibodies against denatured HLA and MⅠCA antigens are associated with antibody mediated rejection[J]. Exp Mol Pathol, 2016, 100(1): 45-50.
[ 7 ] MAUIYYEDI S, COLVIN R B. Humoral rejection in kidney transplantation: new concepts in diagnosis and treatment[J]. Curr Opin Nephrol Hypertens,2002,11(6):609-618.
[ 8 ] NICKELEIT V, ZEILER M, GUDAT F, et al. Detection of the complement degradation product C4d in renal allografts: diagnostic and therapeutic implications[J]. J Am Soc Nephro, 2002. 13(1):242-251.
[ 9 ] HERMAN J, LERUT E, VAN DAMME-LOMBAERTS R, et al. Capillary deposition of complement C4d and C3d in pediatric renal allograft biopsies[J]. Transplantation, 2005, 79(10): 1435-1440.
[10] SIS B, CAMPBELL P M, MUELLER T, et al. Transplant glomerulopathy, late antibody-mediated rejection and the ABCD tetrad in kidney allograft biopsies for cause[J]. Am J Transplant, 2007, 7(7):1743-1752.
[11] SIS B, BAGNASCO S M, CORNELL L D, et al. Isolated endarteritis and kidney transplant survival: a multicenter collaborative study[J]. J Am Soc Nephrol,2015, 26(5):1216-1227.
[12] HAAS M, MIROCHA J, REINSMOEN N L,et al. Differences in pathologic features and graft outcomes in antibody-mediated rejection of renal allografts due to persistent/recurrent versus de novo donor-specific antibodies[J]. Kidney Int, 2017, 91(3):729-737.
[13] HOGEN R, DINORCIA J, DHANIREDDY K. Antibody-mediated rejection: what is the clinical relevance? [J]. Curr Opin Organ Transplant, 2017, 22(2):97-104.
[14] KIBERD B A, MILLER A, MARTIN S, et al. De novo donor-specific human leukocyte antigen antibody screening in kidney transplant recipients after the first year post-transplantation: a medical decision analysis[J]. Am J Transplant, 2016 ,16(11):3212-3219.
[15] MA J, PATEL A, TINCKAM K. Donor-specific antibody monitoring: where is the beef? [J]. Adv Chronic Kidney Dis, 2016, 23(5):317-325.
[16] RAY D S, THUKRAL S. Outcome of ABO-incompatible living donor renal transplantations: a single-center experience from Eastern India [J]. Transplant Proc, 2016, 48(8):2622-2628.

