基于单中心经导管主动脉瓣置换术治疗主动脉瓣狭窄初步临床疗效分析
李明飞, 潘文志, 张 蕾, 张晓春, 周达新, 葛均波
复旦大学附属中山医院心内科,上海市心血管病研究所,上海 200032
主动脉瓣狭窄是老年常见的心脏瓣膜疾病。在西方发达国家心血管疾病中,该病的发病率仅次于冠心病和高血压[1]。患者一旦出现症状,若不进行外科治疗,死亡率很高,1年和5年的生存率分别是60%、32%[2]。长期以来,主动脉瓣置换术是主动脉瓣狭窄公认的治疗金标准[3]。然而,近30%的老年患者因高龄、心功能差或合并症等原因不适合行开胸手术[4]。经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)是治疗主动脉瓣狭窄的新技术,国外一系列研究[5-8]证实,TAVR可改善症状、提高患者存活率 。复旦大学附属中山医院于2010年开展国内首例TAVR术[9],但目前国内TAVR发展较为缓慢,尚在起步阶段,相关报道及经验较少,缺乏TAVR在我国患者中安全性及有效性的相关数据。现对本中心前40例接受TAVR的老年主动脉瓣狭窄患者的短期结果进行分析和总结。
1 资料与方法
1.1 一般资料 选择在我院行TAVR的前40例患者。患者手术入选标准:(1)症状性的重度主动脉瓣狭窄,有效瓣口面积<1.0 cm2,平均跨瓣压差>40 mm Hg;(2)NYHA心功能分级≥Ⅱ级;(3)两名外科医师判断患者为外科手术高危或禁忌。排除标准:(1)冠脉计算机断层显像(CTA)显示解剖主动脉根部内径过大(40 mm以上);(2)预期寿命<12个月;(3)未处理的严重冠脉狭窄;(4)合并梗阻肥厚型心肌病;(5)常规心导管手术禁忌,如急性感染、心脏内血栓等。患者由内外科医师团队共同选择,明确外科瓣膜置换禁忌证、具有TAVR指征。所有入选患者优化药物治疗,积极改善心功能,完善超声心动图、X线电子计算机断层摄影术(CT)等检查,签署情知情同意书后施行介入治疗。本研究经医院伦理委员会审核批准。
1.2 手术方法 所有手术在静脉复合麻醉、超声心动图及血管造影(DSA)引导下进行。前面8例TAVR于普通导管室,之后32例TAVR在杂交手术室完成,外科医师常规术前准备。术前进行多排CTA,评估患者的血管入路及主动脉根部解剖情况,作为患者筛选、血管入路评估及瓣膜型号选择的主要依据。患者常规选择股动脉途径(36例);若股动脉途径不满足条件,则选用颈动脉途径(4例)。瓣膜均为自膨胀瓣膜,包括CoreVale(美国Metroinc,8例)及VitaFlow瓣膜(上海微创医疗器械有限公司,32例)。 常规使用6F Amplatz左冠导管为指引导管及直头超滑跨膜导丝。将超硬导丝塑形成圆圈状,以支撑扩张球囊及瓣膜输送系统。常规使用18~22 mm球囊对狭窄的主动脉瓣膜进行扩张。以猪尾导管最低点作为瓣环的参考线,自膨胀瓣膜释放前目标深度为瓣环下0~4 mm;瓣膜释放后若仍有中度及以上瓣周漏或跨瓣峰值压差大于20 mmHg,则使用球囊进行后扩张。具体手术操作步骤见本课题组既往发表的文献[10]。术前及术后3 d应用抗生素预防感染;术中予适量肝素,使活化凝血时间(ACT)维持在250~350 s;术毕注射鱼精蛋白中和肝素,将患者送至心内科重症监护病房,由固定医护小组管理。
1.3 观察指标 随访TAVR有效性及安全性,随访时间为30 d。有效性包括手术成功率、瓣膜功能情况;安全性包括全因死亡率及并发症发生率。并发症包括血管并发症(血肿、夹层、动静脉瘘)、感染、心肌梗死、瓣周漏、传导异常(房室传导阻滞、束支阻滞)和脑缺血事件(短暂脑缺血发作或卒中)等。
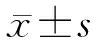
2 结 果
2.1 基线资料 40例TAVR患者中,男性27例,女性13例;年龄67~87岁,平均年龄(78.3±5.0)岁。40例患者心功能Ⅱ级12例,Ⅲ级18例,Ⅳ级10例;二叶式主动脉瓣18例,三叶式主动脉瓣22例;轻度主动脉瓣反流9例,中度主动脉瓣反流5例,重度主动脉瓣反流1例,余25例无明显主动脉瓣反流;10例主动脉瓣环轻度钙化,余30例无明显钙化。40例患者美国胸外科医师学会(STS)评分为(8.4±3.8)分,欧洲心脏手术危险因素评价系统(Euroscore)评分(3.4±1.8)分;左心室射血分数平均(56.7±12.4)%;主动脉瓣跨瓣压差40~109 mmHg(1 mmgHg=0.133 kPa),平均主动脉瓣跨瓣压差(61.8±18.6) mmgHg;主动脉瓣环内径(19.8±4.2)mm,主动脉瓣窦宽(25.3±4.7)mm,升主动脉内径(33.3±5.7)mm。
2.2 围手术期结果 所有患者均完成手术,手术成功率100%。术中无患者死亡。2例患者术中出现心脏骤停,经心肺复苏快速释放瓣膜后,生命体征恢复,康复出院。1例患者术中出现急性右冠脉堵塞,导致心率减慢、血压降低,立即急诊冠脉搭桥后病情稳定,康复出院。1例患者经颈动脉途径,释放后瓣膜脱落至升主动脉,转为外科手术取出瓣膜并行外科主动脉瓣置换术,术后出现脑梗死,经治疗后康复出院。1例患者出现顽固性心包积液、心包填塞,经外科手术后康复出院。1例患者术中出现主动脉夹层,由于年龄较大(89岁),未行外科手术、选择保守治疗,于术后第7天死亡。3例患者因Ⅲ度房室传导阻滞置入永久心脏起搏器。4例患者出现完全性左束支传导阻滞,2例患者出现Ⅰ度房室传导阻滞。3例患者术后1~2 d发热,经抗感染后好转。术后患者平均主动脉瓣跨瓣压差下降[(10.7±3.9) mmHgvs(61.8±18.6) mmHg,P<0.001],平均瓣口面积增加[(1.80±0.24) cm2vs(0.65±0.17) cm2,P<0.001]。术后未见瓣膜反流,12例患者有轻度瓣周漏,1例患者为中度瓣周漏,无重度瓣周漏(表1)。
2.3 短期随访 术后30 d随访,患者美国纽约心脏病学会(NYHA)心功能分级较术前明显改善(1.80±0.62vs2.95±0.75,P<0.001)。1例患者出院后第3天出现晕厥,心电监护显示为间歇性Ⅲ度房室传导阻滞,后置入永久心脏起搏器;其他患者未见并发症。10例患者有轻度瓣周漏,无中度及中度以上瓣周漏。左心室射血分数、平均主动脉瓣跨瓣压差、主动脉瓣口面积、瓣周漏与术后1 d差异无统计学意义(表1)。
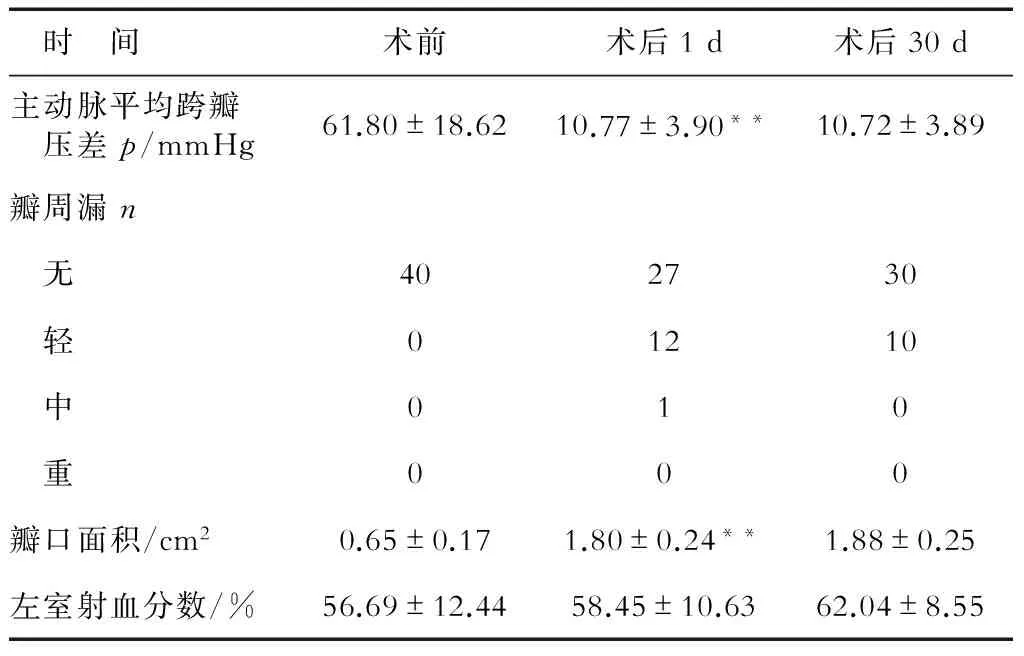
表1 手术前后心脏超声检查结果对比
**P<0.001与术前相比
3 讨 论
TAVR是目前心血管介入领域的热门新技术,适用于因高龄、心功能低下、合并多脏器功能不全等外科禁忌证而不能施行常规外科瓣膜置换手术的主动脉瓣狭窄患者。目前国内外指南[11-13]推荐外科手术禁忌或高危的主动脉瓣狭窄患者为TAVR适应证 。TAVR在欧美国家迅速发展,目前在某些中心已成为常规治疗手段。自2010年10月国内进行首例人体TAVR以来[9],该技术也逐步在国内推广。然而,目前国内完成病例总量仍较少,缺乏较大样本的研究报道,其安全性及有效性的证据不足。本研究为目前国内最大样本量的研究[14-15]之一。
本研究纳入我中心前40例施行TAVR治疗的患者,平均年龄(78.3±5.0)岁,STS评分(8.4±3.8)分,心功能Ⅱ级12例、Ⅲ级18例、Ⅳ级10例。患者总体病情严重,为外科手术禁忌或高危。本研究中手术成功率100%,术中无患者死亡;术后30 d内死亡率为2.5%。 此外,1例患者出现急性右冠脉堵塞,1例患者出现瓣膜脱落及脑埂死,1例患者出现顽固性心包积液、心包填塞,患者经积极治疗后均康复出院。本研究结果与目前国际上已有的最有影响力的几项大型随机对照研究[7,16]结果相似。研究[16]显示,CoreValve高危患者平均年龄为(83.2±7.1)岁,平均STS评分(7.3±3.0)%,30 d死亡率为3.3%。在PARTNER-A研究[7]中,患者平均年龄为(83.6±6.8)岁,STS评分(11.8±3.3)%,30 d死亡率为3.4%。上述结果提示,TAVR在我国主动脉瓣狭窄患者中有较高的安全性。
心脏传导异常是目前TAVR患者最常见的并发症,患者需要置入永久性心脏起搏器。各研究报道的因新发传导异常需植入起搏器的发生率不一(4%~30%),尤其是植入自膨胀瓣膜患者,其植入心脏起搏器的概率(20%~40%)明显高于球囊扩张瓣膜的患者(4%~10%)[10]。CoreValve高危患者研究[16]中,术后30 d植入心脏起搏器的概率为19.8%;CoreValve 极高危患者研究[17]中,术后30 d植入心脏起搏的概率为21.6%。本研究中术后30 d内植入永久起搏器4例 (10%),原因均为Ⅲ度房室传导阻滞。其结果优于目前国内外多数研究报道,可能与本研究采取高位释放的策略有关,瓣膜释放前目标深度为瓣环下0~4 mm,而一般要求瓣膜目标深度为6 mm(甚至10 mm)[18]。本研究中,4例患者出现完全性左束支传导阻滞,2例患者出现Ⅰ度房室传导阻滞,均不需立即植入心脏起搏器,但应加强随访[18-19]。
本研究发现,瓣膜置换术后1 d平均主动脉瓣跨瓣压差由(61.8±18.6)mmHg降至(10.7±3.9)mmHg,未出现新发瓣膜反流或反流程度加重,与既往研究[6-8]一致。术后1 d有1例中度瓣周漏,12例轻度瓣周漏;术后30 d,1例中度瓣周漏转为轻度瓣周漏,3例轻度瓣周漏患者瓣周漏消失。既往研究[20]也显示,自膨胀瓣膜随着时间延长瓣周漏有改善趋势。术后30 d,患者NYHA心功能分级较术前明显改善(P<0.001)。上述结果显示,TAVR对我国患者的疗效较好。
综上所述,本研究单中心、前40例TAVR结果显示,TAVR对我国外科手术禁忌或高危的主动脉瓣狭窄患者具有较好的安全性及有效性。此外,本研究中,18例(45%)患者为二叶式主动脉瓣,提示我国二叶式主动脉瓣患者行TAVR安全有效,与研究[15]结果相似。
[ 1 ] IUNG B, BARON G, BUTCHART E G, et al. A prospective survey of patients with valvular heart disease in Europe: the Euro Heart Survey on Valvular Heart Disease[J]. Eur Heart J, 2003, 24(13):1231-1243.
[ 2 ] VARADARAJAN P, KAPOOR N, BANSAL R C, et al. Clinical profile and natural history of 453 nonsurgically managed patients with severe aortic stenosis[J]. Ann Thorac Surg, 2006, 82(6):2111-2115.
[ 3 ] VAHANIAN A, BAUMGARTNER H, BAX J, et al. Guidelines on the management of valvular heart disease: the Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology[J]. Eur Heart J, 2007, 28(2):230-268.
[ 4 ] IUNG B, CACHIER A, BARON G, et al. Decision-making in elderly patients with severe aortic stenosis: why are so many denied surgery?[J]. Eur Heart J, 2005, 26(24):2714-2720.
[ 5 ] BEKEREDJIAN R, KRUMSDORF U, CHORIANOPOULOS E, et al. Usefulness of percutaneous aortic valve implantation to improve quality of life in patients> 80 years of age[J]. Am J Cardiol, 2010, 106(12): 1777-1781.
[ 6 ] LEON M B, SMITH C R, MACK M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery[J]. N Engl J Med, 2010, 363(17): 1597-1607.
[ 7 ] SMITH C R, LEON M B, MACK M J, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients[J]. N Engl J Med, 2011, 364(23): 2187-2198.
[ 8 ] MAKKAR R R, FONTANA G P, JILAIHAWI H, et al. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis[J]. N Engl J Med, 2012, 366(18): 1696-1704.
[ 9 ] 葛均波, 周达新, 潘文志, 等. 经皮主动脉瓣植入术一例及其操作要点[J].中国介入心脏病杂志, 2010,18(5): 243-246.
[10] 葛均波, 周达新, 潘文志, 等. 经导管主动脉瓣置入术的初步经验[J]. 中华心血管病杂志, 2011, 39(11):989-992.
[11] NISHIMURA R A, OTTO C M, BONOW R O, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol, 2014,63(22):2438-2488.
[12] VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)[J]. Eur J Cardiothorac Surg, 2012,42(4):S1-S44.
[13] 中国医师协会心血管内科医师分会结构性心脏病专业委员会,中华医学会心血管病学分会结构性心脏病学组. 经导管主动脉瓣置换术中国专家共识[J]. 中国介入心脏病学杂志, 2015, 23(12): 661-666.
[14] 陈 茂, 冯 沅, 唐 红, 等. 经导管主动脉瓣植入术治疗重度主动脉瓣狭窄患者的初步经验[J].中国介入心脏病学杂志, 2014, 22(9):558-562.
[15] LIU X B, JIANG J B, ZHOU Q J, et al. Evaluation of the safety and efficacy of transcatheter aortic valve implantation in patients with a severe stenotic bicuspid aortic valve in a Chinese population[J]. J Zhejiang Univ Sci B, 2015,16(3):208-214.
[16] KAUL S. Transcatheter aortic-valve replacement with a self-expanding prosthesis[J].N Engl J Med, 2014,370(10):967.
[17] POPMA J J, ADAMS D H, REARDON M J, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery[J]. J Am Coll Cardiol, 2014,63(19):1972-1981.
[18] NUIS R J, VAN MIEGHEM N M, SCHULTZ C J, et al. Timing and potential mechanisms of new conduction abnormalities during the implantation of the Medtronic CoreValve System in patients with aortic stenosis[J]. Eur Heart J, 2011, 32(16):2067-2074.
[19] NAZIF T M, WILLIAMS M R, HAHN R T, et al. Clinical implications of new-onset left bundle branch block after transcatheter aortic valve replacement: analysis of the PARTNER experience[J]. Eur Heart J, 2014, 35(24):1599-1607.
[20] KANEKO H, HOELSCHERMANN F, TAMBOR G, et al. Predictors of paravalvular regurgitation after transcatheter aortic valve implantation for aortic stenosis using new-generation balloon-expandable SAPIEN 3[J]. Am J Cardiol, 2017, 119(4):618-622.

