LY294002通过PI3K/Akt/mTOR对CD133+CD44+结直肠癌干细胞自我更新、增殖能力的影响
伊纪瑛,唐晨曦,章淑芳,李孝琼,陈政儒,李佳丽,夏金蓉,李思宇,冷政伟
(1.南充市中心医院肿瘤科;2.川北医学院肝胆胰肠疾病研究所,四川 南充 637000)
结直肠癌(colorectal cancer,CRC)发病率和死亡率在我国恶性肿瘤中排名第五;在美国已跃居第三,居消化系统肿瘤第一位;CRC患者中40%~50%在初诊时已有远处转移,即使接受了根治性手术切除和规范放化疗,最终仍然有50%以上转移复发,肿瘤耐药、转移复发是CRC的主要死因[1-2]。研究证实,能够耐受治疗的细胞由肿瘤干细胞(cancer stem cells,CSCs)组成,CSCs数量十分稀少甚至无法检测,但其强大的自我更新、增殖能力最终介导了肿瘤的转移复发,因此,CSCs已经成为探索治疗肿瘤最重要的靶点之一[3-5]。科学家主要通过标记CD133、CD44、CD166、EpCAM、Lgr5、ALDH、SP等标识来分析分选CRC-CSCs[6]。PI3K/Akt/mTOR通路激活后具有促进细胞增殖、抗凋亡、促进血管生成及转移作用,已经成为肿瘤研究的热点,但PI3K/Akt/mTOR通路在维持CRC-CSCs自我更新、增殖过程中的作用未见报道。本课题首先分选CD133+CD44+的CRC-CSCs,将PI3K/Akt/mTOR通路抑制剂作用于CSCs,以研究此通路在人CRC-CSCs自我更新、增殖过程中的作用及机制。
1 材料和方法
1.1 材料
人结直肠癌HCT116细胞系、McCoy’s 5A培养基均购自美国模式菌种收集中心(ATCC);胎牛血清(FBS)及DMEM/F12培养基购自美国Hyclone公司;LY394002、牛血清白蛋白(BSA)、7-AAD、B27及胰岛素购自美国Sigma公司;人表皮细胞生长因子(EGF)及碱性成纤维细胞生长因子(bFGF)购自美国Pepro-Tech公司;CCK-8试剂盒购自日本同仁化工公司;PI3K/Akt/mTOR通路一抗及二抗均购自美国Santa Cruz公司;CD133-PE及CD44-FITC流式细胞术(FCM)抗体及相关试剂购自德国美天妮公司;转录因子流式细胞术检测试剂盒购自美国BD公司。
1.2 结直肠癌CD133+CD44+肿瘤干细胞分选
人结直肠癌HCT116细胞用含10% FBS的McCoy’s 5A培养基培养于37 ℃ 5%CO2细胞培养箱中。常规消化细胞,悬浮1×106细胞于100 μL 缓冲液中,分别加入3 μL CD133-PE及CD44-FITC抗体,4 ℃避光孵育30min,上机前7-AAD室温孵育10min以利分选时去除死细胞,然后上机分选(BD FACSAria Fusion),分选获得CD133+CD44+及CD133-CD44-细胞,细胞分别培养于含20 ng/mL EGF、10 ng/mL bFGF、5 μg/mL 胰岛素、0.4% BSA及2% B27的无血清DMEM/F12培养基中,然后进行CD133+CD44+细胞CSCs特征鉴定,细胞培养箱中培养2 d后进行后续实验。
1.3 细胞活性计数法检测LY294002对CSCs增殖能力的影响
细胞活性计数法(CCK-8):取5×103细胞/孔接种于96孔板中,实验组用LY294002(10、20、30 μmol/L)、对照组不使用LY294002,细胞培养箱中培养3 d后加入CCK-8试剂,在450 nm波长处读吸光度值(OD),绘制生长曲线,抑制率(%)=(1-OD实验组/OD对照组×100%)。
1.4 成球实验、细胞周期检测及平板克隆实验
实验流程参考本课题组发表论文[7],成球实验及平板克隆实验中接种5×103细胞于相应6孔板中,2周后收集数据行统计学分析。
1.5 有限浓度稀释法
细胞以每孔不同浓度(0.5、1、1.5、2个细胞/孔)接种于96孔板中培养2 周后记录每孔中细胞球数量,阴性孔比例与细胞稀释浓度作图并进行线性回归分析,计算CSCs比例[8]。
1.6 实时定量PCR检测PI3K/Akt/mTOR通路基因mRNA表达
实验步骤参考课题组发表论文[7],引物序列如下:
GAPDH-F:5′-GGGGAGCCAAAAGGGTCATCATCT-3′,
GAPDH-R:5′ GACGCCTGCTTCACCACCTTCTTG-3′;
CyclinD1-F:5′-TACCGCACAACGCACTTTC-3′,
CyclinD1-R:5′-AAGGGCTTCAATCTGTTCCTG-3′;
mTOR-F:5′-CGCTGCCCCTTTATCG-3′,
mTOR-R:5′-GGTGGAGGTGTTTGAGCAT-3′;
Bcl-2-F:5′-GTGAGAAGTGAGGGACCTTTATG-3′,
Bcl-2-R:5′-CACTCATTAGCCATATCCAACTTG-3′;
DcR3-F:5′-TTCTGCTTGGAGCACGCATCG-3′,
DcR3-R:5′-ACGCAGCTTCAGCTGCAAGG-3′。
1.7 FCM检测PI3K/Akt/mTOR通路蛋白质表达
按照BD流式细胞术转录因子检测试剂盒说明书在室温下作用40 min以固定及通透3×105细胞,1/100稀释的一抗在4 ℃避光作用4 h,漂洗后以1/100稀释的荧光素标记二抗37 ℃作用30 min,不加一抗只加入二抗组设置为流式细胞术同型对照,漂洗后细胞悬浮于200 μL 孵育液中上机检测。FCM数据采用FlowJo version 10.0分析,蛋白质相对表达量多少由荧光强度比(RFI)大小表示,RFI=样本平均荧光强度/同型对照平均荧光强度[9-10]。
1.8 统计学分析
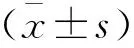
2 结果
2.1 CD133+CD44+肿瘤干细胞特征的鉴定
成球实验是CSCs体外鉴定的一个重要方法,检测细胞自我更新能力。成球实验数据显示:CD133+CD44+与CD133-CD44-细胞成球数量分别为375±16.82,11±4.58(t=36.16,P<0.01),提示CD133+CD44+可以作为CRC-CSCs的研究模型。
2.2 LY294002对CSCs增殖能力的影响
CCK-8数据显示,CSCs增殖能力随LY294002浓度及作用时间增加而逐渐削弱,30 μmol/L LY294002组作用3 d后,CSCs增殖抑制率为(53.9±4.12)%,根据实验结果取30 μmol/L组作为实验组进行后续实验。
与CCK-8数据相吻合,实验组与对照组体外克隆数分别为25.67±4.16,390.67±17.01,(t=36.10,P<0.01),以上数据显示,LY294002对CSCs的增殖具有明显的抑制作用。
2.3 LY294002对CSCs自我更新能力的影响
成球实验显示,实验组与对照组细胞球数量分别为15.67±4.04,370±17.69,(t=33.82,P<0.01);LDA实验显示,实验组与对照组CSCs比例分别为(12.75±2.04)%,(66.02±2.47)%,(t=28.77,P<0.01);以上数据提示实验组CSCs自我更新能力受到明显削弱。
2.4 LY294002对CSCs细胞周期的影响
FCM数据显示,实验组与对照组G0G1细胞比例分别为79.65±2.41,66.22±3.71,(t=5.26,P<0.01);G2M比例分别为10.52±0.80,11.38±2.11,(t=0.65,P>0.05);S期比例分别为9.83±1.66,22.46±1.65,(t=9.33,P<0.01);数据显示,LY294002导致了CSCs G0G1期细胞周期阻滞,从而影响细胞的分化及增殖能力。
2.5 LY294002对CSCs中PI3K/Akt/mTOR通路基因mRNA表达的影响
qRT-PCR结果显示,实验组诱骗受体3(DcR3)(t=15.38,P<0.01)、B淋巴细胞瘤-2(Bcl-2)(t=27.61,P<0.01)、哺乳动物雷帕霉素靶蛋白(mTOR)(t=11.68,P<0.01)及细胞周期蛋白D1(Cyclin D1)(t=11.96,P<0.01)相对表达明显下降。提示LY294002可能通过抑制PI3K/Akt/mTOR通路调控CSCs恶性行为。
2.6 LY294002对CSCs中PI3K/Akt/mTOR通路基因蛋白质表达的影响
为了进一步验证及明确LY294002通过PI3K/Akt/mTOR通路调控CSCs的具体机制,通过FCM检测该通路基因蛋白质表达及磷酸化Akt(p-Akt)表达变化。数据显示,实验组中DcR3(t=11.53,P<0.01)、Bcl-2(t=13.54,P<0.01)、mTOR(t=10.66,P<0.01)及Cyclin D1(t=9.21,P<0.01)蛋白表达量明显下降。Akt磷酸化蛋白表达下降(t=7.10,P<0.01),提示LY294002可能通过抑制磷酸化Akt进而抑制PI3K/Akt/mTOR通路,削弱CSCs的恶性行为。
3 讨论
CSCs是存在于肿瘤中极小群(甚至无法检测)具有强大自我更新及成瘤能力的细胞,CSCs具有干细胞特征,对传统放化疗不敏感,最终介导了肿瘤的耐药、转移复发[11]。探索CSCs维持自我更新、增殖能力的内在机制以靶向杀伤CSCs,已经成为肿瘤研究的难点和热点[12]。但CSCs比例极少,获取足够的细胞并保证细胞模型的正确性就显得尤为重要。目前获取CSCs的方法主要包括:无血清悬浮培养法,免疫磁珠分选法(MACS)及流式细胞术分选(FACS)法,前两种方法操作简单、成本低,但获得CSCs纯度较低。FACS获得的细胞纯度高可以作为CSCs理想的研究模型,但其技术难度高、操作复杂,应用并不广泛[13-14]。本课题组结合前期研究基础,FACS获得CD133+CD44+及CD133-CD44-细胞群,并通过成球实验检测其自我更新能力,证明CD133+CD44+具有CSCs特征,而CD133-CD44-细胞不具有。Zhou等[6]研究也证明HCT116细胞中的CD133+CD44+细胞具有强大的自我更新、增殖及侵袭转移能力,具有CSCs特征。以上数据显示CD133+CD44+细胞可以作为CRC-CSCs研究理想的细胞模型,并用于本研究,并进一步研究PI3K/Akt/mTOR通路在维持CSCs恶性行为中的作用。
PI3K/Akt/mTOR通路被报道在包括CRC在内的多种肿瘤中异常激活,参与肿瘤血管生成、增殖、抗凋亡及侵袭转移过程,此通路的激活与肿瘤低分化、高浸润度及淋巴转移正相关[15]。PI3K磷酸化PIP2形成PIP3,继而磷酸化激活下游Akt等促进细胞恶性行为。激活的Akt能够上调Cyclin D1、c-myc等促进增殖;同时激活的Akt上调mTOR促进细胞生长;上调VEGF促进血管生成;另外,激活的Akt通过激活Bcl-2发挥抗凋亡效应[16]。目前PI3K/Akt/mTOR通路在普通肿瘤细胞或肿瘤群体细胞中研究较多,但在决定肿瘤进展的关键—CSCs中研究未见报道。本课题组前期研究已经证实CSCs与非CSCs在基因表达及功能、生物学行为方面存在巨大差异,CSCs数量极少甚至无法检测,基因在CSCs中的功能可能会被大量的非CSCs所掩盖和干扰,治疗策略无法靶向杀灭CSCs,最终导致CSCs存活及由此介导的肿瘤耐药、转移复发[7]。所以,研究并靶向作用CSCs维持恶性行为的分子机制可能是肿瘤治疗的关键[12]。因此本课题在前期研究基础上,在纯化的CRC-SCs中研究此通路对肿瘤恶性行为的影响及机制。
LY294002是强力的PI3K/Akt/mTOR通路抑制剂,通过非特异性阻断通路导致Akt磷酸化水平下降,进一步抑制下游基因Cyclin D1、mTOR、Bcl-2、DcR3、VEGF等表达,导致细胞凋亡增加、增殖及侵袭迁移能力下降[17]。本研究发现,LY294002作用CSCs后,PI3K/Akt/mTOR通路被抑制,Akt磷酸化水平降低并导致下游靶基因的mRNA和蛋白质表达下降,CSCs的自我更新能力、增殖能力明显削弱,出现G0G1期周期阻滞。传统的蛋白质检测多采用Western-blot技术,但是其检测周期长、所需样本量较大、对磷酸化蛋白检测准确性不高,用于检测极少量的CSCs中蛋白质的表达非常困难。本研究采用FCM检测蛋白质,具有操作时间短、所需样本少、对磷酸化蛋白检测更加准确的优势,非常有利于检测CSCs中磷酸化蛋白的表达[9-10]。
本研究首次发现LY294002可以通过抑制PI3K/Akt/mTOR通路削弱CSCs的自我更新能力,这一作用未见其他研究团队报道。自我更新是指CSCs通过对称或者不对称分裂产生新的CSCs及各种肿瘤细胞,自我更新能够维持CSCs多分化潜能,是肿瘤存活、治疗抵抗、转移复发的关键,深入研究CSCs自我更新机制,对于开发靶向杀伤CSCs的药物及治疗策略具有重要意义。但本研究提示的LY294002可以通过抑制PI3K/Akt/mTOR通路调控CSCs自我更新能力的机制需要进一步研究。以上研究提示,LY294002可以阻断PI3K/Akt/mTOR通路激活进而抑制CRC-CSCs自我更新、增殖,表明阻断该通路可能有效抑制CSCs恶性行为,为靶向杀灭CSCs提供新的靶点。
[1] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[3] 吴安琪,曙光,王晶,等.癌症干细胞特性及靶向治疗进展[J].转化医学电子杂志,2017,4(9):1-8.
[4] 高兆亚,王延召,雷福明,等.结直肠癌基因治疗进展[J].转化医学电子杂志,2017,4(9):55-58.
[5] Zeuner A,Todaro M,Stassi G,etal.Colorectal cancer stem cells:from the crypt to the clinic[J].Cell Stem Cell,2014,15(6):692-705.
[6] Zhou JY,Chen M,Ma L,etal.Role of CD44(high)/CD133(high) HCT-116 cells in the tumorigenesis of colon cancer[J].Oncotarget,2016,7(7):7657-7666.
[7] Leng Z,Tao K,Xia Q,etal.Kruppel-like factor 4 acts as an oncogene in colon cancer stem cell-enriched spheroid cells[J].PLoS One,2013,8(2):e56082.
[8] Reynolds BA,Weiss S.Clonal and population analyses demonstrate that an EGF-responsive mammalian embryonic CNS precursor is a stem cell[J].Dev Biol,1996,175(1):1-13.
[9] Grafone T,Palmisano M,Nicci C,etal.Monitoring of FLT3 phosphorylation status and its response to drugs by flow cytometry in AML blast cells[J].Hematol Oncol,2008,26(3):159-166.
[10] Bardet V,Tamburini J,Ifrah N,etal.Single cell analysis of phosphoinositide 3-kinase/Akt and ERK activation in acute myeloid leukemia by flow cytometry[J].Haematologica,2006,91(6):757-764.
[11] De Angelis ML,De Maria R,Baiocchi M.How to Assess Drug Resistance in Cancer Stem Cells[J].Methods Mol Biol,2018,1692:107-115.
[12] Ahmad G, Amiji MM. Cancer stem cell-targeted therapeutics and delivery strategies[J]. Expert Opin Drug Deliv, 2017, 14(8): 997-1008.
[13] Mehta P,Novak C,Raghavan S,etal.Self-Renewal and CSCs In Vitro Enrichment:Growth as Floating Spheres[J].Methods Mol Biol,2018,1692:61-75.
[14] Lawson DA,Bhakta NR,Kessenbrock K,etal.Single-cell analysis reveals a stem-cell program in human metastatic breast cancer cells[J].Nature,2015,526(7571):131-135.
[15] Qian DC,Xiao X,Byun J,etal.PI3K/Akt/mTOR Signaling and Plasma Membrane Proteins Are Implicated in Responsiveness to Adjuvant Dendritic Cell Vaccination for Metastatic Colorectal Cancer[J].Clin Cancer Res,2017,23(2):399-406.
[16] Bahrami A,Khazaei M,Hasanzadeh M,etal.Therapeutic Potential of Targeting PI3K/AKT Pathway in Treatment of Colorectal Cancer:Rational and Progress[J].J Cell Biochem,2017,119(8):1979.
[17] Wang XJ,Feng CW,Li M.ADAM17 mediates hypoxia-induced drug resistance in hepatocellular carcinoma cells through activation of EGFR/PI3K/Akt pathway[J].Mol Cell Biochem,2013,380(1-2):57-66.

