沉默ANK2基因表达对胃癌细胞增殖、周期以及转移能力的影响
王翠艳,王志伟
1.濮阳市人民医院消化一科,河南 濮阳 457000; 2.郑州大学第一附属医院腔内血管外科
胃癌是常见的消化系统恶性肿瘤,其5年生存率较低。近年来,随着人们生活方式的改变、人口老龄化的加快、空气污染的加剧等,胃癌的发病率逐渐上升。研究[1-2]表明,胃癌的死亡率占肿瘤死亡的第2位,严重危害人类的生命安全。据统计,2017年美国胃癌的新增病例约2.8万,新增死亡人数约1万,占肿瘤发病率和死亡率的第1位和第2位[3]。研究统计表明,2015年中国胃癌新增病例约73万,新增死亡人数约61万[4]。目前胃癌的主要治疗方法是手术结合放化疗,但因胃癌早期症状不明显以及缺乏早期诊断的标志物,大部分的胃癌患者发现时已是晚期,导致胃癌患者预后差,5年生存率低。大量的研究[5-6]表明,癌症的发生、发展受多种因素的影响,例如基因的突变、缺失、表达失调均可引起细胞恶性增殖、侵袭、迁移紊乱等。因此,寻找新的生物学靶基因位点成为目前研究的热点之一。ANK2是一种细胞支架蛋白,属于锚蛋白家族(Ankyrins, ANKs)的成员之一,广泛表达于机体的各个组织。近年来的研究[7]证实,锚蛋白家族参与肿瘤的发生、发展过程。但ANK2在胃癌中的研究较少,因此本研究通过siRNA特异性沉默ANK2基因表达,观察其表达量降低对胃癌SGC-7901细胞的增殖、侵袭、细胞周期的影响,为胃癌诊断治疗以及分子机制的研究提供新的思路。
1 材料与方法
1.1实验材料人胃癌细胞系SGC-7901购自中科院细胞库,胎牛血清、RPMI-1640培养基购自美国Gibco公司,CCK-8细胞增殖检测试剂盒、脂质体Lipofectamine 2000、周期检测试剂盒、Annexin V-FITC/PI凋亡检测试剂盒、流式细胞仪、Matrigel胶均购自美国BD公司,细胞培养板、Transwell小室均购自美国Corning公司,ANK2抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体购自美国Sigma公司,辣根过氧化物酶标记的二抗购自北京联科生物公司,低温离心机购自德国Eppendorf公司,酶标仪购自瑞士Tecan公司。
1.2方法
1.2.1 细胞的培养:采用质量浓度为750 g/L的酒精提前处理实验试剂和耗材,超净工作台紫外灯照射30 min;将冻存与液氮中的SGC-7901细胞系快速放入37 ℃水浴箱中,摇匀,采用3 ml滴管吹匀细胞,加入8 ml RPMI-1640培养基,采用质量浓度为100 g/L的胎牛血清和双抗,混匀离心,弃上清,加入5 ml完全培养基重悬细胞,在体积分数为5%的CO2、37 ℃细胞培养箱中培养。当细胞融合度70%~80%时,采用质量浓度为2.5 g/L胰酶消化细胞,加入新鲜培养基制成单细胞悬液后置于培养瓶中培养。
1.2.2 细胞的转染:以新鲜的完全培养基重悬细胞并将细胞密度调整为6×105ml-1,然后接种在6孔板上,常规条件下培养。细胞融合度90%~95%时进行转染。实验分为3组:对照组、无义组、siRNA-ANK2组。转染前2 h,更换为无胎牛血清的培养基,将4 μg siRNA ANK2或siRNA 无义序列与250 μl OPTI-MEM培养基混合均匀,10 μl Lipofectamine 2000与250 μl OPTI-MEM培养基混匀,将稀释的DNA混合液加入到Lipofectamine 2000混合液中,室温静置20 min,然后将混合液转移至6孔板中,混匀,转染4~6 h,将培养基更换为完全培养基,继续培养48 h,收集细胞。
1.2.3 转染后细胞中ANK2蛋白表达量的检测:采用蛋白质印迹法(Western blotting)检测转染后细胞中ANK2蛋白表达量。PBS洗涤各组细胞2遍,吸取500 μl RIPA裂解液,冰上放置10 min,将细胞完全粉碎,离心,取上清。BCA法测定样品蛋白浓度,玻璃板清洗干净,配置质量浓度为100 g/L的分离胶和50 g/L的浓缩胶,置于蛋白电泳槽中,加入适量电泳液。取蛋白质样品与5×蛋白上样缓冲液混合,沸水浴10 min,然后迅速冰浴10 min,每个上样孔加入40 μg蛋白样品,调整电压至80 V进行电泳,至蓝色条带到达凝胶底部0.5 cm处,调整电压至100 V,蓝色条带移动至凝胶底部,停止电泳。去除浓缩胶,将携带目的蛋白的凝胶置于电转液中浸泡20 min,将蛋白质转移至硝酸纤维素膜上,正面进行标记,放入5%封闭液中,摇床上封闭60 min。TBS-T洗膜10 min,置于一抗溶液中,4 ℃过夜。TBS-T洗膜5次×5 min,放入辣根过氧化物酶标记的二抗溶液中,混合均匀,室温孵育1 h,TBS-T洗膜5次×5 min,加入ECL的A、B液反应1 min,暗盒中曝光,成像仪中成像,分析蛋白质光密度值。
1.2.4 细胞活性的检测:常规消化各组细胞,以2×103/孔细胞接种于96孔板上,放入37 ℃培养箱中培养24 h,每孔细胞中加入10 μl CCK-8溶液,培养箱中孵育1 h,酶标仪上450 nm波长测定细胞的吸光度(OD值)。
1.2.5 细胞周期的检测:常规消化各组细胞,加入PBS重悬细胞,调整细胞浓度为2×106ml-1,1 000 r/min离心5 min,弃上清,加入质量浓度为700 g/L的乙醇(提前预冷)固定12 h,1 000 r/min离心5 min,弃上清,用PBS缓冲液清洗细胞,加入500 μl PI(含RNA酶),避光,4 ℃孵育0.5 h,置于流式细胞仪检测激发波长488 nm细胞各周期DNA含量。
1.2.6 细胞侵袭能力的检测:提前将Matrigel胶、培养基、Transwell小室置于4 ℃冰箱中,加入RPMI-1640培养基稀释Matrigel胶至4 g/L,吸取70 μl Matrigel胶加入Transwell小室上室底部,摇匀,置于37 ℃恒温箱中通风30 min,使Matrigel胶充分凝固。吸取无血清的培养基加入Transwell小室中。胰酶消化已饥饿24 h的细胞,将细胞浓度调整为5×105ml-1。取200 μl细胞稀释液接种于Transwell小室上室中,下室中加入700 μl质量浓度为100 g/L胎牛血清的新鲜培养基,置于24孔板上,在体积分数为5%的CO2、37 ℃培养箱培养24 h,甲醛固定30 min,结晶紫染色30 min,无菌PBS缓冲液清洗3次,随机选取5个视野拍照计数,每组5个复孔,实验重复3次,取平均值。
2 结果
2.1转染后细胞中ANK2蛋白的表达量Western blotting检测转染siRNA ANK2或siRNA 无义序列后胃癌SGC-7901细胞中ANK2蛋白的表达情况,结果如表1、图1所示,与对照组相比,siRNA-ANK2组ANK2蛋白水平显著下调,差异具有统计学意义(t=5.219,P<0.05)。

图1 转染后细胞中ANK2蛋白的表达量Fig 1 The expression of ANK2 protein in transfected cells
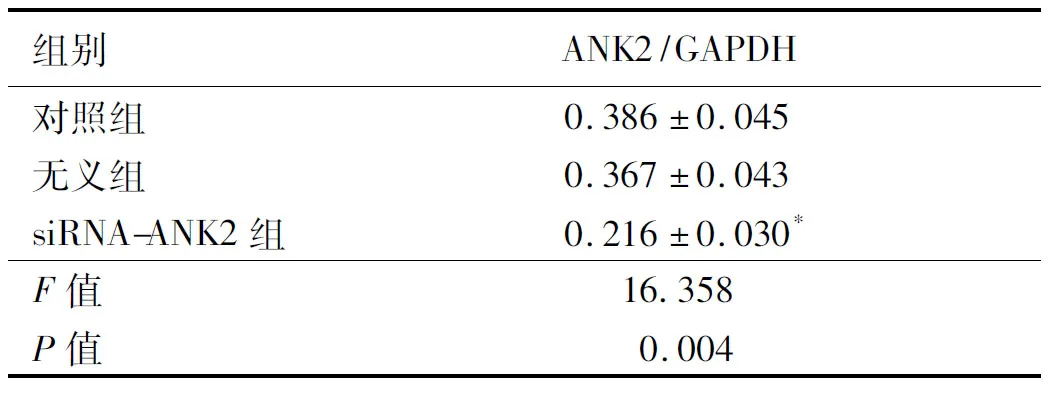
组别ANK2/GAPDH对照组0.386±0.045无义组0.367±0.043siRNA-ANK2组0.216±0.030*F值16.358P值0.004
注:与对照组相比,*P<0.05。
2.2沉默ANK2表达对胃癌细胞增殖情况的影响CCK-8法检测转染siRNA ANK2或siRNA无义序列后胃癌SGC-7901细胞增殖情况的变化。如表2所示,与对照组相比,无义组细胞的OD值无显著变化,siRNA-ANK2组细胞的OD值显著降低,差异具有统计学意义(t=4.811,P<0.05)。
2.3沉默ANK2表达对胃癌细胞周期的影响流式
细胞术检测转染siRNA ANK2或siRNA无义序列后胃癌SGC-7901细胞周期的变化。如表3所示,与对照组相比,无义组细胞周期无明显变化,siRNA-ANK2组细胞周期G0/G1期比例显著升高(t= 3.008,P<0.05),S期显著降低(t=4.016 ,P<0.05),差异具有统计学意义。

表2 沉默ANK2表达对胃癌细胞增殖情况的影响
注:与对照组相比,*P<0.05。

表3 沉默ANK2表达对胃癌细胞周期的影响Tab 3 Effect of silencing ANK2 expression on cell cycle of gastric cancer(±s) %
注:与对照组相比,*P<0.05。
2.4沉默ANK2表达对胃癌细胞侵袭能力的影响Transwell法检测转染siRNA ANK2或siRNA无义序列后胃癌SGC-7901细胞侵袭能力的变化。如表4所示,与对照组相比,无义组细胞的侵袭数无显著变化,siRNA-ANK2组细胞的侵袭数显著降低,差异具有统计学意义(t=9.813,P<0.05)。

表4 沉默ANK2表达对胃癌细胞侵袭能力的影响Tab 4 Effect of silencing ANK2 expression on invasion ability of
注:与对照组相比,*P<0.05。
3 讨论
近年来,癌症已成为严重威胁人类健康的疾病之一,发病率逐年升高。肿瘤的发生主要是由于机体受到某种因素的刺激导致原癌基因和抑癌基因表达量失衡。目前,临床上常采用手术治疗联合放射、化学疗法,但无法根除或彻底杀灭肿瘤细胞,肿瘤患者常出现复发和转移,预后差,且常规化疗特异性较差,不仅杀伤肿瘤细胞,而且损害机体正常的细胞,具有较大的不良反应[8]。基因治疗是一种安全、有效、不良反应小的治疗方法,成为肿瘤生物治疗研究的重点。RNA干扰技术是一种高效、特异性高、作用范围广、操作简单的基因抑制技术,主要通过导入特异性双链RNA,引起靶基因特定的沉默应答反应,从而抑制靶基因的表达,目前多用于基因治疗和肿瘤的发生、发展过程中相关基因功能的探索[9-10]。在本实验中,通过siRNA技术特异性降低ANK2在胃癌细胞中的表达,结果显示,胃癌细胞SGC-7901转染siRNA ANK2后,细胞中ANK2蛋白的表达量明显降低。
胃癌是最常见的恶性肿瘤之一,研究表明,机体内抑癌基因和癌基因的平衡与胃癌的发生、发展有关[11-12],但目前对胃癌的生长和转移机制尚不完全清楚,因此,研究其生长、转移的关键因子,对胃癌的诊断和治疗具有重要意义。肿瘤的恶性生长、侵袭、迁移是导致肿瘤预后较差、死亡率增加的主要原因[13-14]。ANK2编码的Ankyrin-B属于ANKs家族,与肿瘤的发生、发展密切相关[15]。研究[7,16-17]发现,ANKs在前列腺癌、乳腺癌、胰腺癌、卵巢癌组织中的表达量高于癌旁组织,并调节肿瘤细胞的增殖、转移能力以及膜转运过程。在本实验中,CCK-8检测细胞的增殖活性,实验结果显示,当胃癌细胞SGC-7901中ANK2表达量下降时,细胞的增殖活性明显降低;流式细胞术检测细胞周期结果发现,ANK2表达量下调时,G0/G1期的细胞比例明显增多,S期的细胞比例降低,表明沉默ANK2基因表达能使人胃癌细胞SGC-7901的细胞周期阻滞在G0/G1期,抑制其向S期转化;Transwell实验结果表明,ANK2基因沉默的SGC-7901细胞的侵袭能力明显降低。研究[18]表明,干扰ANK2基因的表达可有效抑制胰腺癌细胞的增殖、侵袭和迁移,与本实验结果相符。
综上所述,沉默胃癌细胞SGC-7901中ANK2表达,可以降低胃癌细胞增殖活性,抑制胃癌细胞生长,使细胞周期阻滞在G0/G1期,阻碍胃癌细胞的转移能力,ANK2可能成为胃癌基因治疗的潜在靶点。
[1] HAMASHIMA C. Current issues and future perspectives of gastric cancer screening [J]. World J Gastroenterol, 2014, 20(38): 13767-13774. DOI: 10.3748/wjg.v20.i38.13767.
[2] SHMULEVICH I. Large-scale molecular characterization and analysis of gastric cancer [J]. Chin J Cancer, 2014, 33(8): 369-370.
[3] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics,2017 [J].CA Cancer J Clin,2017,67(1):7-30. DOI: 10.3322/caac.21387.
[4] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132. DOI: 10.3322/caac.21338.
[5] 王思萌, 高柳村, 帖君, 等. Cetuximab抑制胃癌SGC7901/ADR细胞的增殖并增加其化疗敏感性[J]. 现代生物医学进展, 2013, 13(12): 2253-2256, 2264.
WANG S M, GAO L C, TIE J, et al. In vitro proliferation repression and an increase of chemo-sensitivity of Cetuximab as monotherapy in chemo-refractory gastric cancer cell line SGC7901/ADR [J]. Progress in Modern Biomedicine, 2013, 13(12): 2253-2256, 2264.
[6] KÜHL S J, KÜHL M. On the role of Wnt/β-catenin signaling in stem cells [J]. Biochim Biophys Acta, 2013, 1830(2): 2297-2306.DOI: 10.1016/j.bbagen.2012.08.010
[7] WNG T, ABOU-OUF H, HEGAZY S A, et al. Ankyrin G expression is associated with androgen receptor stability, invasiveness, and lethal outcome in prostate cancer patients [J]. J Mol Med (berl), 2016, 94
(12): 1411-1422. DOI: 10.1007/s00109-016-1458-4.
[8] 罗静. RNA干扰在抗肿瘤中的作用研究进展[J]. 新乡医学院学报, 2017, 34(4): 340-343. DOI: 10.7683.xxyxyxb.2017.04.025.
[9] ZHANG G, WANG Z, QIAN F, et al. Silencing of the ABCC4 gene by RNA interference reverses multidrug resistance in human gastric cancer[J]. Oncol Rep, 2015, 33(3): 1147-1154.DOI: 10.3892/or.2014.3702.
[10] 曹大龙, 刘黎明. RNA 干扰技术在肿瘤基因治疗中的研究进展[J]. 医学综述, 2015, 21(14): 2566-2569. DOI: 10.3969/j.issn.1006-2084.2015.14.026.
CAO D L, LIU L M. Research progress of RNA interference in tumor gene therapy [J]. Medical Recapitulate, 2015, 21(14): 2566-2569. DOI: 10.3969/j.issn.1006-2084.2015.14.026.
[11] JIANG C, CHEN X, ALATTRAR M, et al. MicroRNAs in tumorigenesis, metastasis, diagnosis and prognosis of gastric cancer[J]. Cancer Gene Ther, 2015, 22(6): 291-301.DOI: 10.1038/cgt.2015.19.
[12] LIANG L, FANG J Y, XU J. Gastric cancer and gene copy number variation: emerging cancer drivers for targeted therapy[J]. Oncogene, 2016, 35(12): 1475-1482. DOI: 10.1038/onc.2015.209.
[13] NISHIDA T, EGASHIRA Y, AKUTAGAWA H, et al. Predictors of lymph node metastasis in T1 colorectal carcinoma: an immunophenotypic analysis of 265 patients [J]. Dis Colon Rectum, 2014, 57(8): 905-915.DOI: 10.1097/DCR.0000000000000168.
[15] CAO W, WEI W, ZHAN Z, et al. Role of miR-647 in human gastric cancer suppression [J]. Oncol Rep, 2017, 37(3): 1401-1411.
[16] BABINA I S, MCSHERRY E A, DONATELLO S, et al. A novel mechanism of regulating breast cancer cell migration via palmitoylation-dependent alterations in the lipid raft affiliation of CD44[J]. Breast Cancer Res, 2014, 16(1): R19. DOI: 10.1186/bcr3614.
[17] CATTARUZZA F, JOHNSON C, LEGGIT A, et al. Transient receptor potential ankyrin 1 mediates chronic pancreatitis pain in mice [J]. Am J Physiol Gastrointest Liver Physiol, 2013, 304(11): G1002-G1012. DOI: 10.1152/ajpgi.00005.2013.
[18] MONTANINI L, LASAGNA L, BARILI V, et al. MicroRNA cloning and sequencing in osteosarcoma cell lines: differential role of miR-93[J]. Cell Oncol (Dordr), 2012, 35(1): 29-41. DOI: 10.1007/s13402-011-0059-z.

