2 667例患者结直肠息肉诊治及随访分析
陈 功, 孙 洁, 李学良
南京医科大学第一附属医院 江苏省人民医院消化科,江苏 南京 210029
结直肠癌(colorectal cancer, CRC)是一种高发恶性肿瘤,目前在全球恶性肿瘤发病率中居第3位,死亡率居第4位。在我国,其发病率已上升至第3~5位。90%以上CRC由结肠腺瘤到腺癌顺序发展而来[1],且腺瘤多表现为息肉样病变。因此,对结直肠息肉的检查和治疗甚为重要。目前,结直肠息肉主要依靠内镜下诊断和治疗,通过结肠镜检出后,其主要治疗方式包括经内镜下黏膜剥离术(endoscopic submucosal dissection, ESD)、经内镜下黏膜切除术(endoscopic mucosal resection, EMR)、圈套勒除术、氩离子束凝固术(argon plasma coagulation, APC)、活检钳咬除等。但肠镜检查时不能保证检查出全部大肠息肉,存在一定的漏诊率[2],肠息肉内镜治疗后存在复发与再发可能。本研究对2005年3月至2015年3月在江苏省人民医院接受肠镜检查及治疗的患者息肉漏诊、治疗后复发、再发情况进行回顾性分析,探讨结直肠息肉漏诊、复发及再发的相关因素,以期指导临床。
1 资料与方法
1.1一般资料选取2005年3月至2015年3月在江苏省人民医院因各种原因行结肠镜检查或治疗的患者,收集其性别、年龄、息肉大小、息肉部位、数目、形态、治疗方式及医师操作例数、退镜时间、肠道准备情况等资料,进行回顾性分析。
1.2纳入及排除标准纳入标准:肠镜发现息肉病变并予内镜治疗患者;基本信息完善;内镜治疗后至少有1次以上复查经历。排除标准:炎症性肠病患者;家族性肠息肉病患者;CRC患者;曾行外科手术致肠道解剖结构改变患者。
1.3方法术前准备及检查器械:所有患者于检查或治疗前多次小剂量口服复方聚乙二醇电解质散进行肠道准备。采用Olympus CF Q260型内镜(日本奥林巴斯公司)进行结肠镜检查及治疗,术后将息肉送病理检查,并对所有息肉部位、形态及大小进行描述。
1.4相关定义及标准若息肉发生在原部位组织病理类型与原息肉相同者为复发;息肉发生在其他部位,组织病理类型与原来相同或不同为再发;漏诊息肉是指在一定时间内行2次结肠镜检查,第2次结肠镜检查中发现的息肉且不在第1次切除息肉的部位,如所发现息肉在原息肉切除部位认为是第1次未切除干净的残留息肉。息肉漏诊率=漏诊息肉数/两次结肠镜检查中发现的息肉总数;漏诊率=出现息肉漏诊的患者数/研究纳入的患者总数。
息肉的大小根据活检钳张开口径的大小(6.0 mm)来衡量。部位按结直肠解剖结构分为左侧结肠(直肠、乙状结肠、降结肠)和右侧结肠(脾曲、横结肠、肝曲、升结肠及盲肠)。息肉的部位根据肠道的解剖形态及退镜发现息肉时肠镜的插入长度确定。
退镜时间以6 min为界[3],<6 min认为退镜时间不充分,退镜时间≥6 min认为退镜时间充分。根据医师操作肠镜的例数分为熟练内镜医师(本次检查之前操作例数≥1 000例)和初级内镜医师(本次检查之前操作例数<500例)[4]。肠道准备情况以Boston量表[5]为准,0分:有大量固体残留,黏膜不可见;1分:有固体或液体残留,黏膜部分可见;2分:有棕色液体、可移动半固体残留,黏膜全部可见;3分:清洁,黏膜全部可见。

2 结果
2.1患者一般情况共入选患者2 667例,男1 644例,女1 023例,年龄(56.6±11.7)岁,单发息肉患者1 276例(47.8%),多发息肉患者1 391例(52.2%)。息肉总数4 788枚,位于左侧结肠2 833枚(59.2%),右侧结肠1 955枚(40.8%)。息肉<5 mm 2 177枚(45.5%),5~9 mm息肉1 905枚(39.8%),≥10 mm息肉706枚(14.7%)。ESD治疗61枚(1.3%),EMR治疗1 361枚(28.4%),套切治疗1 217枚(25.4%),APC治疗1 249枚(26.1%),活检钳夹除治疗900枚(18.8%)。随访时间为(21.5±13.3)个月。
2.2大肠息肉漏诊率、复发率、再发率及相关因素分析
2.2.1 结直肠息肉漏诊情况及相关因素分析:选取息肉切除术后半年内进行第2次结肠镜检查的患者,将前后两次检查结果对比后,判定第2次结肠镜检查时新发现的息肉为漏诊息肉。对两次检查的所有息肉部位、大小、数目及形态进行描述,并记录初次检查时肠道准备情况、退镜时间及医师操作例数。
两次检查共1 446枚息肉,漏诊341枚,息肉漏诊率为23.6%。用单因素分析息肉漏诊率与息肉部位、形态及大小的关系,结果显示,不同部位的息肉漏诊率差异有统计学意义(P<0.05),右侧结肠漏诊率较高。不同大小的息肉漏诊率差异有统计学意义(P<0.01),息肉越小,越易漏诊。有蒂及无蒂息肉漏诊率差异有统计学意义(P<0.01),无蒂息肉容易漏诊(见表1)。
2.2.2 患者漏诊情况及危险因素分析:入选患者464例,漏诊172例,患者漏诊率为37.1%。对与患者漏诊率相关的各个因素进行Logistic回归分析,结果显示:医师经验不足(<500例)、息肉多发、退镜时间不充分(<6 min)均为影响患者漏诊率的独立危险因素。操作例数<500例的医师的OR值为1.833(95%CI:1.142~2.944,P<0.05),其漏诊风险是熟练医师的1.833倍。多发息肉的患者的OR值为1.695(95%CI:1.150~2.498,P<0.01),其漏诊风险是单发患者的1.695倍。退镜时间<6 min患者的OR值为2.519(95%CI:1.120~5.662,P<0.05),其漏诊风险是退镜时间充分组的2.519倍。如表2所示,肠道准备情况不佳,漏诊率较高,但差异无统计学意义(P>0.05)。
2.2.3 大肠息肉治疗后复发情况及相关因素分析:息肉切除术后半年至5年内复查患者2 203例,发现复发患者94例。患者总体复发率为4.3%。在3 342枚息肉中,共发现复发息肉97枚。用单因素分析复发率与患者年龄、性别、息肉是否多发、息肉大小、息肉部位及术式等关系,结果显示,不同性别的复发率差异有统计学意义(P<0.01),男性患者的复发率较高。不同年龄的复发率差异有统计学意义(P<0.05),≥65岁的患者复发率较高。单发息肉与多发息肉复发率差异有统计学意义(P<0.01),其中多发息肉复发率明显较单发息肉高。不同部位的息肉复发率差异有统计学意义(P<0.01),左侧结肠的复发率较高(见表3)。在术式(EMR、套切,余3种术式处理的息肉大小较局限)相同的情况下,息肉复发率与其大小相关(P<0.01),息肉越大,复发率越高(见表4)。在大小一定的情况下,息肉复发率与治疗术式相关(P<0.05),其中ESD及EMR复发率最低,钳夹最高(见表5)。
2.2.4 大肠息肉随访再发情况及相关因素分析:在2 203例患者中,发现再发患者899例。患者5年内再发率为40.8%,其中35.7%于1年内再发,68.3%于2年内再发(见表6)。用单因素分析再发率与患者年龄、性别、息肉是否多发、息肉部位等关系,结果显示,不同年龄、性别的复发率差异有统计学意义(P<0.01),≥65岁、男性患者的再发率较高。息肉数目与再发率相关(P<0.01),多发息肉再发率明显较单发息肉高。不同部位的息肉再发率差异有统计学意义(P<0.01),全结肠息肉的再发率较高。不同大小的息肉再发率差异无统计学意义(P>0.05)(见表7)。
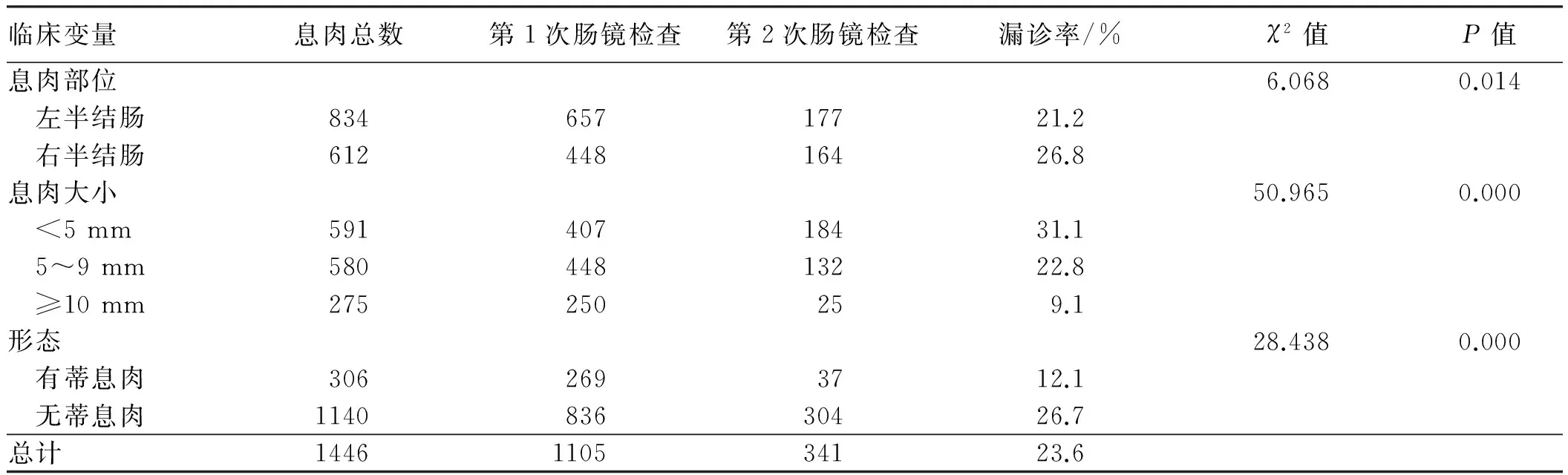
表1 不同类型大肠息肉漏诊率及相关因素分析Tab 1 The miss rate of colorectal polyps and its relevant factors analysis
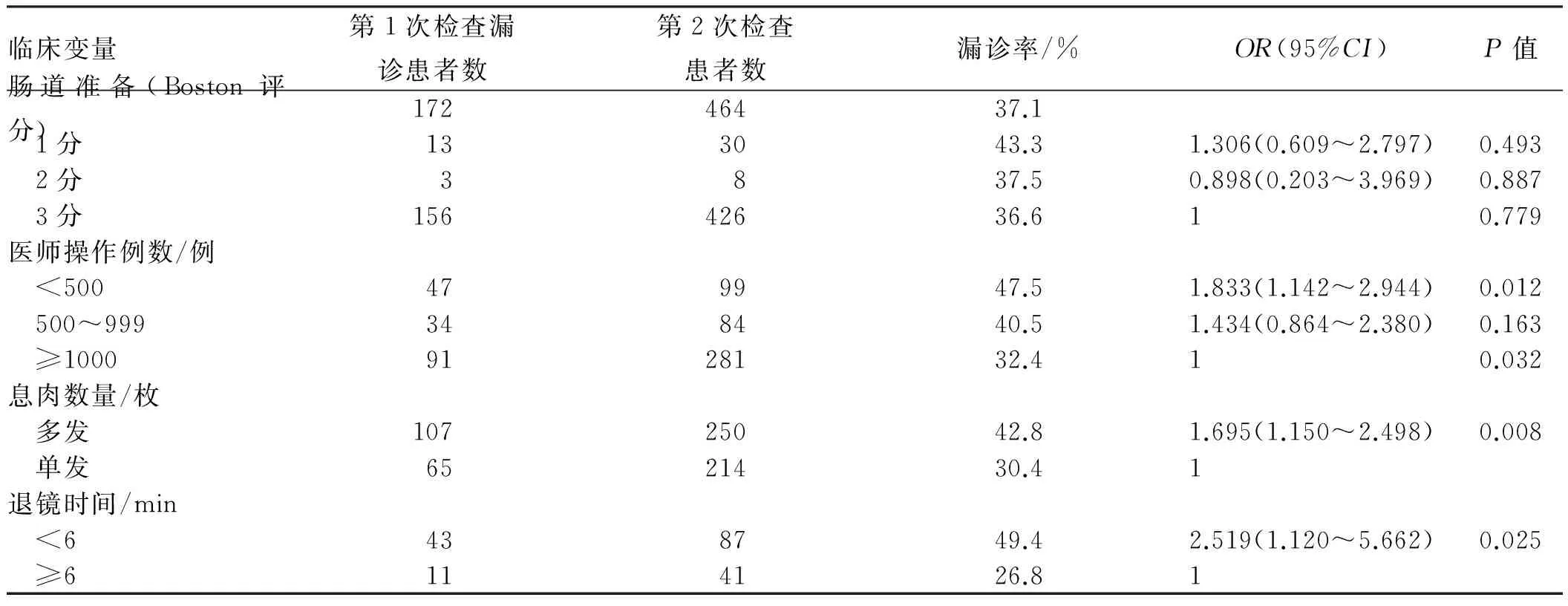
表2 患者漏诊率及Logistic回归分析Tab 2 The miss rate of patients and it’s Logistic regression analysis
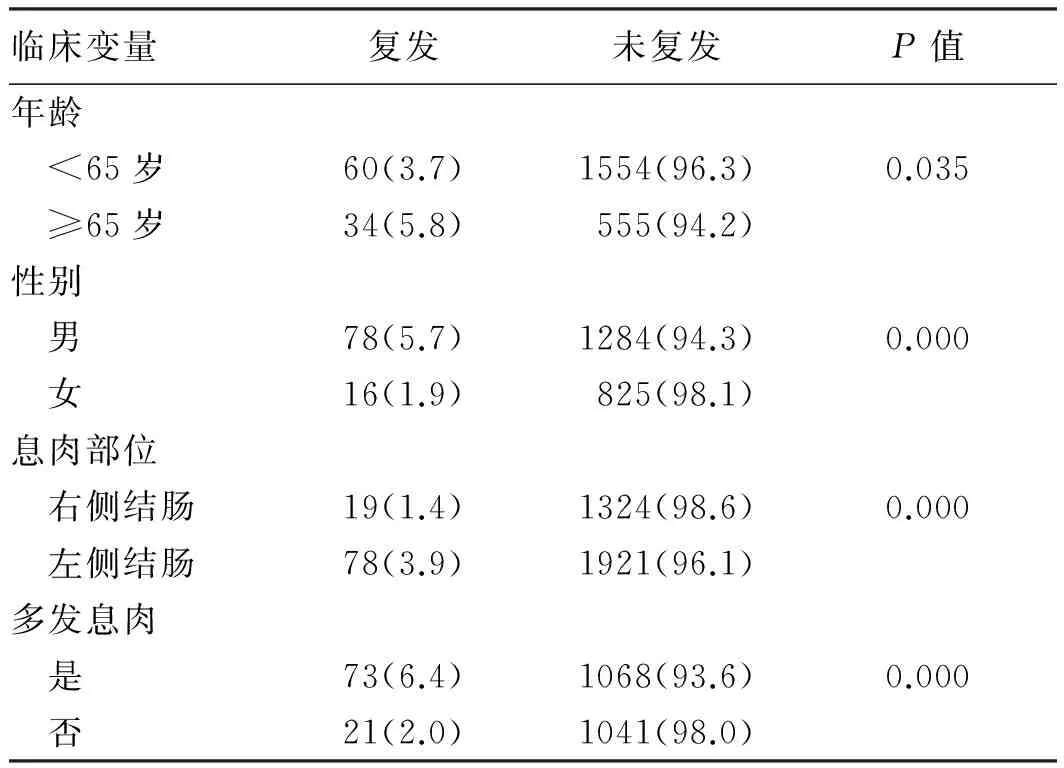
表3 息肉复发情况及相关因素Tab 3 The local recurrence rate of colorectal polyps and it’s relevant factors 比例/%
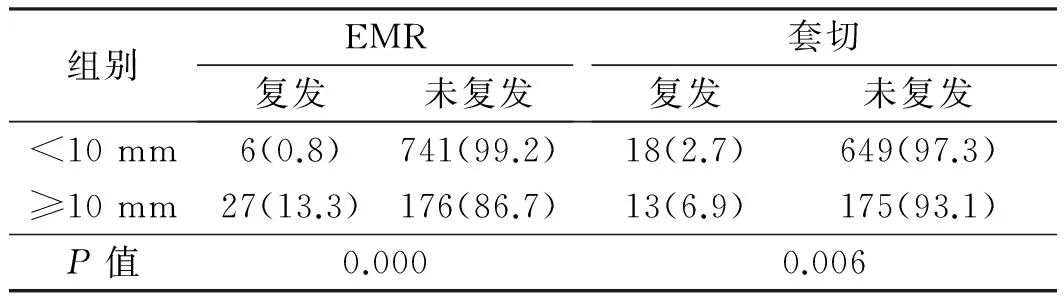
表4 相同术式不同大小息肉的复发率Tab 4 The local recurrence rate of colorectal polyps with different sizes and same treatment 比例/%
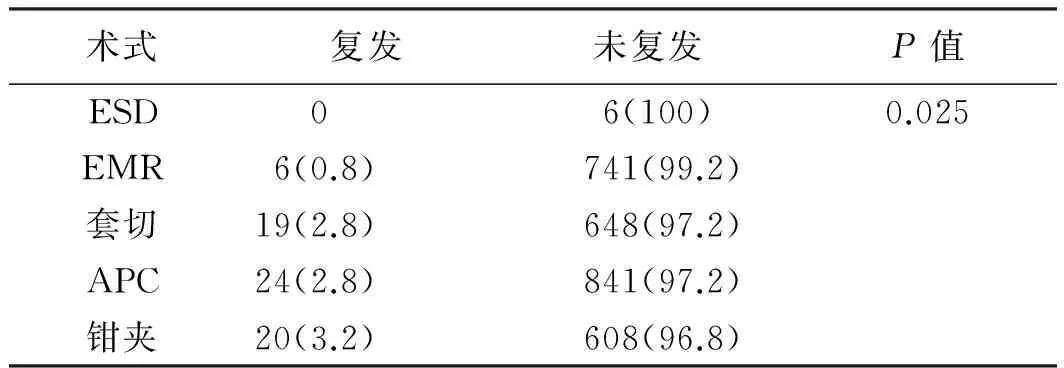
表5 相同大小(<10 mm)息肉不同术式的复发率Tab 5 The local recurrence rate of colorectal polyps with same sizes (<10 mm) and different treatment 比例/%
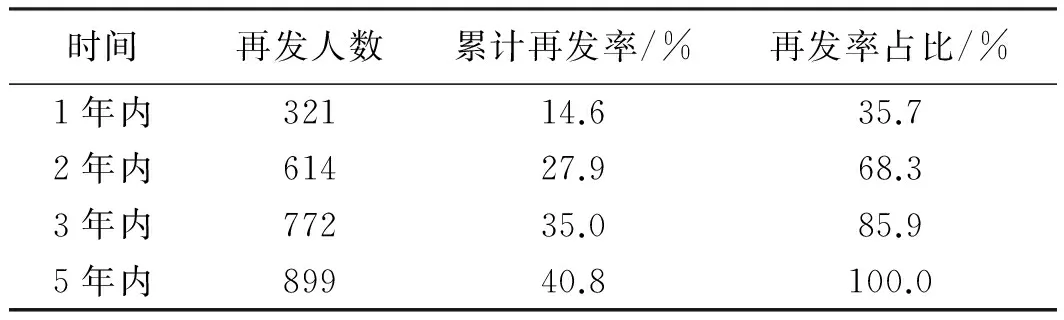
表6 息肉再发与时间的关系Tab 6 The relationship between ectopic recurrence rate and time
3 讨论
结直肠息肉是肠道发病率最高的良性肿瘤。而CRC多由结直肠腺瘤发展而来。结肠镜检查是筛查和检测CRC的金标准,通过结肠镜筛查可将CRC发生率降低约80%。因此,定期结肠镜检查可做到对CRC的早期诊断及早期干预,有利于改善预后。
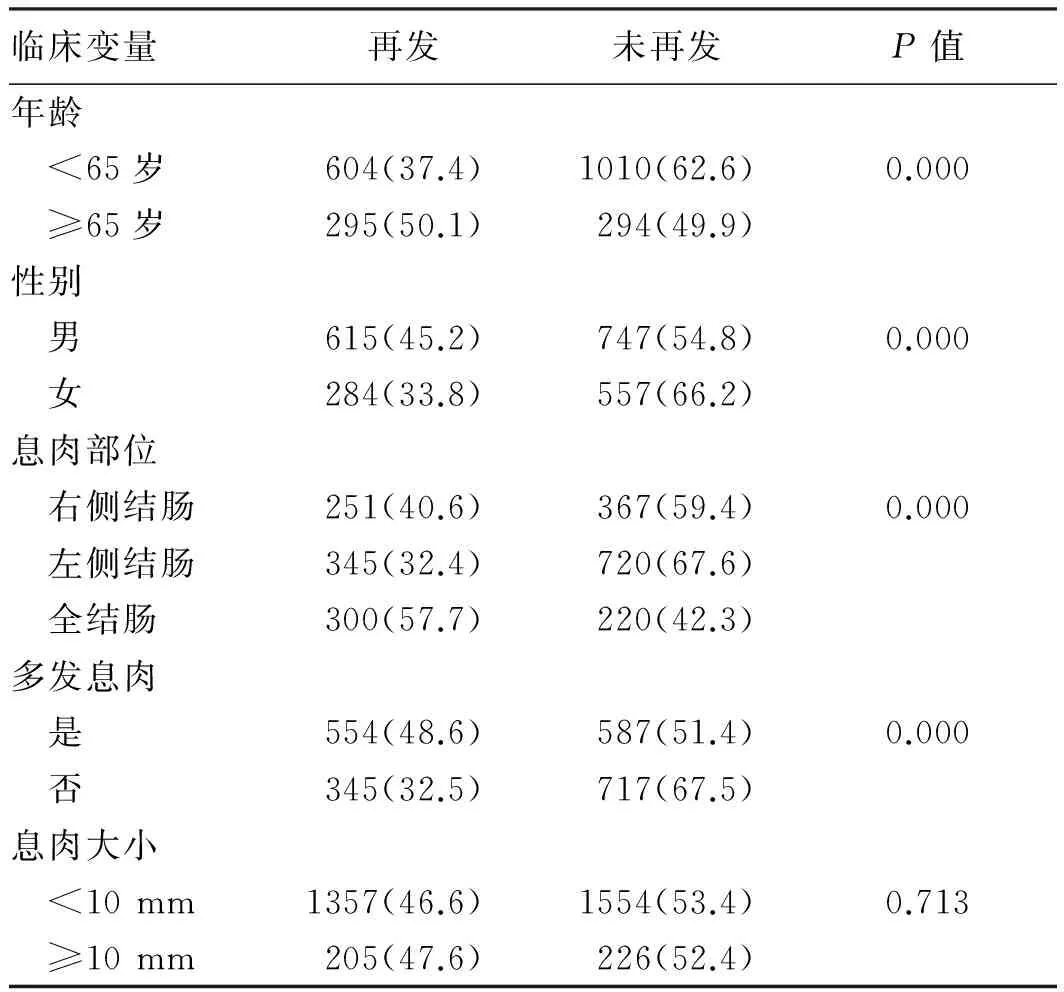
表7 息肉再发情况及相关因素Tab 7 The ectopic recurrence rate of colorectal polyps and it’s relevant factors 比例/%
纳入研究的结肠息肉患者男女比例约为1.61∶1,男性多于女性,这可能与高脂肪低纤维饮食、吸烟、饮酒等有关。本研究发现,国内外有些研究中对复发与再发定义不明,易将再发当成复发。复发为原有息肉未完全切除留有残根,随时间推移逐渐长大再次形成息肉,复发时间多在6个月~3年[2]。
有研究[6-7]称,男性患者复发风险明显高于女性,可能原因为女性体内较高水平的雌激素及孕激素具有一定的抗肿瘤效果,一定程度上降低了复发风险。本研究中发现,性别与复发相关,男性易复发,与文献[6]相符。许多研究[8-9]证实,左侧结肠息肉发生率高,特别是乙状结肠及直肠。本研究发现,左侧结肠息肉复发率高于右侧结肠,差异有统计学意义。原因可能是结肠内容物在左侧结肠滞留时间过长导致其中的致瘤物长时间刺激结肠上皮有关[10]。本研究发现,多发性息肉有更高的复发率。国外有文献[11]报道,息肉数量的增加可促进息肉的发生、发展。另外,也可能与高漏诊率有关。本研究发现,术式与复发率有相关性,其中ESD及EMR术后复发率最低,活检夹除最高。前两者包含黏膜下注射环节,息肉切除较为干净,不易残留。后者基本夹除后息肉残留几率较高。本文结果显示,息肉复发率与其大小相关,息肉越大,复发率越高。可能原因是息肉体积越大,切除后留下残端的几率越高。目前国内外各研究机构对息肉病理类型和复发率相关的观点较为统一,在多数研究[12-13]中,绒毛状腺瘤/绒毛管状腺瘤存在较高的复发率。
国内报道[14]显示,切除后的腺瘤再发率为30%~50%,其中多发腺瘤2年内累计再发率为75.5%。本次研究中5年内息肉再发率40.8%,其中35.7%于1年内再发,68.3%于2年内再发。国外有文献[15]报道,高龄患者(>60岁)腺瘤再发风险是年轻患者的2倍,本研究得出≥65岁的患者息肉再发率明显高于年轻组,与国外研究[15]相符。本研究中,男性患者再发风险明显高于女性,可能原因为女性体内较高水平雌激素及孕激素具有一定的抗肿瘤效果,一定程度降低了再发风险。国外有研究[15]指出,初次检查时腺瘤数量有3~4个的患者再发风险2倍于单发患者。本研究中多发息肉患者再发率明显高于单发患者,可能原因除了息肉数量增加促进其发生、发展外,也可能与多发息肉高漏诊率有关。本研究发现,息肉大小与之后的息肉再发无关,这首先要保证息肉已全部、完整切除。国内有研究[6]报道,全结肠息肉的再发率高于左半及右半结肠。本研究中全结肠息肉再发率高于其他部位,结果与文献[9]一致,但有些文献对息肉部位是否影响再发仍有争议[16]。
有研究[15]称,可以通过降低漏诊率降低结直肠腺瘤的再发率。在纳入的再发息肉中,相当一部分可能为漏诊所致。本研究中,息肉的总漏诊率为21.6%,该结果与国外文献[17]报道结肠腺瘤漏诊率6%~27%相近。近年国外文献[4,18-19]报道,结肠镜检查对腺瘤漏诊率12%~47%,息肉总漏诊率为22%。本研究中患者漏诊率为37.1%,高于国内外文献[4,19]中患者腺瘤漏诊率17%~26%,可能原因为本次研究包括腺瘤及其他所有类型息肉,且未将初次结肠镜检查中的正常患者纳入研究范畴。
VANRIJN等[18]对6项连续高质量的结肠镜检查中的腺瘤漏诊率进行荟萃分析,按息肉分析的漏诊率为21%,但因其要求患者在1 d内进行两次结肠镜检查,故每项研究的例数不多。为增加样本例数,本研究采取回顾性分析,选取6个月内连续2次接受结肠镜检查及治疗的患者,进行漏诊率的研究。根据文献[20]报道,对肿瘤的动态生长过程进行结肠镜的检测,发现<10 mm息肉在3年内大小大致保持相对稳定,1年内腺瘤增大1 mm左右,故6个月内出现明显新发息肉可能性很小。
通过漏诊率与大肠息肉部位、大小及形态的研究,本研究发现,右侧结肠、小息肉、无蒂息肉易漏诊。由于解剖部位不同,右侧结肠黏膜皱襞较深,弯曲较多,位置较远,所以息肉不易发现。本研究也证实了国内外研究中扁平型息肉的漏诊率大于隆起型息肉[4]。因此,对于小息肉、无蒂息肉,我们提倡全结肠检查,在内镜检查时不仅需要更加仔细,也应该革新设备,在临床上广泛应用新技术,提高息肉整体的检出率。另外,通过短期内行结肠镜检查以确保大息肉的完整切除及减少小息肉的漏诊比关注息肉大小更有意义。多发息肉漏诊率较高,原因可能为内镜医师处理已发现的多处息肉后精力下降,易忽略其他病灶的寻找[20]。通过分析漏诊率与内镜医师操作经验的关系,我们得出医师经验丰富可降低漏诊率。这提示我们需充分重视内镜医师培养,累积操作经验,增加对肠道肿瘤的认识,也是减少息肉漏诊率的重要环节。
KAMINSKI等[21]对45 026例结肠镜检查患者的腺瘤检出率(adenoma detection rates,ADR)与CRC间的关系发现,内镜医师的ADR与CRC发生的危险性显著相关,ADR升高,CRC明显降低。退镜时间是影响ADR的重要因素。美国指南[22]建议结肠镜退镜时间为6~10 min,2015年《中国早期结直肠癌筛查及内镜诊治指南》建议的退镜时间应不少于6 min。BENSON等[23]发现,退镜时间的长短与ADR呈正相关。本研究对漏诊率与退镜时间进行相关分析发现,退镜时间<6 min的患者漏诊率较高。因此,为减少漏诊,内镜医师在结肠镜检查时需保证退镜时间充足。但过长的退镜时间也会增加患者不适、操作风险及时间成本。因此,根据不同情况选择最佳退镜时间是下一步研究重点。国外文献[24]报道,若肠道准备充分,ADR明显升高。本研究虽得出肠道准备情况好时漏诊率降低,但差异无统计学意义。推测原因可能与样本例数少有关。
我们需提高对结直肠息肉漏诊、复发及再发的认识,在结肠镜检查及治疗中正确运用合适的内镜手术方式,耐心、仔细地对复发高危患者、多发息肉、小息肉、不同部位的息肉等进行检查及治疗,提高肠道准备质量及内镜医师的诊疗水平,保证退镜时间充分,积极避免息肉残留及降低息肉漏诊率和再发率。目前,如何选择最佳退镜时间及针对不同情况选择不同复查时间仍有待进一步规范,在下一步研究过程中,可继续此方面研究。
[2] 刘模荣, 赵逵, 宋剑, 等. 内镜高频电切大肠息肉术后复发因素及随访[J]. 遵义医学院学报, 2004,27(2):148-149. DOI: 10.3969/j.issn.1000-2715.2004.02.020.
[3] BARCLAY R L, VICARI J J, DOUGHTY A S, et al. Colonoscopic withdrawal times and adenoma detection during screening colonoscopy [J]. N Engl J Med, 2006, 355(24): 2533-2541.DOI: 10.1056/NEJMoa055498.
[4] HERESBACH D, BARRIOZ T, LAPALUS M G, et al. Miss rate for colorectal neoplastic polyps: a prospective multicenter study of back-to-back video colonoscopies [J]. Endoscopy, 2008, 40(4): 284-290. DOI: 10.1055/s-2007-995618.
[5] LAI E J, CALDERWOOD A H, DOROS G, et al. The Boston bowel preparation scale: a valid and reliable instrument for colonoscopy-oriented research [J]. Gastrointest Endosc, 2009,69(3Pt2): 620-625. DOI: 10.1016/j.gie.2008.05.057.
[6] 覃桂聪, 黄璐, 覃爱娜, 等. 结肠息肉内镜下治疗257例回顾性分析[J]. 广西医科大学学报, 2015, 32(3): 487-489. DOI: 10.16190/j.cnki.45-1211/r.2015.03.051.
[7] 陈文星, 郑仕中, 王爱云, 等. 雌激素调节肿瘤血管生成研究进展[J]. 中国药理学通报, 2011, 27(2): 159-162.
[8] 刘希双, 林萍, 刘思良, 等. 结肠良性肿瘤的病理特点与发病规律[J]. 中国内镜杂志, 2005, 11(10):1030-1034. DOI: 10.3969/j.issn.1007-1989.2005.10.008.
LIU X S, LIN P, LIU S L, et al. Pathologic character and regularity of benign colonic neoplasm [J]. China Journal of Endoscopy, 2005, 11(10): 1030-1034. DOI: 10.3969/j.issn.1007-1989.2005.10.008.
[9] 钟清连, 郑昌京, 黄健, 等.结直肠息肉切除术后的再发特点及肠镜监测研究[J]. 中国医师杂志, 2016, 18(7): 1005-1008. DOI:10.3760/cma.j.issn.1008-1372.2016.07.013.
ZHONG Q L, ZHENG C J, HUANG J, et al. Investigation on colorectal polyp recurrence and colonoscopic surveillance after polypectomy[J]. Journal of Chinese Physician, 2016, 18(7): 1005-1008.DOI:10.3760/cma.j.issn.1008-1372.2016.07.013.
[10] CHRISTENSON J. Intestinal motor physiology [M]. In Feldman M, Scharschmidt B F, Sleisenger M H ed, Gastrointestinal and liver disease. 6th ed. Philadelpha, WB Saunders, 2001: 1437-1450.
[11] CARVALHO R, AREIA M, Brito D, et al. Endoscopic mucosal resection of large colorectal polyps: prospective evaluation of recurrence and complications [J]. Acta Gastroenterol Belg, 2013, 76(2): 225-230.
[12] HUANG Y, GONG W, SU B, et al. Recurrence and surveillance of colorectal adenoma after polypectomy in a southern Chinese population [J]. J Gastroenterol, 2010, 45(8): 838-845.DOI:10.1007/s00535-010-0227-3.
[13] 杜爱民, 毛勇, 石延敏, 等. 结肠息肉的临床特征分析[J]. 胃肠病学和肝病学杂志, 2010, 19(1): 53-55. DOI: 10.3969/j.issn.1006-5709.2010.01.015.
DU A M, MAO Y, SHI Y M, et al.Analysis on clinical features of colorectal polyp [J]. Chin J Gastroenterol Hepatol, 2010, 19(1): 53-55. DOI: 10.3969/j.issn.1006-5709.2010.01.015.
[14] 胡炳钿.320例消化道息肉的内镜治疗及随访分析[J]. 肿瘤,1998, 18(2): 98-99.
[15] JI J S, CHOI K Y, LEE W C, et al. Endoscopic and histopathologic predictors of recurrence of colorectal adenoma on lowering the miss rate [J]. Korean J Intern Med, 2009, 24(3): 196-202. DOI:10.3904/kjim.2009.24.3.196.
[16] 高辉, 张川, 阎雪燕, 等. 结直肠腺瘤切除术后复发息肉的特点分析[J]. 胃肠病学和肝病学杂志, 2013, 22(9): 918-920. DOI:10.3969/j.issn.1006-5709.2013.09.026.
GAO H, ZHANG C, YAN X Y, et al. Characteristics of recurrence colorectal polyps after resection of colorectal adenoma [J]. Chin J Gastroenterol Hepatol, 2013, 22(9): 918-920. DOI:10.3969/j.issn.1006-5709.2013.09.026.
[17] AHN S B, HAN D S, BAE J H, et al. The miss rate for colorectal adenoma determined by quality-adjusted, back-to-back colonoscopies [J]. Gut Liver, 2012, 6(1): 64-70. DOI: 10.5009/gnl.2012.6.1.64.
[18] VANRIJN J C, REITSMA J B, STOKER J, et al. Polyp miss rate determined by tandem colonoscopy: a systematic review [J]. Am J Gastroenterol, 2006, 101(2): 343-350. DOI: 10.1111/j.1572-0241.2006.00390.x.
[19] BENSEN S, MOTT L A, DAIN B, et al. The colonoscopic miss rate and true one-year recurrence of colorectal neoplastic polyps. Polyp Prevention Study Group [J]. Am J Gastroenterol, 1999, 94(1): 194-199. DOI: 10.1111/j.1572-0241.1999.00796.x.
[20] LEUFKENS A M, VAN OIJEN M G, VLEGGAAR F P, et al. Factors influencing the miss rate of polyps in a back-to-back colonoscopy study [J]. Endoscopy, 2012, 44(5): 470-475. DOI:10.1055/s-0031-1291666.
[21] KAMINSKI M F, REGULA J, KRASZEWSKA E, et al. Quality indicators for colonoscopy and the risk of interval cancer [J]. N Engl J Med, 2010, 362(19):1795-1803. DOI: 10.1056/NEJMoa0907667.
[22] CUTLER C S, REX D K, HAWES R H, et al. Does routine intravenous glucagon administration facilitate colonoscopy? A randomized trial [J]. Gastrointest Endosc, 1995, 42(4): 346-350.
[23] BENSON M E, REICHELDERFER M, SAID A, et al. Variation in colonoscopic technique and adenoma detection rates at an academic gastroenterology unit [J]. Dig Dis Sci, 2010, 55(1): 166-171. DOI: 10.1007/s10620-008-0703-2.
[24] MENEES S B, KIM H M, ELLIOTT E E, et al. The impact of fair colonoscopy preparation on colonoscopy use and adenoma miss rates in patients undergoing outpatient colonoscopy [J]. Gastrointest Endosc, 2013, 78(3): 510-516. DOI: 1016/j.gie.2013.03.1334.

