水酶法提取红花籽油工艺优化及其籽油挥发性香气成分分析
陈卓,马丹阳,刘文玉,赵巧玲,魏长庆*
(1.新疆石河子大学 食品学院,新疆 石河子 832000;2.新疆赛里木现代农业股份有限公司,新疆 博乐 833400)
红花(CarthamustinctoriusL.),是菊科红花属种一年生草本双子叶植物[1],主要分布于中国、西班牙、荷兰、法国、希腊、伊朗和印度[2]。红花籽油中的亚油酸含量相对其他已知植物油为最高,大约在73%~85%,同时其良好的物理特性使其可以用于冷餐调味品[3]。
目前对红花籽油的主要提取工艺有物理压榨法和溶剂浸提法。物理压榨法存在提取率低、蛋白质变性严重、副产品难以利用等缺点[4];溶剂浸提法由于有机溶剂的使用而可能产生一些安全隐患。近年来,水酶法作为一种“安全、绿色、高效”的提取技术,在食品色素提取及多种植物精油和大豆、花生、菜籽、紫苏、芝麻等多种油料的提取工艺中得到了广泛应用[5]。
挥发性香气物质是调味品添加剂中存在的次生特征性标志成分,同时也是评价植物油品质的重要指标组成[6]。本文以红花籽为原料,对水酶法提取红花籽油最佳工艺条件进行研究,并用HS-SPME-GC/MS技术对提取后的籽油挥发性组分分析,为水酶法提取红花籽油提供一定技术支持与属性识别。
1 材料和方法
1.1 试验材料
红花籽:采自新疆塔城裕民县;碱性蛋白酶、纤维素酶果胶酶、复合酶制剂:郑州万博化工产品有限公司。
1.2 试验仪器
家用螺杆挤压榨油机;5810R 高速冷冻离心机;分析天平; DK-8D数显恒温水浴锅;恒温数显磁力搅拌器;GC-MS 6800气相色谱质谱联用仪;SPME 萃取装置:PDMS纤维萃取头(100 μm)、PDMS/DVB萃取头(75 μm)和DVB/CAR/PDMS 萃取头(50/30 μm)均购于美国色谱科公司。
1.3 试验方法
1.3.1 水酶法提取红花籽油工艺
红花籽脱壳粉碎→过筛(80目)→调至(添蒸馏水)→调pH和温度→酶解→灭酶(100 ℃沸水,水浴5 min)→离心分离(4000 r/min,离心20 min)→得到游离油1、乳状液、水解液和残渣→离心→得到游离油2。

1.3.2 红花籽油挥发性香气成分测定
称取10 g红花籽油样品置于125 mL带硅胶盖顶空瓶中,加盖密封后待测,先将不同萃取头于250 ℃的温度下老化2 h,在60 ℃下萃取15 min后,将萃取头抽出,置于250 ℃的GC进样口解吸3 min并启用采集程序。
1.3.3 GC-MS分析条件
1.3.3.1 GC条件
选用(30 m×0.25 mm i.d.×0.25 μm DFDB-WAX,美国Supelco公司)石英毛细管柱;载气为氦气,流速0.8 mL/min,进样口温度250 ℃;程序升温条件:首先40 ℃保留3 min,再以6 ℃/min 升到120 ℃,然后以10 ℃/min升到230 ℃,保留8 min。
1.3.3.2 MS条件
离子源温度200 ℃,电离方式EI,灯丝发射电流200 μA,电子能量70 eV,接口温度250 ℃,扫描质量范围为33~373 amu。
1.3.4 挥发性物质定性定量方法
GC-MS实验数据由系统自带软件(Xcalibur)处理完成,红花籽油样品中挥发性组分经计算机检索定性(正反匹配度>800)并与商业计算机谱库NIST和WILEY比对分析,采用峰面积归一化法分析各组分的相对含量。
2 结果与讨论
2.1 单因素试验结果
试验以红花籽提油率为指标,分别考察了适宜酶的种类、酶添加量、料液比和酶解时间,测定这4个因素的最佳水平值范围。

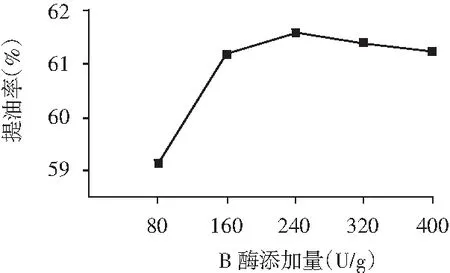


图1 各提取因素对提油率的影响
经预试验,在不同酶制剂中选择碱性蛋白酶、纤维素酶、果胶酶、复合酶制剂(碱性蛋白酶∶纤维素酶∶果胶酶为 5∶3∶2,该比例为预试验所得)进行比较,对得油率进行对比,由图1中A可知,选用不同酶制剂提油率变化不明显,保持在一定水平范围内,相比使用单一酶制剂,复合酶制剂的提油率最高。
在料液比为1∶5,酶解时间为3 h,酶解温度为50 ℃,pH为8的条件下,由图1中B可知,将酶用量提高到240 U/g时,提油率提升至61.67%,但当用量继续增加到240 U/g以上时,提油率变化不明显,保持在一定水平范围内。
复合酶制剂添加量为240 U/g,酶解时间为3 h,酶解温度为50 ℃,pH为8的条件下,由图1中C可知,随着料液比的增加,红花籽油的提取率也随之升高,当料液比为1∶5时,红花籽油提取率最高,提油率为61.20%,当料液比持续增大时,提油率反而会逐渐下降。
在酶添加量为240 U/g,料液比为1∶5,酶解温度为50 ℃,pH为8的条件下,由图1中D可知,随着酶解时间的增加,红花籽油的提取率也逐渐增高,而且变化程度较明显,当酶解时间为3 h时,红花籽油提取率达到最大,当酶解时间继续增加时,红花籽油提取率无明显变化。
2.2 响应面优化水酶法提取工艺试验结果分析
2.2.1 红花籽油回归模型的建立及显著性检验
在单因素试验基础上,综合经济效益及红花籽油品质等因素,确定各因素的最佳水平值范围,酶解pH为8,酶解温度为50 ℃,在此条件下最适用复合酶制剂,采用中心组合设计进行三因素三水平试验,响应面试验设计及结果见表1和表2。

表1 响应面设计因素水平表

表2 响应面试验设计及结果
将所得试验数据采用 Design Expert 8.5软件进行多元回归拟合和工艺参数优化,得到以提油率(Y)为目标函数的二次回归方程:
Y=70.09-12.79A+12.61B+4.59C+8.45AB-7.16AC+0.093BC-2.42A2-15.41B2-3.88C2。
为进一步对该回归模型进行显著性检验,对红花籽油提取的数学模型进行方差分析,回归模型的方差分析及显著性检验见表3,方差变量与自变量之间的线性关系明显,该回归模型极显著(P<0.01),失拟项不显著(P>0.05),说明未知因素对结果干扰很小,该模型能基本反映3种因素与提油率的关系。因此,上述二次回归方程模型合适。由F检验可以得到因子贡献率为:料液比(B)>酶解时间(C)>酶添加量(A)。

表3 回归模型的方差分析及显著性检验

续 表
注:P<0.05为显著,P<0.01为极显著。
2.2.2 红花籽油提取的响应面试验结果
酶添加量、料液比及时间对提油率影响的响应面图见图2。



图2 酶添加量、料液比及时间对提油率影响的响应面图
2.3 试验验证
根据Box Behnken试验所得的结果和二次多项回归方程,利用Design Expert 8.5软件获得了各个因素的最佳酶解条件组合为复合蛋白酶量233 U/g、温度50 ℃、酶解pH 8、料液比1∶4、酶解时间3.7 h,在此条件下,提油率可达到62.3%。为了检验模型预测的准确性,在最佳酶解条件下进行酶解,做3组平行试验,所得结果为(61.55±0.51)%,由此可得,采用响应面分析法对水酶法提取红花籽油最佳酶解条件的优化是有效的。
2.4 红花籽油香气成分分析
2.4.1 水酶法红花籽油样气相色谱图
水酶法提取红花籽油的香气成分的GC色谱图见图3。

图3 水酶法提取红花籽油的香气成分的GC色谱图
2.4.2 水酶法红花籽油香气组分分析

表4 红花籽油的挥发性香气成分

续 表
注:(Z)-表示顺式结构;(E)-表示反式结构。
由表4可知,本研究采用SP-ME-GC-MS技术对水酶法提取的红花籽油的挥发性成分进行了检测分析,共检测出63种挥发性化合物,主要包括烷烃类化合物(2种)、烯类化合物(4种)、醛类化合物(15种)、酮类化合物(1种)、醇类化合物(9种)、酸类化合物(2种)、酯类化合物(3种)、杂环类化合物(21种)、其他类6种。
由图4可知,红花籽油的挥发性香气成分中醛类化合物的含量最高,高达30.07%,其中己醛相对于其他挥发性成分具有较高含量,高达12.13%,这可能是由于其合成途径的多样性所导致[7],研究发现植物油中C5~C9的醛类化合物多数呈现出脂肪味、水果味或者青草味等[8],所以醛类化合物是红花籽油挥发性香气中一类重要的组分。杂环类化合物的相对含量仅次于醛类,但杂环类化合物的阈值通常很低,低浓度下就具有明显的焙烤风味,对油脂整体风味贡献较大[9]。醇类化合物中主要有正己醇(3.09%)和3-乙基-4-甲基戊醇(1.58%), C6醇类一般都具有较强的青草香[10],如正己醇。烯类化合物多具有一种清新淡雅的香气[11],其中1-石竹烯具有淡淡的丁香味[12]。众多挥发性化合物呈现出不同的风味,因此水酶法提取红花籽油的香味是由多种成分共同作用产生的。
3 结论
本试验在单因素试验的基础上,筛选出合适的酶制剂,并以提油率为响应指标,通过三因素三水平的响应分析对水酶法提取红花籽油工艺条件进行优化。最终确定在pH为8,温度为50 ℃,料液比为1∶4的酶解条件下,选用复合酶制剂(其中碱性蛋白酶、纤维素酶、果胶酶含量为5∶3∶2)添加量为233 U/g,酶解时间3.6 h时效果最佳,得油率为62.3%。
采用SP-ME-GC/MS技术对水酶法提取的红花籽油的挥发性成分进行检测分析,共检测出63种挥发性物质,主要包括烷烃类化合物(2种)、烯类化合物(4种)、醛类化合物(15种)、酮类化合物(1种)、醇类化合物(9种)、酸类化合物(2种)、酯类化合物(3种)、杂环类化合物(21种)、其他类6种,其中醛类、杂环类、醇类和烯类挥发性物质的总含量相对较高,依次为30.07%,22.03%,10.11%,5.33%。
[1]李永贵,秦亚兵.新油源——红花[J].农业科技通讯,1988(2):14.
[2]张含藻.西红花白芷无公害高效栽培与加工[M].北京:金盾出版社,2004.
[3]刘旭云.优质、高效经济作物——红花[J].云南农业科技,1992(6):21.
[4]陈婵,曾绍校.红花籽油提取工艺的优化研究[J].江西农业学报,2009,21(12):137-139.
[5]鲁曾,董海洲,潘燕.酶法提油技术研究进展[J].粮食与油脂,2006(6):37-39.
[6]Dabbou S,Issaoui M,Brahmi F,et al.Changes in volatile compounds during processing of tunisian-style table olives[J].Journal of the American Oil Chemists Society,2011,89(2):347-354.
[7]Bardague G,Bolzoni L,Parolari G,et al.Flavor compounds of dry-cured ham[J].Journal of Agricultural and Food Chemistry,1992,40(12):2389-2394.
[8]Kalua C M.Olive oil volatile compounds,flavour development and quality: a critical review[J].Food Chemistry,2007,100(1):273-286.
[9]Newell J A,Mason M E,Matlock R S.Precursors of typical and atypical roasted peanut flavor[J].Journal of Agricultural and Food Chemistry,2005,15(5):767-772.
[10]Tura D,Prenzler P D,Drjr B,et al.Vairetal and processing effects on the volatile profile of Australian olive oils [J].Food Chemistry,2004,84(3):341-349.
[11]Ali Bayrak,Mustafa Kiralan,Hasan Kara,et al.Determination of aroma profiles of olive oilsfrom turkish olive cultivars[J].J Am Oil Chem Soc,2013,90(9):1281-1300.
[12]Miyazaki T,Plotto A,Baldwin E A,et al.Aroma characterization of tangerine hybrids by gas-chromatography-olfactometry and sensory evaluation[J].Journal of the Science of Food and Agriculture,2012,92(4):727-735.

