高产酸性蛋白酶菌株的选育及酶学性质研究
李西波,张旭,杨柳,张惠惠,张继
(1.西北师范大学 生命科学学院,兰州 730070;2.中国科学院兰州化学物理研究所甘肃省天然药物重点实验室,兰州 730000)
酸性蛋白酶是指在pH值为2.5~5.0的酸性条件下水解蛋白质生成多肽和氨基酸的一类酶[1,2],广泛地应用于酿酒[3-10]、调味品酿造[11-14]、轻工[15,16]、皮革[17-19]以及饲料[20-22]等行业中,因此越来越引起人们的关注。在酸性蛋白酶的发酵生产中,菌种性能对产量起决定作用,因此筛选高活力酸性蛋白酶菌种势在必行。从自然界分离得到的菌种,由于其生产能力较低,一般不能满足工业化大规模的生产。因此,采用物理或化学诱变方法选育高产的诱变菌株,弥补生产能力低的不足,这已成为一种常规的选育菌种技术,其中紫外线是最常用的一种物理诱变方法,它直接作用于嘧啶,影响DNA正常解链与碱基配对,使其形成嘧啶二聚体(主要是TT),其优点是危险性小、诱变效果较好[23-25]。
豆酱和酱油是中国传统大豆发酵食品,深受国人喜爱,已成为中国调味品文化的象征,其独特的风味是发酵酱醅中多种微生物相互协调、共同作用的结果[26,27],尤其含有大量的产酸性蛋白酶菌株。本研究采用平板涂布法从酱醅中初筛出1株产酸性蛋白酶的菌株JL-335作为诱变供试菌株,并采用紫外线诱变对菌株JL-335进行改造,以产酸性蛋白酶活力大小为评价标准,筛选产酶活力高且遗传性能稳定的突变株SKY-520,并确定了发酵产酶的最佳工艺。通过对酸性蛋白酶催化条件的优化以及对其热稳定性的研究来阐述蛋白酶的酶学性质,为其进一步生产实践提供了科学依据。
1 材料和方法
1.1 试验材料
酱醅:由河南建洛生物工程公司提供。
麸皮、豆粕:市售;琼脂粉,蔗糖,干酪素,NaCl,KCl,FeCl3,MgSO4,KH2PO4,K2HPO4,FeSO4,NaOH,Na2CO3,三氯乙酸,NaH2PO4,Na2HPO4,CuSO4,MnSO4,NaCl,ZnSO4,福林酚:均为国产分析纯。
1.2 培养基及其制作
1.2.1 菌种保藏培养基
马铃薯培养基(PDA培养基)。
1.2.2 酪素筛选培养基
干酪素4 g,KH2PO40.3 g,NaNO32 g, K2HPO41 g,MgSO40.5 g,FeSO40.01 g,蔗糖30 g,琼脂20~25 g,蒸馏水1000 mL,121 ℃灭菌30 min。
1.2.3 麸皮培养基
250 mL的三角瓶,装料量为麸皮 12 g、黄豆粉3 g、水15 mL,pH自然,121℃灭菌30 min。
1.3 主要仪器和设备
JA1003型电子天平 上海上天精密仪器有限公司;HI8424NEW型高精度酸度计 北京市哈纳科技有限公司;SW-CJ-ZFD型超净工作台 苏净集团安泰公司;LDZX-50KB型立式压力蒸汽灭菌器 上海申安医疗器械厂;PYX-DHS-50X6.5-S型隔水式电热恒温培养箱 上海跃进医疗器械厂;TG-16W型微量高速离心机 长沙湘仪离心机有限公司;THZ-320型台式恒温振荡器 上海精宏试验设备有限公司;WFZ UV-2800AH型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;HH-2型数显恒温水浴锅 江苏金坛市亿通电子有限公司;外径千分尺 台州市新上量量具有限公司。
1.4 方法
1.4.1 菌种筛选
用无菌生理盐水将酱醅稀释成10-3~10-8浓度的菌液,采用稀释平板涂抹法将其分别涂布于PDA平板培养基上,置于28 ℃培养72 h,挑取生长速度最快、产孢子量致密、表面颜色一致且个体形态无异的单个菌落移入PDA斜面培养基;用无菌生理盐水将PDA斜面培养基上的孢子稀释成10-3~10-8浓度的孢子悬浮液,并将其分别涂布于酪素平板培养基表面,置于28 ℃培养72 h,外径千分尺测定每皿中透明圈直径和菌落直径(均以每皿中3个菌落的平均数计为该菌株的结果),计算HE值[透明圈直径(cm)/菌落直径(cm)]。将HE较大的菌落转接于PDA斜面培养基,置于28 ℃培养72 h待用。
1.4.2 诱变方法
用无菌生理盐水将PDA斜面培养基的孢子稀释成10-4,10-5,10-6个/mL的浓度,分别吸取100 μL 不同浓度的孢子悬浮液涂布于PDA培养基,取3个平板做对照不进行紫外诱变选用20 W紫外灯,25 cm处照射诱变,照射时间分别设计为1,3,5 min,照射后立即用锡箔纸进行避光处理,避免光修复。每个诱变处理做3个重复。在28 ℃培养72 h,计算致死率。再培养12 h计算HE值。
1.4.3 初筛方法
挑选紫外线诱变致死率在70%~80%的平板上的菌落,点种于干酪素筛选培养基,28 ℃培养72 h,观察记录透明圈直径和菌落直径,计算HE值。挑选HE值较大且孢子比较多的菌株移入PDA斜面,28 ℃培养72 h,然后于4 ℃冰箱中保存备用。
1.4.4 复筛方法
将经过初筛后HE较大且孢子比较多的菌株接种于经过灭菌冷却到28 ℃的麸曲培养基中。接种量为4环,用接种铲搅拌均匀,28 ℃培养48 h。培养到48 h时,在无菌条件下摇瓶1次。再继续培养12 h后第2次摇瓶,接着培养12 h。总共培养时间达到72 h后将三角瓶躺置12 h。最终培养时间达到72 h。培养结束后,测定蛋白酶活力。
1.4.5 发酵条件的优化
用诱变筛选出的突变株,分别在不同的温度(28,30,32,34,36 ℃)、pH值(3.5,4.0,4.5,5.0,5.5)、培养时间(40,44,48,52,56 h)下发酵,并测定其酶活力,考察温度、pH值、培养时间对发酵的影响。
1.4.6 遗传稳定性试验
将菌株每隔1个月转接1次斜面,连续传代6代,测定菌株发酵48 h后的产酶活性。每个菌株做3个重复,结果取平均值,比较其产酶活性变化,考察菌种的遗传稳定性。
1.4.7 酸性蛋白酶酶学性质研究
1.4.7.1 粗酶液的制备
称取55 ℃,10 h烘干的麸曲,加入pH 3.0的酸性缓冲液200 mL。在40 ℃水浴中浸出30 min,用新的定性滤纸过滤,滤液为酶浸出液。
1.4.7.2 单因素试验对酶活性的优化
酸性蛋白酶最适反应温度:通过恒温水浴锅将反应温度分别调到30,35,40,45,50,55 ℃,以pH 3.0的1.0%酪蛋白溶液为底物测定酶活力。
酸性蛋白酶最适反应pH:用0.1 mol/L乳酸和 0.2 mol/L乳酸钠缓冲溶液配制pH值分别为4.5,4.0,3.5,3.0,2.5的1.0%的酪蛋白溶液,以此为底物测定酶活力。
金属离子对酶活性的影响:分别用FeCl3,MgSO4,KCl,CuSO4,MnSO4,NaCl,ZnSO4溶液稀释抽提初酶液,使酶液中最终金属离子浓度为5 mmol/L,进行酶活测定,考察金属离子(Fe3+,Mg2+,K+,Cu2+,Mn2+,Na+,Zn2+)对酶活力的影响。
1.4.7.3 正交试验对酶活性的优化
在单因素的基础上,选出对酶活力影响较大的3个因素,每个因素设定3个水平,以酶活力作为评价指标,采用L9(34)正交表对酶活力影响条件进行优化试验。
1.4.7.4 热稳定性研究
在80 ℃的恒温干燥箱中分别将抽提初酶液保温1,2,3,5,10 min,迅速取出后立即放入冰水中,再用1.4.8项下酶活力测定方法测定酶活力。
1.4.8 酶活力测定
酸性蛋白酶活力的测定采用Folin-酚法(GB/T 23527-2009《蛋白酶制剂》)。酶活单位[30]:以酪蛋白为底物,在一定条件下1 min水解酪素,产生1 μg酪氨酸所需要的酶量定量为1个酶活力单位,以U/mL表示。
1.5 数据分析
采用Origin 8.5对结果进行分析,试验重复3次,数值以平均值±标准偏差表示。
2 结果与分析
2.1 蛋白酶产生菌的筛选
2.1.1 菌种的筛选
将分离纯化的具有酪素水解能力的菌株稀释成10-3,10-4,10-5,10-6,10-7,10-8(依次编号为①,②,③,④,⑤,⑥),并且涂布到PDA平板培养基,28 ℃培养72 h后,通过测定其菌落直径和透明的水解圈直径,计算其HE值,结果见表1。
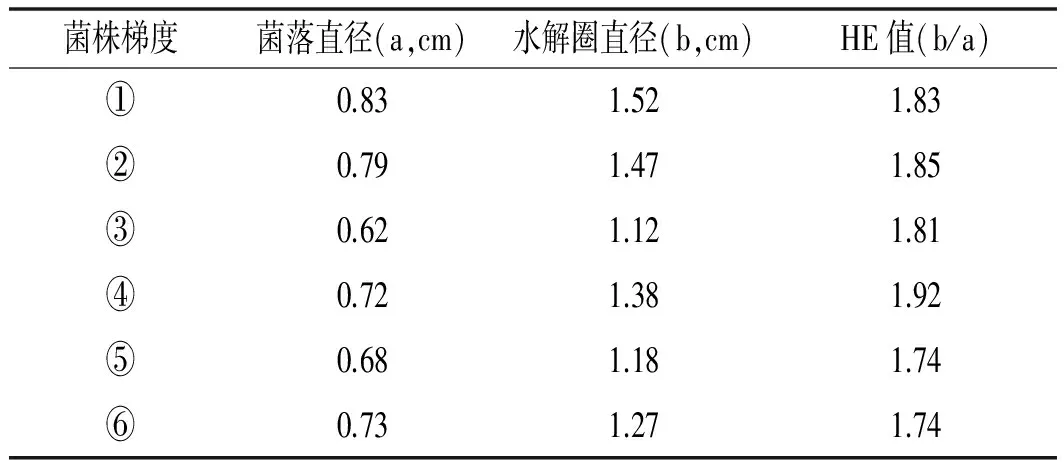
表1 蛋白酶产生菌的初步筛选Table 1 Preliminary screening of protease producing bacteria
注:表中数据为3次测得的平均值。
由表1可知,菌株④的HE值最大,将其命名为JL-335。HE值大的菌株产酶能力强的几率较高,所以选取菌株JL-335作为诱变出发菌株,进行紫外照射诱变。
2.1.2 诱变条件的选择
分别取100 μL 菌株JL-335 的10-4,10-5,10-6个/mL的孢子悬浮液涂布于PDA培养基,取3个平板做对照不进行紫外诱变。统计诱变前后的菌落数,并计算致死率,结果见表2。

表2 紫外线诱变致死情况Table 2 The results of UV mutagenic death
紫外线诱变时间越长,菌株的致死率越高,同时突变率也高。一般认为,当致死率为70%左右时得到的突变株能满足筛选的需要。由表2可知,处理时间为3 min时,致死率为74.3%,符合紫外诱变要求。而稀释倍数为10-5时,平板菌落数量比较合适挑选单菌落,诱变效果最佳,所以我们采用20 W 紫外灯照射,距离平板25 cm,照射时间3 min,稀释倍数10-5为最佳诱变条件。
2.1.3 紫外诱变初筛
将诱变后挑选出的6株长势好、直径较大并且孢子数较多的菌落,统计菌落直径和透明圈直径,计算HE值,结果见表3。

表3 诱变株干酪素平板初筛结果Table 3 The result of mutagenesis strain casein plate preliminary screening
一般HE值越大,产蛋白酶能力越强,由表3可知,诱变后有5株的HE值较大(菌株1,2,4,5,6),其中菌株2的HE值最大,其HE值为1.91;其次为菌株5,其HE值为1.90。初筛的结果可以初步鉴定出哪些菌株的蛋白酶活力较高,需要进一步测定蛋白酶活力才能确定菌株分解蛋白质的能力。
2.1.4 紫外诱变复筛
将5株初筛的菌种分别接种到已灭菌的麸曲培养基中,28 ℃培养72 h。制备蛋白酶液,测定其蛋白酶活力,测定结果见图1。

图1 紫外诱变后各菌株酸性蛋白酶活力Fig.1 Acid protease activity of each strain after UV mutagenesis
注:*,p<0.05,和对照组比较。
由图1可知,诱变后的5个突变株中,1,2,5,6号菌株的酶活力增长显著,尤其是6号菌株的酶活力增长最为显著,从最初的847.2 U/mL提高到3000.8 U/mL,提高率将近254.2%,将其命名为SKY-520,进一步对其发酵条件进行优化,并研究其所产酸性蛋白酶的性质。
2.1.5 发酵因素考察
将菌株SKY-520分别在不同的温度、pH值、培养时间下发酵,测定其酶活力,结果见图2。
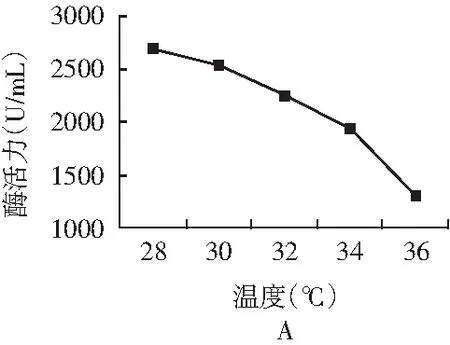


图2 不同培养温度(A)、pH值(B)、培养时间(C)下的酶活力Fig.2 Enzyme activity of different culture temperatures(A), pH values(B),culture time(C)
由图2中A可知,培养温度为28 ℃时,酶活最高,随着温度的升高,酶活力越来越低,低温有利于酶的积累,因此选用28 ℃作为发酵产酶的最适温度。由图2中B可知,发酵产酶的最适pH为5.0,pH低于5.0或高于5.0,酶活都降低。由图2中C可知,培养时间为48 h时,酶活最高,因此选用培养时间为48 h作为发酵产酶的最适培养时间。
2.1.6 遗传稳定性考察
将诱变菌株中酸性蛋白酶活力最高且增长率较高的菌株SKY-520接种于PDA斜面培养基中进行传代,每隔1个月转接1次斜面,连续6次继代培养,并且分别测定其培养种曲的蛋白酶活力,检测该突变株的遗传稳定性,结果见表4。

表4 SKY-520的遗传稳定性试验结果Table 4 Results for genetic stability of SKY-520
由表4可知,SKY-520的酸性蛋白酶活力波动范围不大,波动范围在(2905.0±12.5)~(3000.8±16.1) U/mL之间,说明该菌株的遗传稳定性好。将菌株SKY-520接种在PDA斜面培养基在28 ℃培养48 h,4℃冰箱保藏备用。
2.2 高活性酸性蛋白酶酶学性质研究
2.2.1 单因素试验结果
将发酵得到的酸性蛋白酶液体分别在不同的温度、pH值、金属离子下以1.0%酪蛋白溶液为底物测定酶活力,考察各因素对酶活力的影响,见图3。

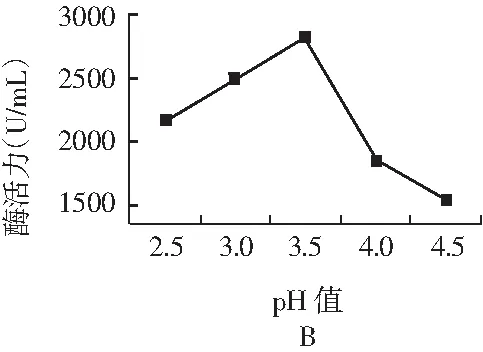
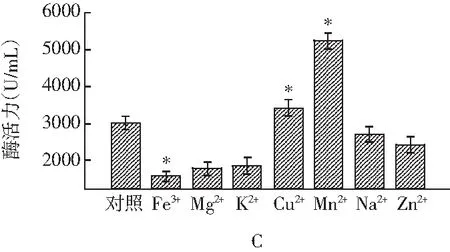
图3 不同温度(A)、pH值(B)、金属离子(C)对酶促反应的影响Fig.3 The effects of different temperatures(A),pH values (B),metal ions (C) on enzymatic reaction
注:*,p<0.05,和对照组比较。
由图3中A可知,酶在不同温度下表现出来的酶活力有很大差异,其适宜的酶促反应温度在40~50 ℃之间,在 45 ℃时最高。酶促反应受温度的影响主要表现在两个方面:一方面是当温度升高时,反应速率加快;另一方面是由于随着温度的升高使酶蛋白逐渐变性而失去活性,引起酶反应速率下降。温度的这两种影响综合产生酶反应的“最适温度”。酶在一定条件下都有其特定的最适pH,但是酶的最适pH受许多因素的影响,随着底物种类和浓度、缓冲液种类和浓度的不同而改变,因此最适pH也只有在一定条件下才有意义,由图3中B可知,pH过高或过低时均影响酶活力。在pH为3.5时,酶活力最高,证明该酶的最适反应pH值是3.5。另外,酶促反应受多种金属离子的调节,其对酸性蛋白酶活力影响较大。由图3中C可知,Mn2+和Cu2+对酸性蛋白酶具有强烈的激活作用,分别达到对照酶活的175.3%和144.3%,而Fe3+,Mg2+,K+等金属离子对酶的抑制作用明显。这个结果和众多文献报道的Mn2+离子对该酶有强烈的激活作用,同时较低浓度Cu2+也有轻度的激活作用的结果相一致。
2.2.2 正交试验结果
结合单因素试验结果,选取温度(A)、金属离子(B)和pH值(C)3个因素进行正交试验(见表5),结果见表6。

表5 L9 (34)正交试验因素水平表Table 5 Factors and levels of orthogonal experiment L9(34)

表6 正交试验结果表Table 6 The results of orthogonal experiment
根据极差大小可知,影响酸性蛋白酶活性的各因素大小依次为:金属离子、pH值和温度。最佳酶促反应组合为 A2B1C2,即45 ℃、pH 3.5、金属离子Mn2+。在此条件下,酶活力可以提高到183.7%。
2.2.3 热稳定性研究
经过不同时间的干热处理后,酸性蛋白酶的热稳定性见表7。

表7 酸性蛋白酶的热稳定性研究Table 7 Study on thermal stability of acid protease
在80 ℃下,随着处理时间的延长酶活下降,保温10 min 仍保留有74.2%的酶活。结果显示酸性蛋白酶具有很好的抗高温性能。
3 讨论
酸性蛋白酶是一种非常重要的工业酶制剂,在酿酒、调味品酿造、轻工、皮革和饲料行业都具有广泛的应用,每年的用量很大。菌种的性能对其产量起决定作用,因此选育诱变高活力产酶菌株是关键问题之一[28]。紫外线是非常有效的菌株诱变技术,已广泛用于微生物菌种的诱变选育[29,30]。
我们首先利用建洛生物公司提供的酱醅,采用平板透明圈法,选择HE值(透明圈直径/菌落直径)较大的菌株JL-335作为诱变出发菌株,将稀释成不同浓度,并接种在PDA培养基,采用20 W紫外灯,距离25 cm,照射时间3 min,结果发现稀释倍数10-5时的HE最大。将其结合产酸性蛋白酶活力大小等为评价标准,筛选出一株酸性蛋白酶活力高菌株SKY-520,其产酶能力从最初的847.2 U/mL提高到3000.8 U/mL,提高率将近254.2%,相对于对照菌的酶活力提高具有显著性。将诱变菌株SKY-520在不同温度、pH值、培养时间等因素下试验,得出最佳发酵条件为温度28 ℃、pH 5.0、培养时间48 h。筛选到的这株菌株,其产酶酶活得到了大幅度的提高,为工业生产选育了1株高产菌株。
对于一株菌株,必须遗传性状稳定才能在工业生产中广泛应用。我们对筛选得到的高产酶菌株SKY-520,每隔1个月转接1次斜面,连续6次继代培养结果表明该菌株的遗传性状稳定。
我们将得到的菌株所产的酸性蛋白酶进行了酶学性质的研究,本研究通过单因素和正交试验分别考察了温度、pH值以及金属离子等对酸性蛋白酶酶促反应的影响,最终确定该酶的最适作用条件为45 ℃、pH 3.5、金属离子Mn2+,此时酶活性可以提高183.7%。另外,酸性蛋白酶在使用过程中存在酶活性损失严重的问题,限制了其使用,我们考察了该酶的热稳定性。我们对该酶在80 ℃下,采用不同时间的干热处理后发现,随着处理时间的延长酶活下降,在80 ℃恒温干燥箱中保温10 min仍保留有74.2%的相对酶活,说明该酶具有较好的抗高温能力。这些研究结果对于该酶越来越广泛的使用以及使用中条件的选择具有很好的指导意义。
[1]王婧,王晓丹,罗晓叶,等.酱香大曲中高产蛋白酶功能细菌的筛选及鉴定[J].中国酿造,2015(10):43-46.
[2]葛向阳,宫赛赛,张伟国.耐高温酸性蛋白酶产生菌株的选育[J].酿酒科技,2012(5):47-50.
[3]孙荣,高艳华,信春晖,等.功能菌株稳定芝麻香型白酒品质的研究[J].酿酒科技,2015(2):54-57.
[4]聂慧芳,蒋英丽,沈毅,等.酱香型大曲中高产蛋白酶细菌的分离鉴定[J].酿酒科技,2015(12):41-44.
[5]彭伟林,刘国锋,王颖,等.复合酶制剂在玉米原料酒精发酵中的应用[J].酿酒科技,2015(2):69-72.
[6]方春玉,周健,邓静,等.泸型大曲黑曲霉产酸性蛋白酶条件的优化及其酶学性质的研究[J].食品与发酵科技,2011,47(2):13-17,31.
[7]程伟,卓毓崇,杨柳,等.不同工艺对麸曲中酸性蛋白酶活性的影响[J].酿酒科技,2016(12):40-42.
[8]魏桃英,汪钊,魏瑞锋.发酵醪中添加酸性蛋白酶对黄酒稳定性的影响[J].食品与发酵工业,2015(12):148-152.
[9]李树森.酸性蛋白酶在酒精生产中的应用[J].酿酒,2014(3):84-86.
[10]刘劲松,靳玉双,从志会,等.酸性蛋白酶对浓醪发酵生产酒精工艺影响的研究[J].酿酒,2014(4):108-110.
[11]程伟,卓毓崇,杨柳,等.不同工艺对麸曲中酸性蛋白酶活性的影响[J].酿酒科技,2016(12):40-42.
[12]曹小红,张斌,鲁梅芳,等.离子注入诱变米曲霉及酱油优良生产菌株的快速筛选[J].中国调味品,2007(5):26-30.
[13]魏丕伟,王凌云,罗惠波,等.大曲中高产酸性蛋白酶霉菌的分离鉴定[J].食品与发酵科技,2014(4):1-4.
[14]张杰,熊文,崔成斌,等.米曲霉沪酿3.042发酵酱油制曲的条件优化[J].中国调味品,2015,100(8):48-53.
[15]潘佩平,王慕华,苏槟楠,等.酸性蛋白酶在山西老陈醋酿造中的应用[J].中国调味品,2014,39(10):33-36.
[16]王联结,刘慧.酸性蛋白酶对纤维素酶酶解秸秆影响的初步研究[J].中国酿造,2010(10):127-130.
[17]赵培城,邓颜威,等.离子体注入法诱变选育高产酸性蛋白酶菌株的研究[J].粮食与食品工业,2013(5):59-64.
[18]俞从正,董新宽,王全杰,等.酸性蛋白酶537处理绵羊蓝湿革对皮革延伸性能影响的研究[J].中国皮革,2006,35(9):16-20,25.
[19]郭承义,王志,陈雄,等.高产蛋白酶和淀粉酶米曲霉菌株的选育[J].中国调味品,2012,37(2):42-45.
[20]刘克胜,王莹军,孔博丹,等.酸性蛋白酶在兔毛皮染色中的应用研究[J].西部皮革,2015(8):21-24.
[21]李雄,夏永军,胡慧东,等.利用黑曲霉固态发酵啤酒糟生产饲料复合酶的研究[J].工业微生物,2010,40(3):53-57.
[22]邓静,徐静,吴华昌,等.米曲霉高产酸性蛋白酶菌株的选育[J].中国调味品,2010,35(1):53-55.
[23]焦玉双,王冕,王如福.海藻酸钠-阿拉伯胶固定化酸性蛋白酶及其性质的研究[J].中国酿造,2016(10):62-67.
[24]曲波.产酸性蛋白酶菌株的诱变育种研究[J].食品研究与开发,2015(20):169-173.
[25]宫赛赛,张伟国,葛向阳.耐高温酸性蛋白酶产生菌株的选育[J].酿酒科技,2012(5):47-50.
[26]赖颖,鲁四海.酸性蛋白酶产生菌的筛选及其部分性质研究[J].周口师范学院学报,2013(2):70-72.
[27]王春才,郭福阳,宫殿良,等.酸性蛋白酶和发酵促进剂在玉米浓醪发酵生产食用酒精中的联合应用[J].粮食与食品工业,2015(1):47-50.
[28]张秀江,胡虹,范国歌,等.酸性蛋白酶高产菌株选育及酶学性质的研究[J].河南科学,2012(3):327-332.
[29]刘畅,李军,马腾,等.黑曲霉的紫外诱变及酸性蛋白酶缺陷株的选育[J].河北科技师范学院学报,2012(1):72-76.
[30]舒冬梅,王德良,宋绪磊,等.紫外诱变筛选高蛋白酶活米曲霉的研究[J].中国调味品,2016,41(3):81-84.

