微泡破坏及骨髓间充质干细胞移植治疗犬急性心肌梗死模型的有效性
柳淑云 常学锋 刘旭光
(北京市昌平区中西医结合医院心内科,北京 102208)
急性心肌梗死(AMI)是急性危重症疾病。心肌细胞减少和缺血缺氧是导致心肌梗死晚期出现难治性心力衰竭等症状的主要因素。因此,增加有活性的心肌细胞数量是病因上治疗心肌梗死的关键。研究表明,骨髓间充质干细胞(BMSCs)能够分化为心肌组织和血管,减轻心室重构〔1〕。而且,最近的临床试验表明,移植的异体BMSCs与自体BMSCs同样可以安全有效地用于心肌细胞再生〔2〕。因此,BMSCs的移植为AMI的治疗提供了希望。
1 材料和方法
1.1试剂 DAB显色酶底物试剂盒购自天根生化科技(北京)有限公司。 小鼠单克隆抗BrdU抗体购自上海浩然生物技术有限公司。 L-DMEM培养基购自北京雅安达生物技术有限公司;Percoll分离液(1.073 g/ml)、CD34和CD44兔单克隆抗体、2.5 mm×15 mm OTW球囊,购自美国Gibco公司。
1.2动物 吉林大学白求恩医学院实验动物中心获得24只健康比格犬,雌雄各半,体重16.0~17.5 kg。
1.3BMSCs 准备 取骨髓:将犬以5%戊巴比妥钠1 ml/kg腹腔麻醉后,用20 ml注射器穿刺抽取犬肱骨骨髓10 ml,加入等体积肝素。离心纯化BMSCs,获得的单核细胞在直径100 mm的培养皿中接种,培养液内含20%磷酸盐缓冲液(PBS)、0.1 mg/ml链霉素、100 U/ml青霉素的L-DMEM。在37.0℃,5%CO2下培养。 过24 h更换培养基。细胞生长至68%以上时,细胞以1∶3的比例传代,48 h更换一次培养基。 用第三代细胞进行测定,MTT比色检测培养细胞的生长规律。通过CD34和CD44阳性细胞的免疫组化染色鉴定BMSCs。在移植前24 h,加入10 μl BrdU标记液以标记BMSCs。
1.4犬AMI模型的制作 禁食8 h后,3%戊巴比妥钠1 ml/kg腹腔麻醉实验动物。以Sedinger技术穿刺右侧股动脉,置入6 F鞘管。将6 F导管(造影),自犬右股动脉置入至主动脉根部,注入适量造影剂优维显,显示左冠状动脉前降支(LAD)。用BMW导丝推送6F OTW球囊导管至LAD远端,使之达第一间隔支和第二间隔支之间,抽除导丝,注入适量造影剂优维显,以4~6 amt充盈球囊堵塞LAD 4 h后撤除气囊,造模完毕。
1.5分组 模型成功7 d后,将狗随机分为4组,每组6只,雌雄各半。(1)PBS组:5 ml生理盐水冲洗后,用OTW球囊将LAD开口完全堵塞,然后自中心腔由远及近于2 min内注射PBS。(2)微泡+PBS组:LAD开口,给予超声辐射:经股静脉应用微量泵以1.5 ml/min匀速缓慢静脉注射2.0 ml声诺维,同时启动超声。超声探头固定于犬心脏左室乳头肌水平,观看短轴切面图;时间触发模式,触发脉冲持续时间2 ms,帧频(FPS)为0.48,触发时间间隔2 s,机械指数(MI)1.33,作用时间11 min,深度9~10 cm,强度为1.1 W/cm2,频率为1.2 MHz,其后操作同PBS组。(3)BMSCs组:以BMSCs取代PBS,余操作同PBS组。(4)微泡+BMSCs组:以BMSCs取代PBS,余操作同微泡+PBS组。
1.6观察指标 (1)细胞形态学、生长特性、数目及鉴定;(2)BMSCs的体外免疫组化标记;(3)造模时在指引导管内通过注入适量造影剂,查看其在气囊近端是否受阻,以清楚血流有无阻断情况;(4)M型超声、二维超声心动图及心肌声学造影(MCE)测量心功能、灌注缺损面积占左室总灌注面积的百分比(DA):MCE测量DA;M型超声测量心功能,包括左室射血分数(LVEF)、舒张末期容积(EDV)、收缩末期容积(ESV)、室壁增厚率(D)、短轴缩短率(FS)、室壁运动异常指数(WMSI)。造模前及造模后4 h、梗死相关冠状动脉再通后,分别进行心肌造影。选择每次造影心肌显影达平台时灌注缺损面积最小的图像,应用Matlab软件计算DA%。
1.7统计学方法 应用SPSS16.0软件,多组计量资料比较采用方差分析,两组间比较采用t检验。
2 结 果
2.1细胞形态学、生长特性、数目及鉴定 原代培养BMSCs约12 h贴壁,一般3~4 d可以传代一次。第2代细胞形态以长梭形为主;传代后呈漩涡生长(图1)。MTT细胞生长曲线分析,培养第1、2、3代细胞的生长规律基本一致,首先经过1~2 d滞留期,第3天开始进入对数生长期,第7天达到平台期,此时细胞数目不再增加(图2),可行传代。1 w后获得BMSCs数量为1×107个,3 w后传代2次,从第3代细胞中可以获得足够数量的BMSCs:107个/盘,共24盘。

图1 第3代细胞(×100)
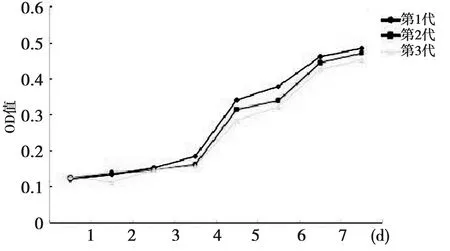
图2 MTT分析各代培养细胞的生长曲线
2.2培养细胞的鉴定 CD34、CD44免疫细胞化学检测显示表面抗原CD34呈阴性表达,CD44呈阳性表达(图3),这是BMSCs的特异标志。
2.3BMSCs的体外免疫组化标记 在BrdU 掺入BMSCs 24 h后进行免疫组化染色,细胞核染为棕褐色,证明 BrdU 已经掺入细胞核中(图4)。
2.4造模成功 冠状动脉造影显示LAD动脉闭塞。阻塞部位为第一、二间隔支之间,其远端再无造影剂显示,血流中断,证实AMI模型建立成功(图5)。MCE同步心电图导联V1表现出特征性AMI变化,包括弓背向上抬高的ST段与直立的T波连接以形成单个曲线和病理Q波(图6)。
2.5心功能和DA%的测量 各组造模后4 h心脏功能显著降低,DA%显著增加,差异均有统计学意义(P<0.05)。见表1。
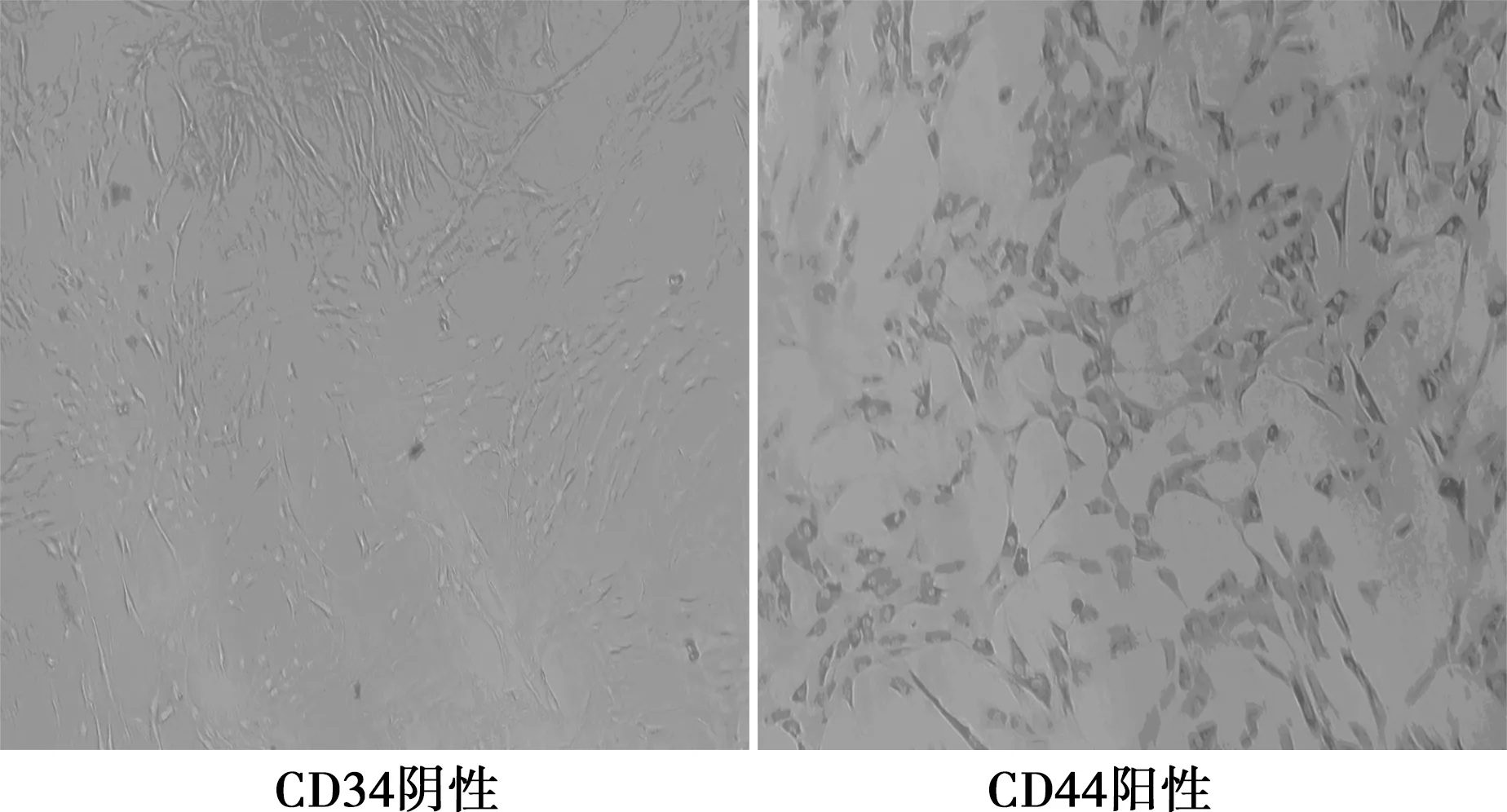
图3 免疫细胞化学检测BMSCs的表面抗原(DAB染色,×200)
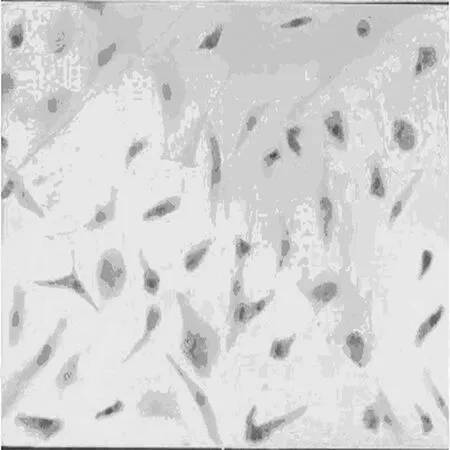
图4 BMSCs的体外免疫组化染色(DAB染色,×200)
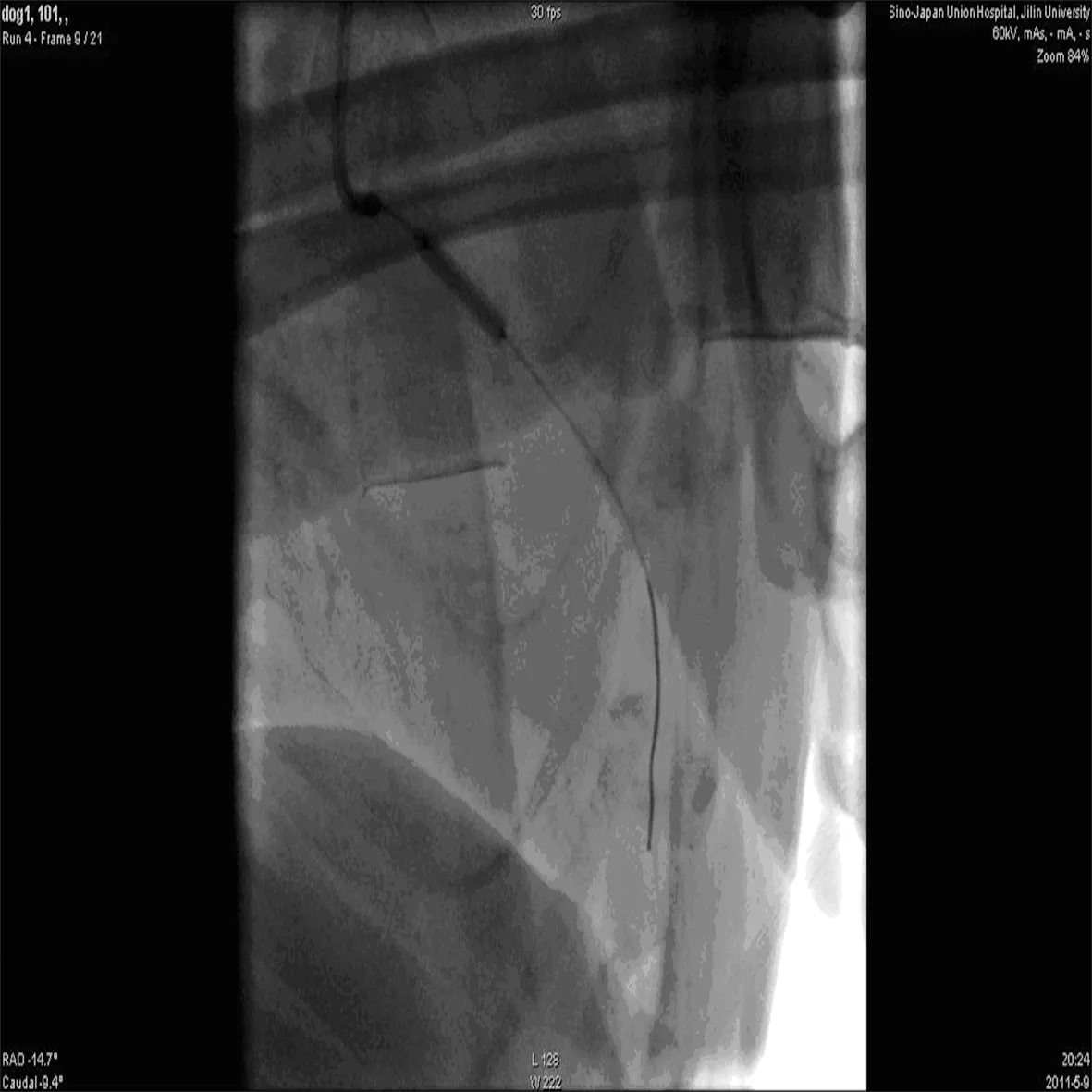
图5 封堵前降支
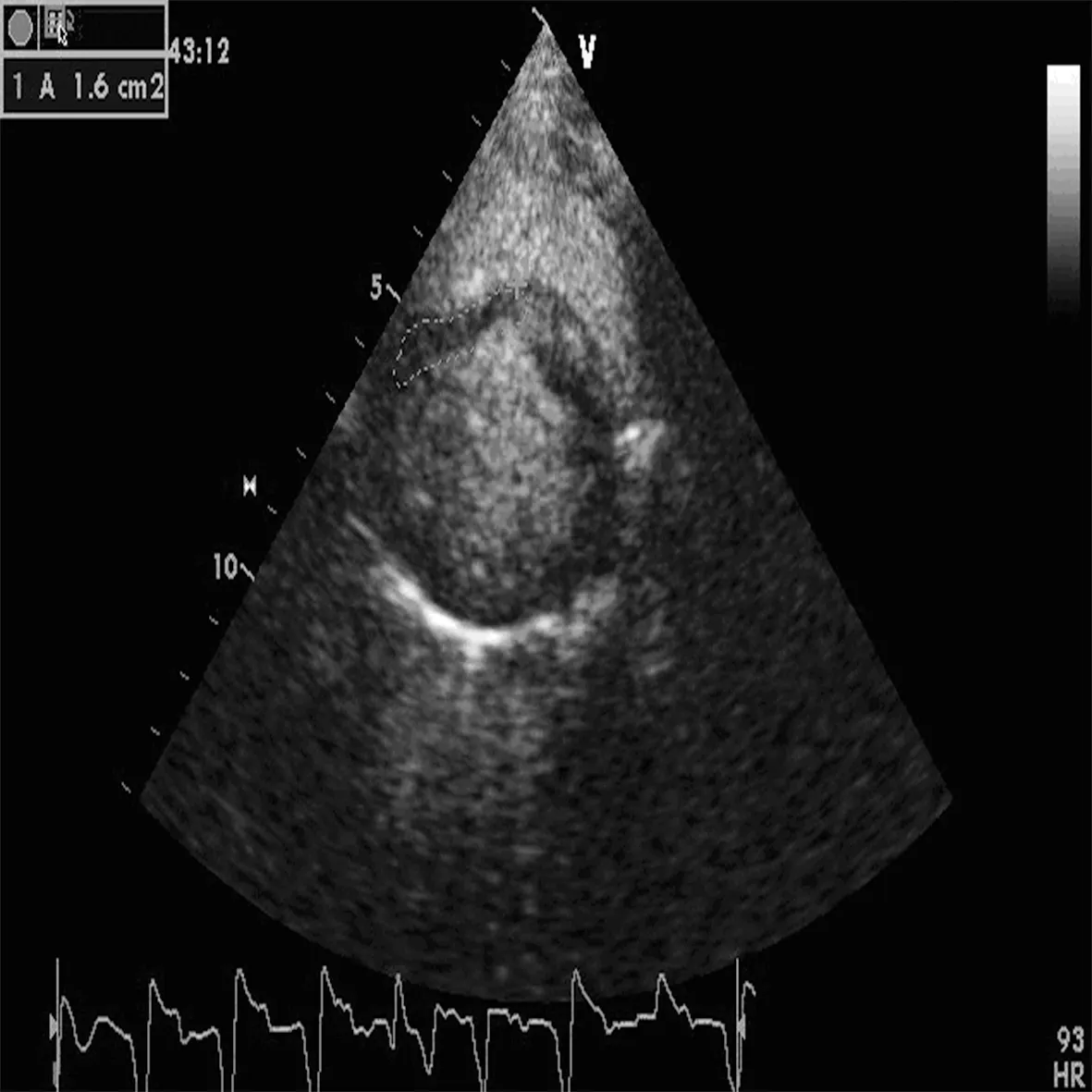
图6 特征性AMI变化

表1 各组EDV、LVEF、FS、D、WMSI和DA测量结果
与造模前比较:1)P<0.05
3 讨 论
通常AMI治疗包括药物治疗和手术治疗,主要手术方法包括冠状动脉内植入支架和冠状动脉旁路移植术植入。尽管这些治疗方法在挽救和改善患者生活质量方面取得了成功,但没有取代梗死区丢失的组织,即没有从根本上解决问题。由于心脏的再生能力很低,需要新的治疗方法,以便在细胞和分子水平上培育新的组织并治愈心脏〔3〕。
将足够的BMSCs安全、准确地归巢到梗死区是从根本上治疗AMI的关键。通过同轴整体交换型OTW导管经梗死相关冠状动脉移植的BMSCs不仅定位准确,而且风险较低,易于操作;诊断超声介导的微泡破坏可以增加血管通透性,促进BMSCs归巢到心肌梗死区〔4~6〕。为此,本文建立了犬AMI模型,验证冠状动脉内移植和超声介导的微泡破坏的组合是否可以促进BMSCs准确和有效率地移植到梗死区。
本研究结果表明,BMSCs的移植促进BMSCs在心肌内存活,提高α-肌动蛋白表达,增加了能够有效收缩的心肌细胞数量,减少了心肌梗死面积和灌注缺陷面积,心脏功能得到了有效改善。
心肌梗死发生后病变局部的微环境是细胞存活的最关键因素,他将影响移植细胞的黏附,迁移和定植能力及长期存活〔7〕。因此选择合适的移植时机非常重要。Gehrke等〔8〕发现在心肌梗死后第7天,血管内皮生长因子(VEGF)的分泌达到高峰,可能此时为移植细胞提供最充分的血供,且在心肌梗死7~15 d,纤维组织开始生成,炎症反应较前减弱,可能此时对心肌的损害降至最低,此时移植细胞容易存活。
本研究结果也证实了BMSCs移植后能够存活和分化,这为心肌梗死的干细胞临床治疗提供了借鉴。
1Du M,Schmull S,Zhang W,etal.C-kit(+)AT2R(+) bone marrow mononuclear cell subset is a superior subset for cardiac protection after myocardial infarction〔J〕.Stem Cells Int,2016;2016:4913515.
2Hare JM,Fishman JE,Gorstenblith G,etal.Comparison of allogeneic vs autologous bone marrow-derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy〔J〕.JAMA,2012;308:2369-79.
3Lister Z,Rayner KJ,Suuronen EJ.How biomaterials can influence various cell types in the repair and regeneration of the heart after myocardial infarction〔J〕.Front Bioeng Biotechnol,2016;4(1):62.
4Fakoya AD.New delivery systems of stem cells for vascular regeneration in ischemia〔J〕.Front Cardiovasc Med,2017;4(1):7.
5Liao YY,Chen ZY,Wang YX,etal.New progress in angiogenesis therapy of cardiovascular disease by ultrasound targeted microbubble destruction〔J〕.Biomed Res Int,2014;2014:872984.
6Yousef M,Schannwell CM,Kostering M,etal.The BALANCE Study:clinical benefit and long-term outcome after intracoronary autologous bone marrow cell transplantation in patients with acute myocardial infarction〔J〕.J Am Coll Cardiol,2009;53(24):2262.
7Wang J,de Veirman K,de Beule N,etal.The bone marrow microenvironment enhances multiple myeloma progression by exosome-mediated activation of myeloid-derived suppressor cells〔J〕.Oncotarget,2015;6(41):43992-4004.
8Gehrke I,Gandhirajan RK,Poll-Wolbeck SJ,etal.Bone marrow stromal cell-derived vascular endothelial growth factor (VEGF) rather than chronic lymphocytic leukemia (CLL) cell-derived VEGF is essential for the apoptotic resistance of cultured CLL cells〔J〕.Mol Med,2011;17(7-8):619-27.

