重复经颅磁刺激对遗忘性轻度认知功能障碍患者认知功能及长程功能性连接的影响
隆世宇 王晓明 罗 成 刘 新 杨 飞 何 苏 何 林
(南充市第五人民医院神经科,四川 南充 637000)
轻度认知功能障碍(MCI)是一种介于正常老年与老年性痴呆之间的临界状态,MCI向阿尔茨海默病(AD)的转化率远高于普通人,新近报道中国60岁以上的社区人口中MCI发病率为20%〔1〕。Petersen等〔2〕调查发现,MCI向AD的平均年转化率约为12.0%,明显高于正常人群。以记忆力减退为主的遗忘型MCI(aMCI)较易发展为AD。处于这种状态的个体表现出的记忆障碍与其年龄、受教育程度不符,但其他认知能力及社会功能仍保持良好,未达到痴呆的严重程度。美国食品药品监督管理局(FDA)和新的《中国痴呆与认知障碍诊治指南》 至今未推荐任何药物或非药物疗法用于对MCI的防治,而重复经颅磁刺激(rTMS)技术对认知功能的改善作用已逐渐得到认可〔3,4〕。静息态血氧水平依赖性功能磁共振(BOLD-fMRI)是目前研究aMCI功能性脑网络的重要手段,研究表明在MCI进展为AD的临床症状出现前,BOLD-fMRI就能检测到脑功能改变〔5〕,aMCI患者的大脑默认模式网络(DMN)连接性降低,而这些区域与淀粉样病变、结构萎缩、葡萄糖代谢的异常区域有明显重叠〔6〕。本研究探讨rTMS对aMCI认知功能的干预机制。
1 资料与方法
1.1一般资料 2013年12月至2014年10月在川北医学院附属医院、南充市第二人民医院及南充市第五人民医院神经内科门诊及住院aMCI患者30例,入选标准:aMCI参照Petersen的诊断标准〔2〕:①有记忆力下降的主诉。②病程>3个月。③量表评估:全面衰退量表(GDS)2~3级。临床痴呆评估量表(CDR)0.5分,记忆测查分值在年龄和教育匹配对照组1.5标准差(s)以下,且中文版简易智能状态检查(MMSE)评分:文盲18~21分,小学文化程度21~24分,中学文化程度25~27分。日常生活能力(ADL)量表低于26分。④以记忆损害为主,其他认知领域相对保持完整。排除标准:①年龄>90岁;②严重的视力或听力障碍,重度失语或瘫痪患者;③以非汉语为母语,经中国人利手评定量表评定为非右利手;④MRI检查禁忌,如假体植入、带有心脏起搏器、体内有金属异物,及有幽闭恐惧症者;⑤近期有服用可能影响fMRI检查的药物史;⑥实验室检查提示甲状腺功能减低,维生素B1,维生素B12缺乏,烟酸缺乏,低血钙,神经梅毒,人类免疫缺陷病毒(HIV)感染等系统性情况;⑦头颅影像学提示硬膜下血肿,正常颅压性脑积水,脑瘤等;⑧既往有重度抑郁,精神分裂症等精神障碍,汉密尔顿抑郁量表(HDRS)评分<10分;帕金森病或亨廷顿病史;⑨精神发育迟滞或药源性智能损害的患者,某些物质所致的痴呆;⑩谵妄;拒绝签署知情同意书者。其中,男14例,女16例。随机分为真刺激组男8例,女7例,平均年龄(68.27±9.85)岁,平均受教育年限(6.60±4.40)年,平均发病时间(2.23±0.84)年;假刺激组男6例,女9例,平均年龄(65.63±9.36)岁,平均受教育年限(6.30±4.70)年,平均发病时间(1.96±1.23)年。两组性别、年龄及教育年限差异均无统计学意义(P>0.05)。
1.2实验仪器 经颅磁刺激仪:丹麦Medtronic公司,型号:Magpro R30,最大输出强度为 4.2 T;真刺激组予以MCF-B65型蝶形线圈刺激。假刺激组采用与上述型号相匹配的MCF-PB65型线圈。肌电/诱发电位仪:丹麦Medtronic公司,型号Keypoint。神经导航系统:意大利SofTaxic公司,型号EMS,系统采用美国NDI公司的Polaris Vicra光学监测系统,记录空间位置。MRI系统:美国GE公司3.0 Tesla超导型MRI系统。
1.3神经心理学量表 ①蒙特利尔认知评估量表(MoCA):包括视结构技能、记忆、注意、语言、抽象思维、运算、定向、执行等方面的认知评估,共30分,若受试者受教育年限少于12年,则在测试结果加1分,校正受教育程度的偏倚。评分≥26分为正常。②临床记忆量表(CMS)包括各个年龄段的三组常模及甲乙两套平行测试,可用于治疗前后对照使用,每套量表包括5项记忆分测验:指向记忆、联想学习、图像自由回忆、无意义图形再认及人像特点联系回忆。汇同分测分数按受教育年限、年龄换算成记忆商(MQ),MQ<100 分为异常。③MMSE:常作为痴呆筛选初步工具,满分为30分。5~10 min完成,痴呆敏感度为80%~90%,特异性70%~80%〔7〕。一般而言,在有文化的人群中以MMSE≥24分作为MCI的筛查标准。④GDS分为7个等级,由主试者与受试者或其照料者访谈得来。本研究3级为aMCI。⑤CDR:对于痴呆严重程度的评定,目前临床最常使用该量表,主要针对痴呆患者认知水平及日常社会功能损害的严重程度进行临床分级。评定标准为:CDR 0分无痴呆,0.5分为 可疑痴呆,1分为轻度痴呆,2分为中度痴呆,3分为重度痴呆,本研究0.5分为aMCI。⑥HDRS:是世界上应用最广泛的抑郁状态评定量表。一般项目采用0~4 分的5级评分法,评分≥11分诊断为抑郁状态。本研究所有受试者HDRS评分均低于10分。⑦ADL:常用以评价老年人躯体及社会功能状况的量表,国内常用的ADL量表共20项,本研究受试者该评分均<26分。
1.4研究方法 均经过 MMSE、GDS、CDR、HDRS测试,排除痴呆、 精神症状等可影响认知功能的疾病。经简要介绍测查内容后,依次进行MoCA、CMS测试,真刺激组进行fMRI扫描(安静状态下),假刺激组采集sMRI;然后各组给予rTMS治疗;2个疗程结束后再次进行MoCA、CMS测试,并对真刺激组进行fMRI扫描(安静状态下)。
rTMS刺激方案:治疗前测定运动诱发电位刺激阈值;刺激点:选择Brodmann (BA)46区左侧额叶背外侧皮质(dlPFC)为刺激位点(采用国际EEG10/20 标准的F3点)。刺激强度:静息态运动阈值(RMT)的90%,刺激频率:15 Hz,序列均为 50 次/序列,每天 20个序列,间隔时间25 s,5 d为1疗程,间隔2 d,连续治疗2个疗程。
fMRI数据处理:(1)高分辨率T1结构像(sMRI)采集参数:采用T1-SPGR 序列,重复时间(TR)=8.5 ms,回波时间(TE)=3.4 ms,翻转角度=12°,矩阵=512×512,层厚1 mm,空间分辨率(FOV)=24 cm×24 cm,全脑无间距扫描共156层。(2)静息态fMRI数据采集:fMRI采用快速梯度回波(EPI)序列,TR=2 000 ms,TE=30 ms,FOV=24 cm×24 cm,翻转角度=90°,矩阵=64×64,层厚5 mm,全脑无间距扫描30层,205体积成像。为保证MRI磁场的稳定性,在对fMRI处理过程中舍弃了前五幅的全脑图像,即fMRI处理过程中使用200个volumes。使用磁共振图像处理软件SPM8对fMRI进行预处理分析:选择左侧dlPFC内一个球形区域(半径为6 mm)作为(ROI),中心坐标确定为(Tailarach,-31,5,60);然后从ROI中提取平均的BOLD时间序列;最后去除信号中可能的伪迹信号。将所有的相关系数进行Feisherr-to-z变换,完成Z分数化过程,因此对每一个被试都生成了一个全脑的Z分数映射图像。
1.5统计学方法 采用SPSS13.0软件进行t检验。对长程功能连接密度连接性分析首先采用长程功能连接的图像做空间8 mm的半高斯平滑(FWHM),然后使用SPM8对平滑后的图像进行双样本t检验。
2 结 果
2.1神经心理量表评定结果比较 治疗前两组MoCA、MQ、指向记忆、联想学习、图像自由回忆、无意义图形再认、人像特点联系回忆评分差异无统计学意义(P>0.05)。治疗后,两组MoCA及指向记忆评分差异有统计学意义(P<0.05)。真刺激组治疗后较治疗前MoCA、MQ、指向记忆、联想学习、图像自由回忆、无意义图形再认评分升高,其中MoCA及指向记忆神经心理量评分差异有统计学意义(P<0.05)。假刺激组治疗后与治疗前MOCA、MQ、指向记忆、联想学习、图像自由回忆、无意义图形再认、人像特点联系回忆评分差异无统计学意义(P>0.05)。见表1。
2.2fMRI数据分析结果 真刺激组治疗前后长距离功能性连接密度可以看出,长距离功能性连接增强区域主要涉及双侧小脑、双侧岛盖部额下回、右侧顶上回、右侧楔前叶、左侧中央沟盖、右侧缘上回、右侧丘脑及右侧颞极;连接降低的脑区包括:双侧角回、双侧扣带回后部(PCC)、左侧眶部额中下回及双侧颞中回,密度较高的脑区表示该脑区在脑网络中起重要作用,即网络的中心节点,见表2,图1。
2.3不良反应 真刺激组在治疗过程中没有受试者因为不良反应退出,均表现出良好的耐受性。仅有1例rTMS首次治疗后诉感轻微头晕,可忍受,症状在1 h内缓解,之后再未出现。此外,无其他不适反应。

表1 真刺激组、假刺激组治疗前后神经心理量表评定结果对比分,n=15)
P1:真刺激组治疗前后,P2:假刺激组治疗前后
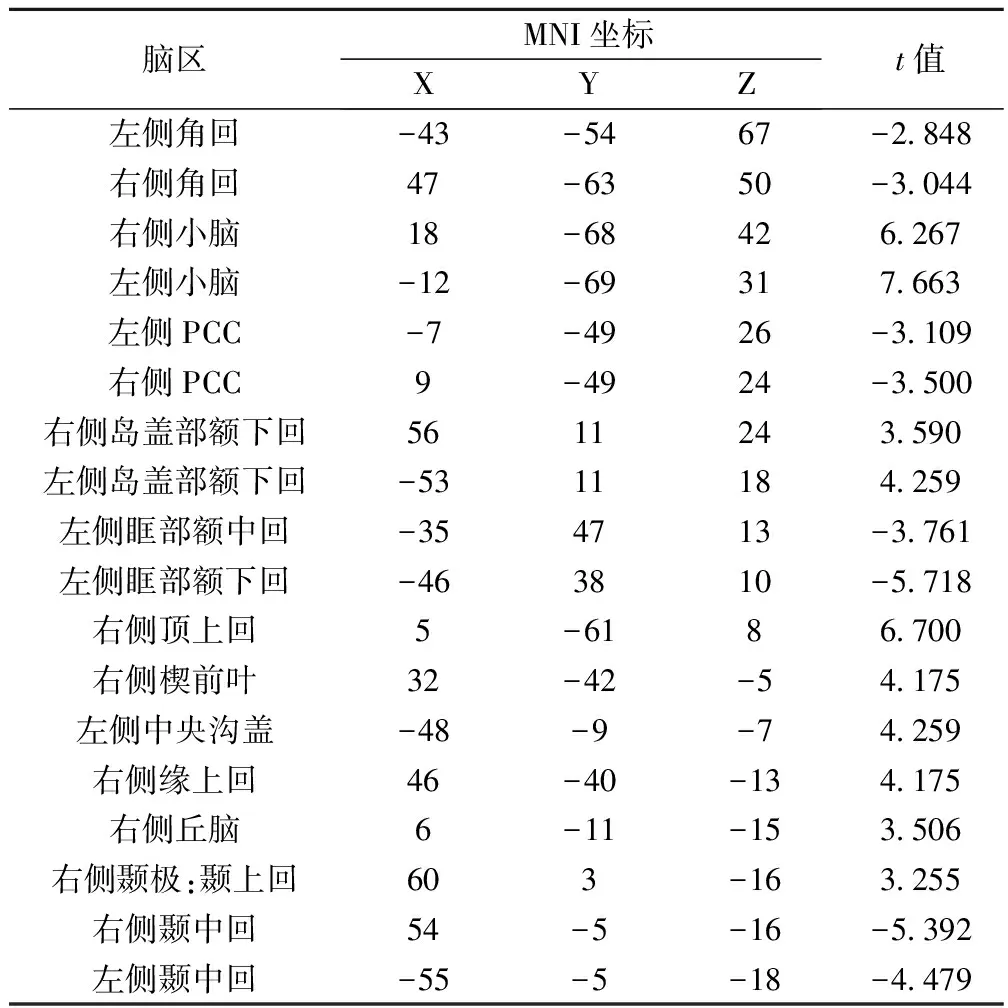
表2 真刺激组治疗前后长距离功能连接密度性组间对比
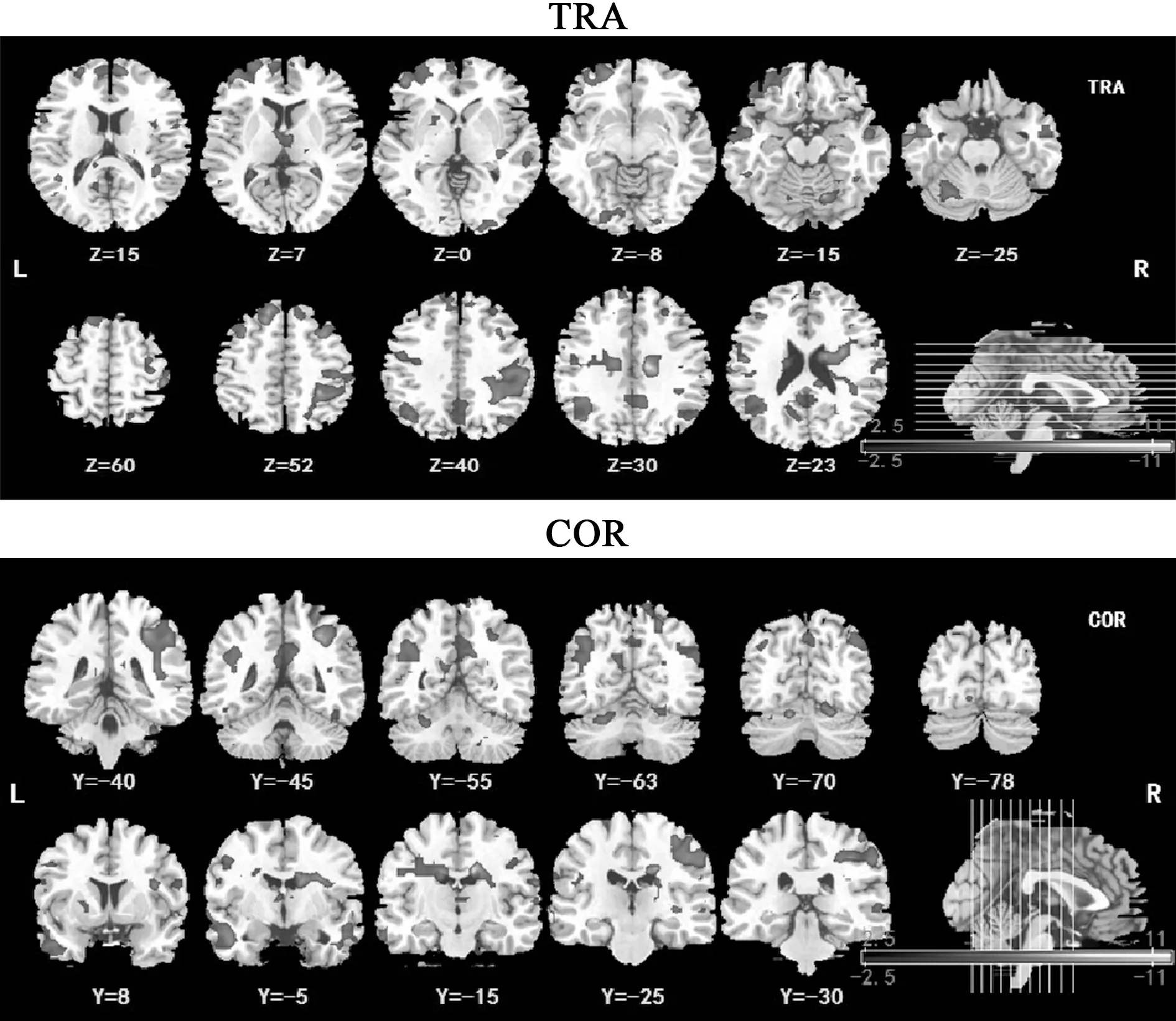
蓝绿色代表功能连接降低的脑区,红色区域为功能连接增强的脑区;Z代表坐标值;Y代表坐标值图1 真刺激组治疗前后轴位(TRA)、冠状位(COR)长距离功能连接性
3 讨 论
对皮层进行rTMS所产生的生物学效应涉及多种神经递质、局部脑血流和糖、氧代谢的影响及部分基因表达的调控等方面。rTMS可通过多种刺激方案反复、持续的磁脉冲刺激大脑皮层,调节刺激区域及相关联皮层的兴奋性,并以此达到对两侧半球间的皮层兴奋性的平衡调节〔8,9〕。rTMS不仅能影响局部皮层的兴奋性,还能对功能相关的较远皮层功能进行调控,并实现对区域性皮层功能重建,和脑网络系统的重塑。而且通过长时间增强/抑制可使其效果维持到刺激停止后一段时间。如通过BOLD-fMRI技术,便可直观了解到执行某项认知任务时,某部分脑区的血氧代谢比例发生变化,如视觉研究中常发现顶叶皮层的兴奋性增加,但这并不能说明这个脑区就是因为这项任务而活跃,只能说明该脑区与该认知任务相关。
rTMS能够影响刺激局部和功能相关的远隔皮层功能,实现大脑皮层网络系统功能区域性重塑,而且对解剖位置较远脑区同样有调控作用。rTMS不但能增加左侧dlPFC附近皮质的兴奋性、影响脑血流及代谢、增强工作记忆(WM)和维持注意力;rTMS的调控作用影响了包括神经递质在内的多种体素改变,从而影响了丘脑的功能〔10〕。根据Thomann等〔11〕研究,AD的小脑体积较正常人明显更小,而小脑的萎缩与AD患者较差的认知表现密切相关,国内的fMRI研究也发现aMCI患者小脑的连接性明显下降〔12〕。本研究结果显示:通过rTMS干预增强了小脑的连接性,这可能是rTMS改善认知水平的机制之一。对DMN的研究发现:aMCI较正常人在包括内侧前额叶(包括岛盖部),右侧顶叶,楔前叶,海马旁回(颞极)的多个节点功能性连接增强,提示了DMN的损伤和自我代偿〔13〕。这些脑区与外界和自我内省状态的监控、情景记忆的提取密切相关。本研究结果显示发现以上区域在rTMS的调控后连接性得到进一步增强,这进一步证实了前面所提到的rTMS对dlPFC的高频刺激可能对DMN有修复作用,从而改善了认知能力。值得注意的是连接增强区域不仅包括左侧额叶附近区域,而且大多集中在右侧半球,而右脑在自我认知中发挥着主导作用,这可能体现了rTMS对自我认知能力的调控及双侧半球兴奋性的平衡性调节。大脑角回连接视觉,听觉,和体感皮质区,它与左侧额下回皮质能够综合处理不同表征形式的语言信息,而大脑的语言机制是一种涉及多个脑区和多种表征形式的高级认知系统。特别是左侧角回和左侧额下回皮质通过组织协调不同语言信息,并使其转变为综合语言活动〔14〕。而颞中回的功能则在于词汇的加工。本研究结果显示:角回、左侧眶部额中下回及颞中回在治疗后出现了连接降低,有趣的是神经心理量表测试,并没有出现语言功能的下降,其原因可能在于rTMS能有效改善语言功能。Devlin等〔15〕对双侧半球语言区障碍造成的失语症患者的左侧dlPFC进行rTMS,发现刺激后在语言组织、易感性等方面获得改善,表明rTMS有助于语言能力的恢复、提高了语言学习运用能力,并造成了以上脑区在功能上的竞争性抑制。PCC是监控感觉、立体定位、情绪控制及记忆作用的组织,是DMN的重要节点之一,aMCI患者在PCC出现连接增强〔13〕,本实验在rTMS干预后出现连接性的降低也可能与其对DMN的修复有关。
1Ding D,Zhao Q,Guo Q,etal.Prevalence of mild cognitive impairment in an urban community in China:a cross-sectional analysis of the Shanghai Aging Study〔J〕.Alzheimers Dement,2015;11(3):300-9.
2Petersen RC,Smith GE,Waring SC,etal.Mild cognitive impairment:clinical characterization and outcome〔J〕.Arch Neurol,1999;56(3):303-8.
3Klimesch W,Sauseng P,Gerloff C.Enhancing cognitive performance with repetitive transcranial magnetic stimulation at human individual alpha frequency〔J〕.Eur J Neurosci,2003;17(5):1129-33.
4Cotelli M,Calabria M,Manenti R,etal.Brain stimulation improves associative memory in an individual with amnestic mild cognitive impairment〔J〕.Neurocase,2012;18(3):217-23.
5Vannini P,Almkvist O,Dierks T,etal.Reduced neuronal efficacy in progressive mild cognitive impairment:a prospective fMRI study on visuospatial processing〔J〕.Psychiatry Res Neurol,2007;156(1):43-57.
6Buckner RL,Snyder AZ,Shannon BJ,etal.Molecular,structural,and functional characterization of Alzheimer's disease:evidence for a relationship between default activity,amyloid,and memory〔J〕.J Neurosci,2005;25(34):7709-17.
7尹文刚.神经心理学〔M〕.北京:科学出版社,2007:303.
8Bashir S,Edwards D,Pascual-Leone A.Neuronavigation increases the physiologic and behavioral effects of low-frequency rTMS of primary motor cortex in healthy subjects〔J〕.Brain Topography,2011;24(1):54-64.
9Siebner HR,Lang N,Rizzo V,etal.Preconditioning of low-frequency repetitive transcranial magnetic stimulation with transcranial direct current stimulation:evidence for homeostatic plasticity in the human motor cortex〔J〕.J Neurosci,2004;24(13):3379-85.
10Li X,Large C H,Ricci R,etal.Using interleaved transcranial magnetic stimulation/functional magnetic resonance imaging (fMRI) and dynamic causal modeling to understand the discrete circuit specific changes of medications:lamotrigine and valproic acid changes in motor or prefrontal effective connectivity〔J〕.Psychiatry Res Neuro,2011;194(2):141-8.
11Thomann PA,Schläfer C,Seidl U,etal.The cerebellum in mild cognitive impairment and Alzheimer′s disease-a structural MRI study〔J〕.J Psychiatric Res,2008;42(14):1198-202.
12张志珺.遗忘型轻度认知障碍患者AD转化的神经网络特征研究〔C〕.郑州:中国神经科学学会第九届全国学术会议暨第五次会员代表大会论文摘要集,2011:33.
13Qi Z,Wu X,Wang Z,etal.Impairment and compensation coexist in amnestic MCI default mode network〔J〕.Neuroimage,2010;50(1):48-55.
14陆勋林.大脑左侧角回的综合语言功能〔J〕.科教文汇(上旬刊),2009;(16):282-3.
15Devlin JT,Watkins KE.Stimulating language:insights from TMS〔J〕.Brain,2007;130(3):610-22.

