量子点荧光腹腔镜在胃癌治疗中的研究进展及前景*
刘长旭 综述 刘 昶 纪艳超 审校
(哈尔滨医科大学第四临床医学院普外三科,哈尔滨 150001)
胃癌是全球最常见的胃肠道恶性肿瘤之一[1]。我国是胃癌的高发地区,2005年以后,胃癌一直是我国癌症发病率和病死率居首位的癌症[2]。胃癌一直由于复发转移导致难以根治,肿瘤准确切除及转移淋巴结清扫可以使复发转移率大大降低。腹腔镜胃癌根治术已广泛开展[3~5],但无法对肿瘤范围及腹腔淋巴结转移范围进行精确定位[6]。荧光腹腔镜可以在术中直视下通过肿瘤显现的荧光有效区分出病变部位与非病变部位,还能发现常规腹腔镜难以觉察的其他组织转移[7],实现荧光导航辅助精准肿瘤切除。
1 荧光腹腔镜系统的组建
美国Stryker公司的标准腹腔镜系统经过以下改动,实现荧光腹腔镜系统组建:X8000氙气光源用于正常白光腹腔镜照明,该光源后面放置一个480 nm短波滤片,为防止滤片热损伤[8],其放在光缆的尾部,激发光源(L9000 LED灯)的光被一个玻璃滤光器(肖特GG495)过滤,此滤光器置于腹腔镜和1288P高清摄像头之间,利用电脑系统对激发光源的红色、蓝色和绿色成分进行调整,使荧光肿瘤得以可视化,可以同时显示不同荧光波长的肿瘤。
2 HER-2在胃癌组织中高表达
HER-2在胃癌组织中的高表达为荧光腹腔镜的靶向治疗提供了新的思路。HER-2/neu又称lien、C-erbB-2或P185,编码产物为185kD的跨膜精蛋白P185。HER-2基因在很多癌症中存在高表达或过表达,如乳腺癌、结直肠癌、膀胱癌及卵巢癌等,并影响预后。在人类的各种癌症中,有至少30%存在HER-2蛋白表达异常[9]。HER-2蛋白在胃癌的过表达率最高可达到88%[10],由此可见HER-2基因在胃部恶性肿瘤中扮演着关键角色,HER-2基因与胃癌的诊断及治疗有密切关系[11,12]。制作可以与HER-2特异性结合的量子点单抗荧光探针,使探针与肿瘤特异性结合,可在荧光腹腔镜下精确定位肿瘤的侵袭范围。
3 量子点纳米荧光探针在分子影像方面的优势
量子点(quantum dots,QDs)是一类纳米晶体,大小为1~10 nm。量子点比传统的荧光蛋白及有机染料荧光强度强,光化学稳定性也比其他染料好,不易发生光漂白[13];激发量子点发光的光谱比较宽且连续分布,而量子点的发射光谱窄且对称,通过改变量子点的直径和成分可获得从紫外线到近红外线范围内任意点的光谱;并且有比较强的穿透能力[14]。正是由于这些优点,量子点纳米荧光探针成为有广阔前景的腹腔镜成像工具[15,16]。量子点荧光探针在显像上有以下优点:①它的物理性质克服了荧光染色的障碍,使发射波长容易控制,而且量子点荧光探针的半衰期很长,是有机染料的100倍左右[17];②荧光强度维持能力强,在多次照射后仍能保持较高的荧光率,而且在多次激发后也可以保持无衰减状态[18]。因此,量子点纳米荧光探针在分子影像方面的这些优势,使得它具有良好的发展前景,也逐渐为人们所了解。
4 荧光腹腔镜在荧光探针实时显像中的应用
荧光腹腔镜可以在特定的激发光照射下使肿瘤发出荧光,分辨肿瘤和正常组织,术者可以在术中比较精准地切除肿瘤。术中实时荧光显像技术有能够精准定位肿瘤组织、实时便捷的优势。目前较为成熟的方法主要有荧光素钠以及δ-氨基-γ-酮戊酸(5-ALA)引导的术中实时荧光显像技术。但He等[19]报道,在部分病例中,由于5-ALA的光毒性较大,患者在术后必须避光24 h,这些缺点导致5-ALA不能在临床推广,限制了荧光显像技术的发展。相比之下,量子点纳米探针具有较好的实用效果,它的直径最小可以达到1 nm,半衰期(19.8±3.2)h,当正常机体组织细胞与量子点共同培养时90%以上的细胞都能存活下来,量子点的生物毒性仅为其他有机染料的1/500[20],因此量子点更加适合作为荧光腹腔镜的标记试剂。国内对荧光腹腔镜的研究鲜有报道。Metildi等[21]进行了小鼠胰腺肿瘤的荧光腹腔镜成像(图1),关于胃癌的治疗,Murayama等[22]应用5-ALA标记人体胃癌进行荧光腹腔镜下分期(图2),结果均证实荧光腹腔镜下观察肿瘤的边界较肉眼所见更为准确。
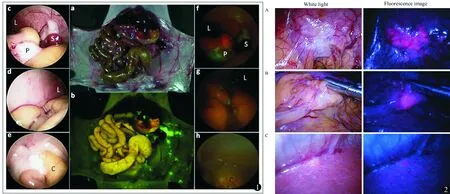
图1 普通白光和荧光下绿色荧光蛋白标记肿瘤的显像情况[21]:a,b分别为小鼠在白光下和荧光下的对比,c,d,e和f,g,h分别为在标准腹腔镜和荧光腹腔镜下小鼠内脏的成像情况。L-肝脏;P-胰腺;S-脾脏;C-盲肠 图2 5-ALA标记胃癌进行荧光腹腔镜下分期[22]:左、右列分别为白光与荧光腹腔镜下肿瘤的成像情况。A-胃癌;B-腹膜播散;C-肝脏转移
5 小结
荧光腹腔镜因其精准的特点已为人们所熟知,它可以较容易地区分出被标记组织与正常组织,目前已应用于肝癌的诊断以及胃肠道与妇科肿瘤的治疗之中。而量子点荧光腹腔镜因其灵敏度高,特异性好,也逐渐进入人们的视野。虽然它的使用在国内鲜有报道,但在国外已成功应用于消化道肿瘤的治疗,并且优势明显,它可以为消化道肿瘤患者术中导航精准切除肿瘤、辅助化疗以及提高预后奠定基础,为胃肠道肿瘤的治疗提供新思路。量子点荧光腹腔镜今后将广泛应用于胃癌的治疗。
1 NCCN.NCCN guidelines for gastric cancer (version 1.2014).Fort Washington:NCCN,2014[2014-07-09].https://www.nccn.org/professionals/physician_gls/f_guidelines.asp#gastric
2 邹文斌,李兆申.中国胃癌发病率及死亡率研究进展.中国实用内科杂志,2014,34(4):408-415.
3 Quan YJ,Huang A,Ye M,et al.Comparison of laparoscopic versus open gastrectomy for advanced gastric cancer:an updated meta-analysis.Gastric Cancer,2016,19(2):939-950.
4 Yamanaka N,Nagai E,Ohuchida K.Feasibility of laparoscopic gastrectomy for advanced gastric cancer with positive peritonealcytology.Surg Today,2013,43(6):859-864.
5 Kim HH,Han SU,Kim MC,et al.Long-term results of laparoscopic gastrectomy for gastric cancer:a large-scale case-control and case-matched Korean multicenter study.Clin Oncol,2014,32(7):627-633.
6 Waddell T,Verheij M,Allum W,et al.Gastric cancer:ESMO-ESSO-ESTRO Clinical Practice Guidelines for diagnosis,treatment and follow-up.Radiother Oncol,2014,110(1):189-194.
7 McElroy M,Kaushal S,Luiken GA,et al.Imaging of primary and metastatic pancreatic cancer using a fluorophore-conjugated anti-CA19-9 antibody for surgical navigation.World J Surg,2008,32(6):1057-1066.
8 Tran Cao HS,Kaushal S,Lee C,et al.Fluorescence laparoscopy imaging of pancreatic tumor progression in an orthotopic mouse model.Surg Endosc,2011,25(1):48-54.
9 Kim HL,Jeon KH,Jun KY,et al.A potent topoisomerase inhibitor,inhibits the expression of human epidermal growth factor receptor 2.Cancer Lett,2012,325(1):72-79.
10 Cui H,Cheng Y,Piao SZ,et al.Correlation between HER-2/neu(erbB-2)expression level and therapeutic effect of combination treatment with HERCEPTIN and chemotherapeutic agents in gastric cancer cell lines.Cancer Cell Int,2014,14(1):1-10.
11 Park DI,Yun JW,Park JH,et al.HER-2/neu amplification is an independent prognostic factor in gastric cancer.Dig Dis Sci,2006,51(4):1371-1379.
12 Janjigian YY,Viola-Villegas N,Holland JP,et al.Monitoring afatinib treatment in HER2-positive gastric cancer with 18F.Nucl Med,2013,54(6):936-943.
13 Byers RJ,Hitchman ER.Quantum dots brighten biological imaging.Prog Histochem Cytochem,2011,45(4):201-237.
14 Yang K,Cao YA,Li ZG,et al.Visual imaging for buccal carcinoma with nearinfrared fluorescent quantum dots in vivo.Chin J Stomatol,2011,46(3):134-138.
15 Li ZG,Kai Y,Cao YA,et al.In vivo study of the effects of peptide-conjugated near-infrared fluorescent quantum dots on the tumorigenic and lymphatic metastatic capacities of squamous cell carcinoma cell line Tca8113 and U14.Mol Sci,2010,11(4):1413-1422.
16 Sun DP,Yang K,Zheng G,et al.Study on effect of peptide-conjugated near-infrared fluorescent quantum dots on the clone formation,proliferation,apoptosis,and tumorigenicity ability of human buccal squamous cell carcinoma cell line BcaCD885.Int J Nanomedicine,2010,5(1):401-405.
17 Tang R,Xue J,Xu B,et al.Tunable ultrasmall visible to extended near infrared emitting silver sulfide quantum dots for integrin targeted cancer imaging.ACS Nano,2015,9(1):220-230.
18 Kairdolf BA,Smith AM,Stokes TH,et al.Semiconductor quantum dots for bioimaging and biodiagnostic applications.Annu Rev Anal Chem,2013,6(2):143-162.
19 He Z,Zhu H,Zhou P.Microwave-assisted aqueous synthesis of highly luminescent carboxymethyl chitosan-coated CdTe/CdS quantum dots as fluorescent probe for live cell imaging.J Fluoresc,2012,22(1):193-199.
20 Jing L, Ding K, Kershaw SV,et al. Magnetically engineered semiconductor quantum dots as multimodal imaging probes. Adv Mater,2014,26(37):6367-6386.
21 Metildi CA,Kaushal S,Lee C,et al.An LED light source and novel fluorophore combinations improve fluorescence laparoscopic detection of metastatic pancreatic cancer in orthotopic mouse models.J Am Coll Surg,2012,214(6):997-1007.e2.
22 Murayama Y,Ichikawa D,Koizumi N,et al.Staging fluorescence laparoscopy for gastric cancer by using 5-aminolevulinic acid.Anticancer Res,2012,32(12):5421-5427.

