股动静脉途径插管体外膜式氧合循环辅助的学习曲线
廉 波 李 勍 陈 彧 赵 舟 高 卿 韩增强
(北京大学人民医院心脏外科,北京 100044)
体外膜式氧合(extracorporeal membrane oxygenation,ECMO)技术越来越多地应用到严重心肺功能衰竭。自1972年第1例成功的ECMO辅助报道以来[1],ECMO相关的管路涂层、膜肺、动静脉插管设计等技术不断发展。ECMO建立过程中的血管插管技术毕竟是一种侵入性操作,存在一些潜在的负性并发症,例如血管损伤、出血、血栓事件、肢体缺血、感染风险[2]。ECMO辅助方式分为静-静脉(veno-venous,VV-ECMO)和静-动脉(veno-arterial,VA-ECMO)2种模式,VV-ECMO常用于心功能正常的严重呼吸功能衰竭的患者,VA-ECMO常用于辅助心源性休克循环衰竭的患者。我院2007年8月~2016年5月对37例难治性心功能衰竭(心衰)或合并呼吸功能衰竭行VA-ECMO辅助,本研究旨在探讨经股动静脉途径插管VA-ECMO的学习曲线。
1 临床资料与方法
1.1 一般资料
本组37例,女15例,男22例。年龄(55.9±12.4)岁。瓣膜术后心源性休克5例,缩窄性心包炎术后心源性休克1例,急性心肌炎3例,急性肺栓塞循环衰竭4例,冠状动脉旁路移植术后心源性休克22例,急性呼吸窘迫综合征合并心功能异常2例。合并糖尿病22例,肾功能不全9例,慢行阻塞性肺病5例,外周动脉血管疾病8例。欧洲心脏手术风险评估系统(European system for cardiac operative risk evaluation, EuroSCORE)[3]评分为(9.46±3.20)分。
1.2 方法
使用Maquet BE-PLS 2050管路套包、Maquet BE-PAS动脉插管和Maquet BE-PVL静脉插管。
均使用股动静脉途径插管建立ECMO辅助通路,由同一位心脏外科医生完成。术者评估患者适应证,决定行VA-ECMO辅助后开始计时,计时分为两段:准备时间和手术操作时间。准备时间从确定需要VA-ECMO辅助至开始消毒时间,准备工作包括:护理人员对ECMO机器的准备,主管医生对患者的术前准备,手术助手准备床旁手术器械,灌注师准备耗材和预充膜肺管路;手术操作时间为开始消毒时间至切口缝合完成的时间。选择腹股沟纵行或横行皮肤切口,充分暴露股动脉,选择股动脉直接插管并向远端建立侧支循环,或者股动脉纵行切开后端侧吻合8 mm人工血管,动脉插管放置于人工血管内——“烟囱技术”。前21例使用直接插管手术技术,后16例使用“烟囱技术”。
1.3 评价指标设立和量化
在早期,累积和(cumulative sum,CUSUM)分析法多用于工业生产评价工人劳动技能,近10年被越来越多地应用于临床技术学习曲线的描述[4]。本研究选择手术时间、出血量、下肢缺血、插管部位二次切开4项指标作为CUSUM的评价指标。评价指标以术者的相关指标平均数据作为目标值,然后计算各项评价指标达到目标值的比例,再根据学习曲线评价指标计算公式δ=Xi-X0得出δ值,即为每例操作水平的量化值。其中X0为评价指标所设目标值的失败率,当评价指标达到目标值时Xi=0,若未达到所设目标值则Xi=1[5]。
①手术时间(δ1):平均手术时间117 min(目标值),其中≤117 min占65%,即失败率为35%。当病例手术时间≤117 min时,该例δ1=0-0.35=-0.35;若操作时间>117 min时,该例δ1=1-0.35=0.65。
②出血量(δ2):平均出血量458 ml(目标值),其中≤458 ml占51%,即失败率为49%。当病例出血量≤458 ml时,该例δ2=0-0.49=-0.49;若病例手术出血>458 ml时,该例δ2=1-0.49=0.51。
③下肢缺血(δ3):本组下肢缺血比例为43%,当病例未发生下肢缺血,δ3=0-0.43=-0.43;若发生下肢缺血表现,δ3=1-0.43=0.57。
④插管部位二次切开(δ4):本组因插管手术部位出血或下肢缺血导致需要二次切开进行手术处理占27%,当病例未发生下肢缺血表现,δ4=0-0.27=-0.27;若发生下肢缺血表现,δ4=1-0.27=0.73。
参照公式∑=δ1+δ2+δ3+δ4,计算每例手术的4项评价指标的和。绘制学习曲线,横坐标(X)为手术例数,纵坐标 (Y)为∑i(依次累加值),首例病例的CUSUM值是4项量化指标的和;第2例的CUSUM值是第2例的4项量化指标的和,再加上第1例的CUSUM值,以此类推至第37例[5,6]。
1.4 统计学处理
应用SPSS19.0软件曲线拟合X与Y的曲线关系,求出学习曲线函数公式,拟合模型检验以P值判断,P<0.05曲线拟合成功。以系数R2判断拟合优度,R2越接近于1,曲线拟合优度越高,R2最高的模型,即为最佳拟合模型[5]。根据函数公式计算曲线斜率k,k值在逐渐减小的过程中,开始变为负值时所对应的手术例数即为掌握该手术所需要的最小手术例数。
2 结果
手术时间(117.2±23.8)min,其中准备时间(43.3±24.3)min,手术操作时间(74.0±8.9)min。出血量(458.4±234.8)ml。术后下肢缺血16例,需要二次切开插管部位解决出血或缺血10例,成功脱机17例,死亡23例。
手术时间和出血量随手术例数增加的变化趋势见图1。手术时间随手术例数的增加逐渐减少,其中准备时间减少趋势比较明显,手术操作时间随手术例数的增加变化不大;出血量随手术例数的增加呈减少趋势。应用SPSS19.0软件进行曲线拟合,二次方曲线、复合函数曲线、指数曲线、三次方曲线的拟合曲线模型检验P值均<0.05,拟合优度系数R2分别是0.964,0.133,0.133,0.994,判断最佳拟合模型曲线为三次方曲线(图2),拟合方程为∑i(CUSUM值)=0.001X3-0.136X2+3.449X-2.012。根据函数公式计算曲线斜率k,k值在逐渐减小的过程中,由16例开始变为负值,见表1。
3 讨论
VA-ECMO最常见的临床适应证是:心脏病术后出现心源性休克,难以脱离体外循环辅助,失代偿非心肌缺血性心衰[7],急性心肌梗死后心源性休克[8],难治性的重症心肌炎[9],急性肺动脉栓塞循环难以维持[10,11],心肺移植前的过渡治疗[12,13]等。本研究的病例分布特点和文献报道的适应证相符合。
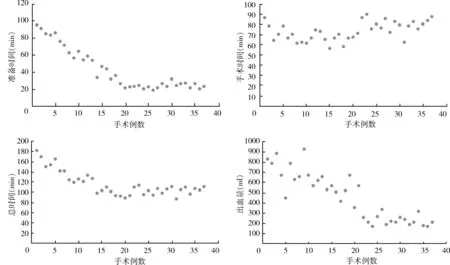
图1 VA-ECMO手术时间和出血量随手术例数增加的变化趋势

图2 VA-ECMO股动脉途径插管CUSUM学习曲线
ECMO建立过程中的血管插管技术是一种侵入性操作,血管插管过程和术后辅助过程中可能出现一些致命性并发症,例如:插管术中出现血管损伤、严重出血,辅助过程中出现出凝血功能障碍、肢体缺血、无菌性炎性反应、感染等问题。Barbaro等[14]2015年报道ECMO辅助治疗需要一个有经验、有良好组织的团队来完成,这个团队需要有一定的病例积累。本研究37例VA-ECMO辅助均由一名外科医生完成,通过对学习曲线的描述来评价VA-ECMO技术掌握情况。CUSUM分析法是第二次世界大战后由Wald等最先用于生产线产品质量控制的一种统计学模式,由于这种统计学方法能够满足临床技术学习和质量控制的要求,被越来越多地用于对临床技术学习曲线的描述[4]。然而使用CUSUM技术首先要决定使用哪些量化指标,并定义这些量化指标的目标值。本研究使用的量化指标是外科技术最常见的手术时间、出血、并发症、二次手术等4个指标,这4个指标在不同的治疗中心的定义和结果存在很大区别。因此,本研究使用的目标值是病例各项平均值和发生率。
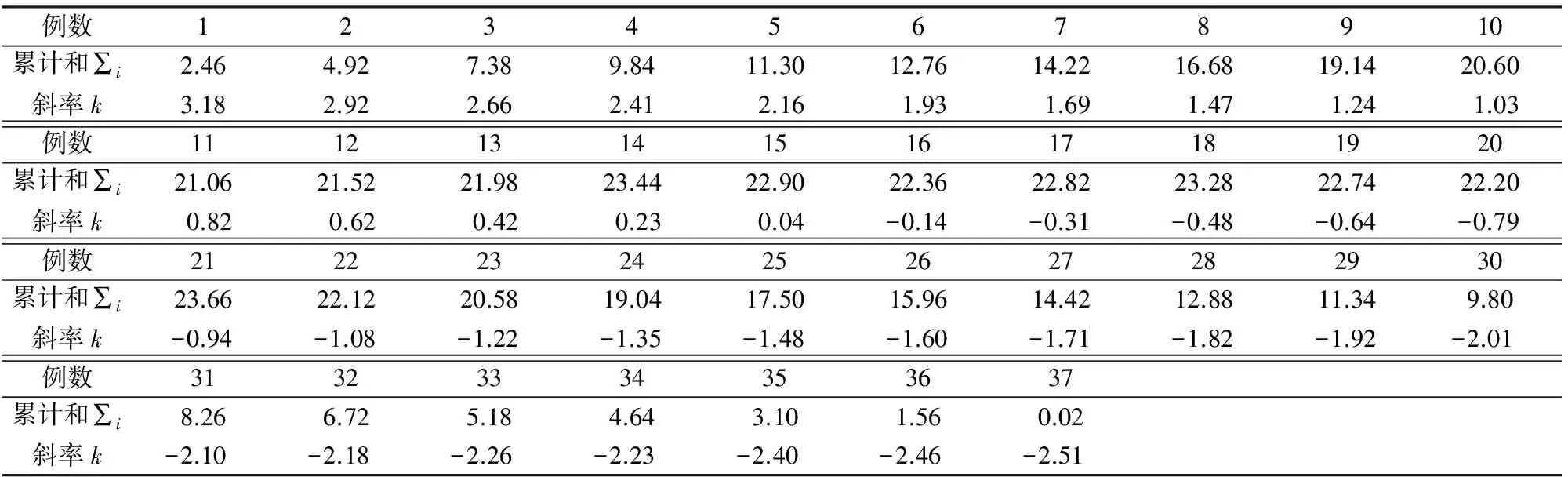
表1 VA-ECMO手术例数累计和值与曲线斜率值
大部分文献将ECMO手术时间定义为准备时间和手术操作时间,准备时间是从确定需要VA-ECMO辅助至开始消毒时间;手术时间为开始消毒时间至切口缝合完成的时间[15]。从图1的时间变化曲线我们可以看出,随着手术例数的不断增加,准备时间明显缩短,手术操作时间比较稳定,总时长随手术例数的增加有减少的趋势。本组病例开始阶段,患者准备由术者助手和护理人员共同完成,但手术器械、耗材的准备和预充工作均由术者完成,随着手术例数的增加,参与各项准备工作的医、技、护人员逐渐增多,形成治疗常规,当VA-ECMO适应证确立后,各项准备工作由专门的人员负责并快速启动,准备时间由最初的93 min逐渐稳定到25 min左右。手术操作时间比较稳定,后16例手术时间略有上升,可能与插管手术技术有关。总体手术时间减少,与准备时间的明显减少趋势相同。
出血量随手术例数的增加有减少趋势,可能与术者的手术经验和出凝血管理经验有关。本组远端肢体缺血发生率较高(16/37,43%),大部分文献报道下肢缺血发生率在20%左右,股动脉直接插管并建立远端侧支循环能够比较好地解决远端肢体缺血表现[16,17],这个结论与我们观察到的表现不相符,可能的因素是:①对远端肢体缺血的定义不同,本组将下肢缺血定义为远端肢体紫绀的发生;②直接股动脉插管向肢体远端建立侧支循环的管路直径较细。因为下肢缺血发生率较高,术者在后16例改变动脉插管策略,使用“烟囱技术”完成股动脉插管,16例中1例出现下肢缺血表现,发生在术后第5天,血管超声怀疑肢体远端微栓形成所致。本组二次切开血管插管部位的发生率较高(10/37,27%)二次切开的原因是难以接受的下肢缺血或者出血,早期手术期间二次切开例数较多,后16例无二次切开事件发生。
将上述评价指标进行量化,利用CUSUM分析法,结合SPSS的曲线拟合模型,我们得出第16例出现学习曲线的拐点,提示术者在16例后基本掌握VA-ECMO辅助的动静脉插管技术。
1 Hill JD, O‘Brien TG, Murray JJ, et al. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung. New Engl J Med,1972,286(12):629-634.
2 Zangrillo A, Landoni G, Biondi-Zoccai G, et al. A meta-analysis of complications and mortality of extracorporeal membrane oxygenation. Crit Care Resusc,2013,15(3):172-178.
3 仓正强,魏渝鉴,张杨杨.EuroSCORE临床应用回顾和展望.中国胸心血管外科临床杂志,2016,23(10):1012-1018.
4 Biswas P, Kalbfleisch JD. A risk-adjusted CUSUM in continuous time based on the Cox model. Stat Med,2008,27(17):3382-3406.
5 Bolsin S, Colson M. The use of the Cusum technique in the assessment of trainee competence in new procedures. Int J Qual Health Care,2000,12(5):433-438.
6 高 峰,许李力.CUSUM绘制在心外科住院医师临床培养中的应用.中华医学教育探索杂志,2015,14(4):397-400.
7 Guenther S, Theiss HD, Fischer M, et al. Percutaneous extracorporeal life support for patients in therapy refractory cardiogenic shock: initial results of an interdisciplinary team. Interact Cardiovasc Thorac Surg,2014,18(3):283-291.
8 Sheu JJ, Tsai TH, Lee FY, et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Crit Care Med,2010,38(9):1810-1817.
9 Asaumi Y, Yasuda S, Morii I, et al. Favourable clinical outcome in patients with cardiogenic shock due to fulminant myocarditis supported by percutaneous extracorporeal membrane oxygenation. Eur Heart J,2005,26(20):2185-2192.
10 Hoeper MM, Tudorache I, Kühn C, et al. Extracorporeal membrane oxygenation watershed. Circulation,2014,130(10):864-865.
11 Belohlavek J, Rohn V, Jansa P, et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. J Invasive Cardiol,2010,22(8):365-369.
12 Olsson KM, Simon A, Strueber M, et al. Extracorporeal membrane oxygenation in nonintubated patients as bridge to lung transplantation. Am J Transpl,2010,10(9):2173-2178.
13 Javidfar J, Brodie D, Takayama H, et al. Safe transport of critically ill adult patients on extracorporeal membrane oxygenation support to a regional extracorporeal membrane oxygenation center. ASAIO J,2011,57(5):421-425.
14 Barbaro RP, Odetola FO, Kidwell KM, et al. Association of hospital-level volume of extracorporeal membrane oxygenation cases and mortality.Am J Respir Crit Care Med,2015,191(8):894-901.
15 Sanchez-Glanville C, Brindle ME, Spence T, et al. Evaluating the introduction of extracorporeal life support technology to a tertiary-care pediatric institution: Smoothing the learning curve through interprofessional simulation training. J Pediatr Surg,2015,50(5):798-804.
16 Foley PJ, Morris RJ, Woo EY, et al. Limb ischemia during femoral cannulation for cardiopulmonary support. J Vasc Surg,2010,52(4):850-853.
17 Hendrickson SC, Glower DD. A method for perfusion of the leg during cardiopulmonary bypass via femoral cannulation. Ann Thorac Surg,1998,65(6):1807-1808.

