DNA损伤修复相关因子在宫颈癌组织中表达的研究
吴 郁 姚 颖 李文静 金一枚 杨 沫 郭红燕
(北京大学第三医院妇产科,北京 100191)
宫颈癌是常见的妇科恶性肿瘤,高居妇科恶性肿瘤第2位[1]。随着宫颈癌筛查的普及和手术、放疗技术的发展,尤其腹腔镜手术的发展[2],宫颈癌预后得到改善,但是临床上一部分患者诊断时已经晚期,治疗棘手,因此,精确的早期诊断仍然是临床面临的难点。目前,生物标记物相关研究成为疾病早期诊断及预后的热点。DNA损伤修复与肿瘤的发生、发展密切相关,可能会造成DNA错误,诱发肿瘤的发生。磷酸化组蛋白H2AX(γH2AX)与磷酸化毛细血管扩张性共济失调突变因子(phospho-ataxia telangiectasia mutation,pATM)共同参与非同源末端链接(nonhomologous end joining, NHEJ)DNA损伤修复过程,是细胞内对于DNA双链断裂的一种快速敏感的反应,因此,γH2AX可以作为DNA损伤的标记物分子。另外,γH2AX与宫颈癌新辅助化疗后完全缓解率显著相关[3,4]。本研究探讨H2AX与ATM 2个目标分子在宫颈癌中的表达,旨在为宫颈癌早期精确诊断提供新的手段。
1 临床资料与方法
1.1 一般资料
选取2016年1月~2017年7月我科就诊的30例宫颈癌(宫颈癌组),年龄30~62岁,平均45.7岁。FIGO分期:ⅠB1期4 例,ⅠB2期8例,Ⅱ A期6例,Ⅲ期10例,Ⅳ期2例。HPV16阳性20例,HPV18阳性7例,HPV56阳性2例,HPV阴性1例。病理:鳞癌22例,腺癌8例。对照组选取我科就诊的18例非宫颈癌(年龄44~57岁),包括子宫肌瘤(13例)、子宫内膜息肉(5例)。
1.2 方法
1.2.1 实验试剂与耗材 逆转录试剂盒(thermo, K1622),TRIZOL,无水乙醇,氯仿,异丙醇,荧光定量PCR试剂盒(takara RR420A),免疫组化试剂盒PV900,苏木素-伊红染色液,γH2AX一抗(CST 2755S,1∶100,兔来源,pATM一抗(NOVUS NB100-306,1∶200,鼠单抗)。qRT-PCR仪[QuantStudio 3 Real-Time PCR(96-well 0.2 ml Block)],组化湿盒及相关器材,显微镜(日本Nikon ECLIPSE 80i,Nikon corporation)等。
1.2.2 实验方法
1.2.2.1 实时定量PCR 取宫颈癌组和对照组的宫颈组织,Trizol法提取总RNA。Nanodrop2000检测RNA浓度。采用thermo K1622逆转录试剂盒,按照试剂说明书添加逆转录体系,获得cDNA文库。设计H2AX和ATM,β-actin引物。H2AX 上游引物 5’-GTTCCCAGTGGGCCGTGTA-3’,下游引物5’- CTGGTCTTCTTGGGCAGCA-3’;ATM 上游引物 5’-TCGGCATTCAGATTCCAAACA-3’, 下游引物5’-TGAGAAATCTCCAAGGATCTGGT-3’;β-actin上游引物 5’-CTCTCCCTCACGCCATC-3’, 下游引物5’-ACGCACGATTTCCCTCTC3’。 引物由华大基因合成。按照实时定量PCR试剂盒添加体系反应。PCR反应条件:90 ℃,30 s;95 ℃,5 s,60 ℃,30 s(45个循环);95 ℃,60 s;55 ℃,30 s。
1.2.2.2 免疫组化 ①4%多聚甲醛室温组织固定过夜,修整组织。组织常规石蜡包埋、切片,切片厚度为0.5 μm。②柠檬酸抗原修复缓冲液高温修复。③阻断内源性过氧化物酶。④孵育一抗:滴加γH2AX和pATM一抗,γH2AX和pATM的抗体分别按照1∶100和1∶200稀释。4 ℃孵育过夜。⑤孵育二抗: PBS(pH 7.4)洗涤3次,每次5 min,二抗(HRP标记)按照1∶200稀释覆盖组织,室温孵育50 min。⑥DAB显色,自来水冲洗终止。⑦复染细胞核。⑧脱水封片。结果评估:
宫颈癌组和对照组γH2AX和pATM免疫组化染色结果阳性呈黄色或棕黄色。免疫组化染色的强度和分布采用国际Remmele 评分(international remmele score,IRS)半定量评分系统[5]。染色强度:0分=无,1分=弱,2分=中等,3分=强;阳性细胞百分比:0分=无,1分=<1%,2分=1%~10%, 3分=11%~33%,4分=34%~66%,5分=67%~100%,综合评分最高分8分。综合评分0分记(-),1~2分记(+),3~5分记(++),6~8分记(+++)。-和+代表阴性,++和+++代表阳性。免疫组化染色的评分由2位病理科医生遵循互盲原则进行,二者评分不一致时取均值。
1.2.2.3 HE染色 按照常规方法,石蜡切片脱蜡,常规苏木精-伊红染色,中性树胶封片。
1.3 统计学分析
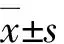
2 结果
2.1 H2AX和ATM 在mRNA水平的表达情况
实时定量PCR分析宫颈癌组和对照组H2AX和ATM的表达,通过相对定量计算方法2-ΔCT,β-actin为内参基因。宫颈癌组ATM mRNA和H2AX mRNA相对表达量较对照组显著高表达,见表1。
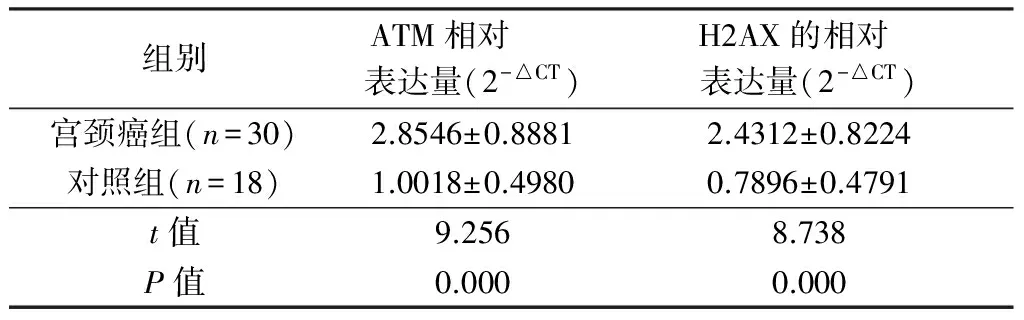
表1 宫颈癌组和对照组H2AX和ATM mRNA表达情况
2.2 HE染色和免疫组化
宫颈癌组γH2AX综合评分中位数4分(0~8分),显著高于对照组中位数0分(0~5分)(Mann-WhitneyU检验,Z=-4.027,P=0.000);宫颈癌组pATM综合评分中位数5分(0~8分),显著高于对照组中位数0分(0~5分)(Mann-WhitneyU检验,Z=-4.468,P=0.000)。宫颈癌组γH2AX阳性24例(80.0%),对照组阳性2例(11.1%),宫颈癌组显著高于对照组;宫颈癌组pATM阳性 25 例(83.3%),对照组阳性3例(16.7%),宫颈癌组显著高于对照组,见表2。HE染色见图1,免疫组化染色见图2。
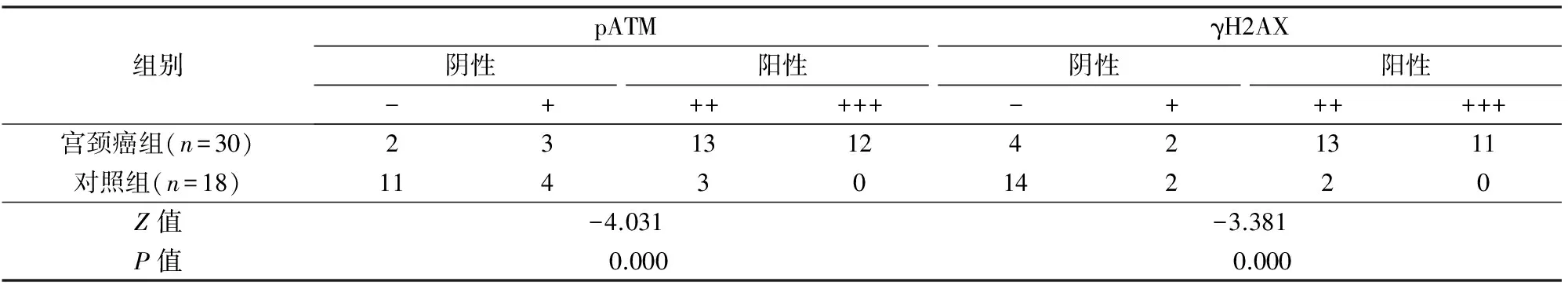
表2 宫颈癌组和对照组pATM和γH2AX免疫组化综合评分比较
注:-和+代表阴性,++和+++代表阳性
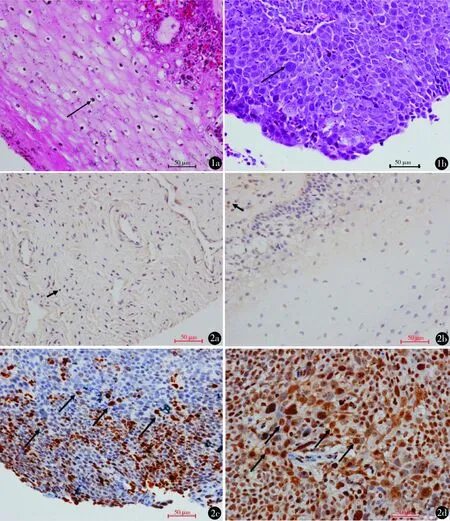
图1 宫颈癌组和对照组HE染色 a.对照组宫颈上皮细胞排列整齐,细胞核形态正常(黑色箭头:正常宫颈上皮);b.宫颈癌组可见明显癌灶,细胞排列紊乱,细胞核形态消失(黑色箭头:癌细胞) (HE染色 ×200) 图2 宫颈癌组和对照组γH2AX和pATM免疫组化表达情况 a,b.对照组γH2AX和pATM免疫组化(黑色箭头:细胞呈弱阳性);c,d.宫颈癌组γH2AX和pATM免疫组化均有明显表达,棕黄色或黄色为阳性显色,两者均定位于细胞核( ×200)
3 讨论
在我国,宫颈癌患者每年新发病例约在11万以上,每年有2万~3万女性死于宫颈癌。与其他肿瘤相比,宫颈癌具有明确的致病因素及癌前病变病程进展,通过早期预防和筛查,可以降低发病率和死亡率[6]。性交年龄早、多个性伴侣、早婚、早产、多次流产、肥胖、家族史、高危型HPV16和18感染均可导致宫颈癌的发生。宫颈癌预后与多因素相关,年龄是宫颈癌患者独立预后因素之一[7]。目前,宫颈癌的研究重心已转向对癌前病变的早期发现和治疗[8]。本研究探讨参与DNA双链损伤修复相关因子γH2AX和pATM在宫颈癌中的表达情况,并分析其是否可以作为诊断预测的标记分子。本研究中免疫组化判读结果将“+”判定为阴性,是根据黄晓园等[9]的评分判断方法,以除外非特异性染色的干扰。本研究结果显示二者在mRNA和蛋白质水平宫颈癌组织中表达明显高于对照组(P均=0.000)。因此,γH2AX和pATM因子在宫颈癌的早期诊断有一定临床意义。
DNA损伤是肿瘤发生的明确病因,尤其是DNA双链断裂伴随细胞周期检查点的激活。宫颈癌可能由于DNA损伤导致肿瘤的发生,并伴随DNA损伤修复相关因子的激活[10]。pATM 和γH2AX是参与DNA双链断裂损伤修复的重要因子,ATM活化会进一步激活γH2AX,磷酸化修饰会启动DNA修复和激活检查点的相关途径,从而阻止细胞周期的进展[11,12]。Roossink 等[13]研究DNA损伤修复(DNA damage repair,DDR)组成成分包括pATM在内作为潜在的治疗靶点以及DDR活化在放化疗的宫颈癌患者的预测和预后价值,最终认为宫颈癌患者中pATM对放化疗的保护性意义,并指出pATM抑制可能是促进放化疗的可能途径。γH2AX是磷酸化的H2AX,可以作为宫颈癌患者新辅助化疗的预测因子,但仍需进一步探索[14]。对宫颈癌的特征性信号通路和基因的探索研究显示,ATM 信号通路的激活、细胞周期调控异常、内切酶活性增强和3q 区域的扩增等都有希望成为评价宫颈癌发病风险的指标,提供更好的宫颈癌防治策略[15]。
宫颈癌可通过定期妇科体检达到一定的预防、早期诊断目的,但患者早期症状无特异性,临床误诊、漏诊率较高[16],诊断缺乏准确性,无论是病毒还是肿瘤相关标记物检测均没有完全准确的手段,感染程度和癌症病程进展关系难以提前预知[17]。早期检出并给予积极的治疗是防治宫颈癌的关键,目前,宫颈癌的诊断多通过TCT、高危型HPV感染、肿瘤相关标记物以及影像学检查等联合诊断[18~21]。本文提出DNA损伤修复因子γH2AX和pATM参与宫颈癌的发生,期望通过对宫颈组织早期检测达到诊断目的。近年来,不断出现新的宫颈癌相关的生物标记,比如ATB(转化生长因子-β诱导激活的一种lnc RNA)的高表达是宫颈癌预后的独立危险因素[22],PBX3(Pre-B-cell leukemia homeobox 3)[23]和 microRNA-466也同样发现有宫颈癌早期预测,疾病进展以及预后的标记作用[24]。本研究显示宫颈癌细胞中存在显著的γH2AX与pATM激活,即大量的DNA损伤,表明DNA损伤很可能是驱动癌症发生的主要原因之一。除γH2AX与pATM外,细胞内还含有数十种其他DNA损伤响应因子,如MDC1、NBS1、PNKP等。这些因子的功能异常或基因突变都有可能引起DNA损伤修复的失败、基因组紊乱以及最终的癌症发生。因此,检测DNA损伤修复因子的基因表达或相关生化特性,很可能对宫颈癌的早期诊断及分级治疗提供新策略。
1 应 倩,夏庆民,郑荣寿,等.中国2009年宫颈癌发病与死亡分析.中国肿瘤,2013,22(8):612-616.
2 张昕蕾,张 军,蔡有芹,等.腹腔镜手术治疗108例宫颈癌的临床分析.中国微创外科杂志,2016,16(11):980-982.
3 Larsen DH,Stucki M.Nucleolar responses to DNA double-strand breaks.Nucleic Acids Res,2016,44(2):538-544.
4 Vici P, Buglioni S, Sergi D, et al.DNA damage and repair biomarkers in cervical cancer patients treated with neoadjuvant chemotherapy: an exploratory analysis.PloS One,2016,11(3):e0149872.
5 Cuppens T, Annibali D, Coosemans A, et al. Potential targets’ analysis reveals dual PI3K/mTOR pathway inhibition as a promising therapeutic strategy for uterine leiomyosarcomas-an ENITEC Group initiative. Clin Cancer Res,2017,23(5):1274-1285.
6 李英伟,刘海枝.宫颈癌高危因素及检测的研究进展.中外医疗,2010,29(5):98-99.
7 郑晓霞,李琼珍,李 玲,等.宫颈癌预后状况及其影响因素分析.实用癌症杂志,2014,29(3):314-316.
8 Wright TC Jr, Massad LS, Dunton CJ, et al.2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol,2007,197(4):340-345.
9 黄晓园,李琼珍,马 丁,等. Chkl /2和Pl kl 蛋白在宫颈良恶性病变组织中的表达及其意义.中国癌症杂志,2007,17(6):429-432.
10 Jin Y,Xu X,Li M,et al.Increasing sensitivity to DNA damage is a potential driver for human ovarian cancer. Oncotarget,2016,7(31):49710-49721.
11 Turinetto V, Giachino C. Multiple facets of histone variant H2AX: a DNA double-strand-break marker with several biological functions. Nucleic Acids Res,2015,43(5):2489-2498.
12 Larsen DH, Stucki M. Nucleolar responses to DNA double-strand breaks. Nucleic Acids Res,2016,44(2):538-544.
13 Roossink F, Wieringa HW, Noordhuis MG, et al.The role of ATM and 53BP1 as predictive markers in cervical cancer.Int J Cancer,2012,131(9):2056-2066.
14 Zhao J, Wang Q, Li J, et al.Comparative study of phosphorylated histone H2AX expressions in the cervical cancer patients of pre- and post-neoadjuvant chemotherapy.Eur J Gynaecol Oncol,2015,36(3):318-322.
15 程 静,潘光鑫,周 素,等.宫颈癌发病机制的探讨.中国妇幼保健,2014,29(28):4545-4547.
16 姚春慧,李 波,谭 娟,等.子宫颈癌患者肿瘤标志物联合MRI影像诊断的临床价值.中国CT和MRI杂志,2017,15(6):103-106.
17 王 楠,马 蓉,吴建中,等.宫颈癌的发病机制、诊断及治疗进展.中国肿瘤外科杂志,2013,5(2):121-124.
18 杨 辉,郑 君.联合检测血清SCCA、CA19-9及CA125对宫颈癌诊断及预后判断的临床意义.中国妇幼保健,2013,28(5):772-774.
19 颜 萍,龚旭华.多种血清肿瘤标志物检测在早期宫颈癌诊断中的意义.实用癌症杂志,2014,29(7):741-743.
20 左拥军,史丽静,谢 雁.MRI扫描技术对诊断宫颈癌的临床研究.中国临床医生杂志,2017,45(2):83-86.
21 张志娟,薛 燕.TCT与高危型HPV-DNA检测在宫颈癌筛查中的应用价值探讨.中国妇幼保健,2016,31(24):5339-5341.
22 Cao W, Peng T, Zhou Y.Long noncoding RNA activated by transforming growth factor-β promotes cancer development and is a prognostic marker in cervical cancer.J Cancer Res Ther,2017,13(5):801.
23 Li H, Sun G, Liu C,et al. PBX3 is associated with proliferation and poor prognosis in patients with cervical cancer. Onco Targets Ther,2017,10:5685-5694.
24 Zhou LL, Shen Y, Gong JM, et al.MicroRNA-466 with tumor markers for cervical cancer screening.Oncotarget,2017,8(41):70821-70827.

