还原型谷胱甘肽联合复方甘草酸苷治疗药物性肝损伤疗效观察
齐正
药物性肝损伤(DILI)是患者在疾病治疗期间因药物或其代谢产物对肝脏造成的损伤或者过敏反应,也被称为药物性肝炎[1]。该病既可以发生在肝脏健康的患者群体,也可以发生在患有肝脏疾病或者肝脏相关疾病的患者群体,后者该病的发病率相对较高[2]。在所有药物损伤病例中约有10%~15%为DILI,DILI的发病率紧随皮肤黏膜损伤及药物热之后。在我国,约有10%的急性肝炎住院患者为DILI,10%~50%成年人的转氨酶升高是由药物引发的[3]。根据世界卫生组织(WHO)相关研究统计结果,DILI在全球致死原因中已位居第5位[4]。因此,对于DILI的有效治疗成为消化内科医生关注的焦点。
1 资料与方法
1.1 一般资料 选取我院2015年5月至2016年12月消化内科收治的76例DILI患者,所有患者均根据中华医学会消化病分会肝胆疾病协会提出的《急性药物性肝病诊断标准》(2007)[5]确诊为DILI。按随机法分为对照组和观察组,各38例。对照组男性21例,女性17例,年龄24~78岁,平均(45.87±5.29)岁,解热镇痛类药物损伤10例,抗结核类药物损伤8例,降血糖类药物损伤4例,中药类药物损伤6例,抗生素类药物损伤8例,其他药类药物损伤2例。观察组:男性22例,女性16例,年龄21~75岁,平均(45.31±5.66)岁,解热镇痛类药物损伤11例,抗结核类药物损伤10例,降血糖类药物损伤2例,中药类药物损伤5例,抗生素类药物损伤7例,其他药类药物损伤3例。两组患者的性别、年龄及药物损伤种类等一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法 对照组(复方甘草酸苷治疗),40 mL复方甘草酸苷注射液(海南通用同盟药业有限公司,国药准字H20052289)加入250 mL葡萄糖注射液(质量浓度为0.05 g/mL,山西晋新双鹤药业有限责任公司,国药准字H14022409),静脉滴注,1次/d。
观察组(还原型谷胱甘肽联合复方甘草酸苷治疗),在给予复方甘草酸苷注射液基础上,加用0.6 g还原型谷胱甘肽(昆明积大制药股份有限公司,国药准字H20030427)加入250 mL葡萄糖注射液,静脉滴注,1次/d。两组治疗周期为15 d。
1.3 观察指标 治疗前后的肝功能指标[丙氨酸转氨酶(ALT)、门冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(GGT)、总胆红素(TBIL)和直接胆红素(DBIL)]及疗效。
疗效评价[6]:显效,临床症状完全消失,肝功能指标恢复正常值;有效,临床症状有明显的改善,肝功能指标与治疗前相比降幅大于50%;无效,临床症状有轻微改善或者没有改善,肝功能指标与治疗前相比降幅小于50%或者肝功能指标与治疗前相比有所升高。总有效率=(显效+有效)例数/患者总数×100%。
1.4 统计学分析 将研究数据采用统计学软件SPSS 20.0进行分析,计量数据用(±s)表示,采用t检验。计数数据用[n(%)]表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后的肝功能指标比较 两组治疗后各项肝功能指标均低于本组治疗前,观察组治疗后的指标低于对照组,差异有统计学意义(P<0.05,表1)。
2.2 两组患者疗效比较 观察组的总有效率明显高于对照组,差异有统计学意义(P<0.05,表2)。
表1 两组患者治疗前后的肝功能指标比较(±s)
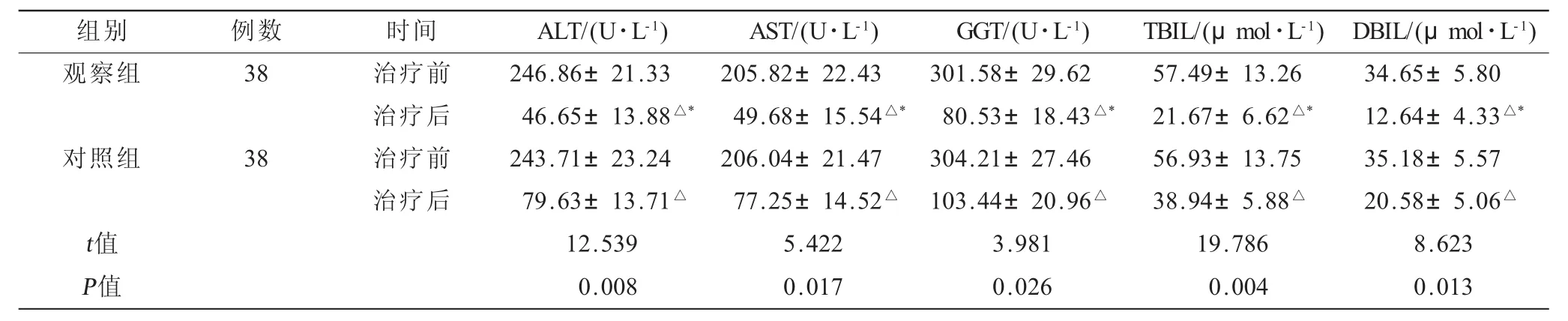
表1 两组患者治疗前后的肝功能指标比较(±s)
注:与本组治疗前比较,△P<0.05;与对照组治疗后比较,*P<0.05。
组别 例数 时间 A L T/(U·L-1) A S T/(U·L-1) G G T/(U·L-1) T B I L/(μ m o l·L-1) D B I L/(μ m o l·L-1)观察组 3 8 治疗前 2 4 6.8 6±2 1.3 3 2 0 5.8 2±2 2.4 3 3 0 1.5 8±2 9.6 2 5 7.4 9±1 3.2 6 3 4.6 5±5.8 0治疗后 4 6.6 5±1 3.8 8△* 4 9.6 8±1 5.5 4△* 8 0.5 3±1 8.4 3△* 2 1.6 7±6.6 2△* 1 2.6 4±4.3 3△*对照组 3 8 治疗前 2 4 3.7 1±2 3.2 4 2 0 6.0 4±2 1.4 7 3 0 4.2 1±2 7.4 6 5 6.9 3±1 3.7 5 3 5.1 8±5.5 7治疗后 7 9.6 3±1 3.7 1△ 7 7.2 5±1 4.5 2△ 1 0 3.4 4±2 0.9 6△ 3 8.9 4±5.8 8△ 2 0.5 8±5.0 6△t值 1 2.5 3 9 5.4 2 2 3.9 8 1 1 9.7 8 6 8.6 2 3 P值 0.0 0 8 0.0 1 7 0.0 2 6 0.0 0 4 0.0 1 3
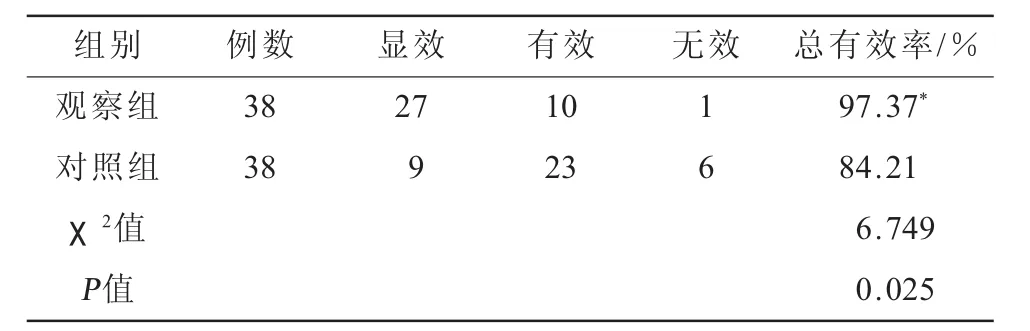
表2 两组患者疗效比较
3 讨论
DILI患者的临床症状为:高热、皮疹、畏寒、淋巴结肿痛、乏力或腹胀等,病情进一步发展则会发生急性肝坏死,有出血的倾向、出现腹水和肝昏迷,严重者导致死亡[7]。还原型谷胱甘肽包含有甘氨酸(Gly)、半胱氨酸(Cys)、谷氨酸(Glu)及巯基,其在人体的各类细胞中广泛存在,特别是在肝细胞中含量最高,起到保护肝脏的作用,其中的巯基可以起到解毒、保护肝细胞膜、保障肝细胞代谢正常、清除自由基及代谢胆汁等作用,正是巯基的清除自由基功能,增强了肝细胞膜结构的稳定性,从而使肝细胞膜得到保护[8]。复方甘草酸苷的主要成分为甘草酸,另外添加Gly、Cys,该药物的主要作用是保护肝细胞膜,甘草酸的抗炎功效,使细胞膜结构处于稳定状态,并且甘草酸在肝脏内还能够亲和类固醇代谢酶,抑制醛固酮及可的松的灭活,阻止肝脏对类固醇的代谢,发挥类固醇样作用,达到抗过敏和消炎的目的,甘草酸还能够促进T细胞的活化,起到免疫调节的作用[9-10]。本研究采用还原性谷胱甘肽联合复方甘草酸苷治疗,观察组治疗后各项肝功能指标明显得到改善,治疗总有效率也明显升高(P<0.05),这说明,将这两种药物联合使用,在缓解肝脏中毒症状的同时又避免了肝脏发生变态反应,最终起到治疗DILI的作用。
总之,还原型谷胱甘肽联合复方甘草酸苷治疗DILI能够达到保护肝细胞、恢复肝功能、提升治疗有效率的目的,具有广泛应用价值。
[1]Chalasani N,Bonkovsky HL,Fontana R,et al.Features and Outcomes of 899 Patients With Drug-Induced Liver Injury:The DILIN Prospective Study[J].Gastroenterology,2015,148(7):1340.
[2]赵晗,丁利平,吕雄文,等.腺苷受体及其介导的cAMP-PKA信号通路在对乙酰氨基酚致药物性肝损伤中的作用[J].安徽医科大学学报,2015(5):616-621.
[3]周军,朱灵,曹海军,等.药物性肝损伤与免疫性肝损伤肝组织中lncRNA表达谱的差异分析[J].中国病理生理杂志,2015(2):313-318.
[4]范作鹏,梁珊,聂巍,等.基于细胞计数试剂盒8的药物淋巴细胞刺激试验在急性药物性肝损伤诊断中的应用[J].临床肝胆病杂志,2016,32(8):1562-1565.
[5]胡琴,吴凡,刘维,等.保肝药物治疗药物性肝损伤系统评价的再评价[J].中国药房,2016(9):1214-1218.
[6]施慧,魏娟,王震凯,等.住院患者药物性肝损伤病因分析及熊去氧胆酸协同治疗疗效观察[J].实用肝脏病杂志,2015(1):34-37.
[7]赵兰兰,张玉.药物性肝损伤的风险评估及诊治进展[J].国际消化病杂志,2015,35(2):119-121.
[8]夏凡,包其,谭艳红,等.还原型谷胱甘肽对大剂量甲氨蝶呤相关肝损伤的预防作用分析[J].药物不良反应杂志,2016,18(5):337-341.
[9]王英夫,曹荣.复方甘草酸苷治疗系统性红斑狼疮合并肝损害的疗效评价[J].中西医结合肝病杂志,2015,25(5):306-308.
[10]王建云.中西医结合疗法预防抗结核药所致肝损伤疗效观察[J].西部中医药,2017,30(4):94-96.

