PFOS致大鼠肝毒性及其作用机制研究
张宵月,肖静,徐苗苗,彭美娟,朱晓凡,高尚,张桃娜
南通大学公共卫生学院 职业卫生与环境毒理学教研室,南通 226019
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)是全氟化合物的代表性化合物,具有良好的热及化学稳定性,自面世以来,被广泛应用于生产生活的诸多方面,如纺织、涂料、皮革、包装等[1-2]。但同时以上稳定的性质也使PFOS进入环境后难以降解,并且能随环境介质的变化产生迁移和蓄积[3]。人或其他生物体则可通过呼吸、饮食等因素间接或直接接触到PFOS,研究发现PFOS在生物体中能长期停留,并发挥毒性效应[4]。目前已发现PFOS具有神经、生殖发育、免疫等多重器官毒性,其中又以肝脏毒性最为常见[2,5-6]。作为主要的蓄积和效应器官,PFOS可引起肝细胞空泡出现,诱发肝肿大和肝细胞凋亡,同时导致肝糖脂代谢紊乱。有研究者提出这种干扰效果与PFOS对组成型雄甾烷受体(constitutive androstane receptor, CAR)、孕烷X受体(pregnane X receptor, PXR)及肝X受体(liver X receptor, LXR)等核受体的过度激活有关[7-8]。但也有实验证实,部分基因敲除动物和转染细胞中以上PFOS的诱导损害作用并未消失,进一步研究也表明PFOS对以上核受体的活化作用在不同种属动物及脏器间具有差异,因此有研究提出PFOS可能存在其他的调控方式[9-10]。
氧化应激已被证实与化学性肝损伤、病毒性肝炎、肝纤维化及肝癌等多种肝脏病变有关。近年来,有研究表明PFOS可以通过氧化应激影响肝的脂肪代谢[11],有学者认为这可能是由于PFOS激活了细胞的抗氧化机制,从而激活了调控脂肪生成的相关基因,最终导致肝脂肪累积[12],但是具体的机制还不确定。核转录因子E2相关因子2(Nuclear factor E 2 related factor 2, Nrf2)作为细胞内一个重要的抗氧化信号分子,在保护细胞组织,对抗氧化损伤中有重要的作用。目前研究发现Nrf2在调节脂肪代谢过程中也扮演着重要的作用。Kitteringham等[13]研究发现Nrf2敲除的成年小鼠肝脏内的脂质含量相对于野生型小鼠会有所降低。最近,也有研究报道了PFOS与Nrf2的关系。Shi等[14]在研究中发现,斑马鱼胚胎可以通过激活Nrf2来对抗PFOS引起的氧化应激。Xu等[15]发现PFOS可以通过Nrf2信号通路促进脂肪前体细胞的增殖分化。鉴于以上原因,我们拟通过动物实验考察PFOS对大鼠肝脏毒效应表现及对氧化应激相关分子的影响,借此探讨PFOS肝毒性反应的潜在机制与可能途径,为PFOS生态毒理学研究提供基础数据。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
试剂:全氟辛烷磺酸(Assay LC-MS 98%,Sigma-Aldrich公司,美国);RT-PCR试剂及引物(TaKaRa大连宝生物公司,中国);丙氨酸转氨酶试剂盒、谷草转氨酶试剂盒、碱性磷酸酶试剂盒(Applied Biosystems公司,美国);丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(碧云天生物研究所,中国);甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC) (南京建成生物工程研究所);二喹呆甲酸(BCA)蛋白定量试剂盒(北京博迈德科技发展有限公司);其他试剂均为国产分析纯。
仪器:5332型PCR仪(Eppendorf公司,德国)、MODEL550酶标仪(Bio-Rad公司,美国)、RM2126切片机(Leica公司,德国)、CK40显微镜(Olympus公司,日本)、CFI60数码相机(Nikon,日本)。
1.2 试验动物及染毒
考虑到文献报道中PFOS对雄性大鼠具有较为明显的毒性效应[17],本次实验选用成年SD雄性大鼠30只,体重220~250 g,上海西普尔必凯实验动物有限公司提供(SCXK沪2008-0016),实验室驯养1周后随机分为0 mg·kg-1PFOS(对照组)、5 mg·kg-1PFOS(低剂量组)和10 mg·kg-1PFOS(高剂量组) (n=10),灌胃染毒28 d。期间每周称重并于实验结束颈椎脱臼处死动物,采集血清及肝脏样本进行相关指标检测。动物饲养室温18~23 ℃,相对湿度45%~55%。实验期间自由饮水摄食。
1.3 指标检测1.3.1 脏器系数
大鼠处死前称重,处死后用预冷生理盐水漂洗肝脏,滤纸吸干称取肝重计算脏器系数:脏器系数(%)=脏器重量(g)/大鼠体重(g)×100%。
1.3.2 肝脏病理观察
暴露结束后处死大鼠并取肝脏组织,制作冰冻切片进行油红染色,同时取肝组织用10%中性福尔马林溶液固定,常规脱水后石蜡包埋制备4 μm切片,HE染色后显微镜观察其病理学变化。
1.3.3 肝功能指标测定
大鼠下腔静脉取血后室温3 000 r·min-1离心分离血清,ELISA试剂盒检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)水平。
1.3.4 脂代谢和氧化还原水平的测定
处死大鼠后立即分离肝脏,精确称取100 mg肝组织,加入无水乙醇1 mL,制成10%匀浆。BCA蛋白定量试剂盒测定上清液蛋白浓度,化学比色法测定肝匀浆甘油三酯(TG)、总胆固醇(TC)水平,硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量,黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)含量,谷胱甘肽氧化酶活力的测定方法(DTNB直接法)测定谷胱甘肽过氧化物酶(GSH-Px)含量。
1.3.5 基因表达水平检测
大鼠处死后迅速剖腹摘取肝脏,称取100 mg肝组织,Trizol抽提总RNA,紫外分光光度计测定OD260/OD280比值以检验纯度,两步法进行反转录和实时PCR。反应体系为10 μg·μL-1cDNA模板2 μL、10 μmol·L-1引物各0.4 μL、2×SYBR 10 μL、ddH2O补充总体积为20 μL。反应条件为95 ℃、5 s,退火温度65 ℃、30 s,72 ℃ 、30 s,反应40个循环计算相对表达量。基因引物设计如表1所示。
1.4 统计学分析

表1 基因引物设计Table 1 Primer sequences of different gene detected by PCR

表2 全氟辛烷磺酸(PFOS)暴露对大鼠体重的影响Table 2 Effect of perfluorooctane sulfonate (PFOS) exposure on body weight of male rats n=10)
注:*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1组相比P<0.05。
Note: * indicatesP<0.05 compared with 0 mg·kg-1group;#indicatesP<0.05 compared with 5 mg·kg-1group.
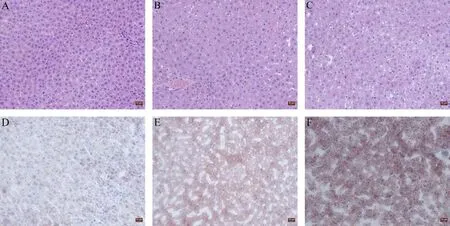
图1 PFOS对大鼠肝脏组织病理的影响注:A~C为HE染色;D~F为油红染色。A和D为0 mg·kg-1;B和E为5 mg·kg-1;C和F为10 mg·kg-1。标尺=10 μm。Fig. 1 Effect of PFOS on liver tissue morphology of male ratsNote: A-C, HE staining; D-F, Oil red staining; A and D, 0 mg·kg-1; B and E, 5 mg·kg-1; C and F, 10 mg·kg-1. Bar=10 μm.

表3 PFOS暴露对大鼠肝重和脏器系数的影响Table 3 Effect of PFOS exposure on liver weight and organ index of male rats n=10)
注:*表示与0 mg·kg-1组相比P<0.05。
Note: * indicatesP<0.05 compared with 0 mg·kg-1group.
表4 PFOS暴露对大鼠血清肝代谢酶的影响Table 4 Effect of PFOS on liver metabolic enzyme activity in serum of male rats n=6)
注:AST、ALT和ALP分别表示血清中谷丙转氨酶、谷草转氨酶和碱性磷酸酶水平。*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1组相比P<0.05。
Note: AST stands for serum aspartate transaminase; ALT stands for serum alanine aminotransferase; ALP stands for serum alkaline phosphatase. * indicatesP<0.05 compared with 0 mg·kg-1group;#indicatesP<0.05 compared with 5 mg·kg-1group.
2 结果(Results)
2.1 PFOS暴露对大鼠一般状况的影响
染毒初期,大鼠活动在三组间无明显异常,但随染毒时间延长,PFOS组大鼠出现不同程度活动减缓、消瘦和毛发暗淡竖直,2周后个别大鼠出现腹泻、脱毛和易怒现象,尤以10 mg·kg-1组大鼠更为典型。
如表2、3所示,实验第2周时,5 mg·kg-1暴露组大鼠体重与0 mg·kg-1组相比即出现降低,但差异并不显著(P>0.05)。从第18天开始,10 mg·kg-1暴露组大鼠体重显著降低,并呈现剂量反应关系(P<0.05)。肝脏系数在整个试验期间,差异显著(P<0.05)。
2.2 PFOS暴露对大鼠肝组织形态学的影响
如图1所示,大鼠大体解剖可见0 mg·kg-1组大鼠肝脏色泽正常,表面光滑无结节,质地柔软,HE染色显示肝索排列规整,细胞核分布正常,胞质均匀。油红染色少见脂滴沉着。但PFOS暴露组大鼠肝脏质地较脆,颜色暗沉,边缘钝化且肝表面分布大小不同的黄色斑点。HE染色和油红染色结果显示PFOS组肝细胞出现不同程度肿胀和核的偏移,镜下可见细胞空泡和大小不等的脂滴出现,细胞内可见红色深染脂肪滴,10 mg·kg-1组改变最明显。
2.3 PFOS暴露对大鼠血清中肝脏代谢酶水平影响
如表4所示,PFOS暴露造成ALT、AST、ALP水平显著上升(P<0.05),其中ALT和ALP水平均随暴露浓度增高显著上升(P<0.05),AST水平在PFOS各暴露组中均显著高于0 mg·kg-1组(P<0.05),但不同剂量组间差异并不显著(P>0.05)。
2.4 PFOS暴露对大鼠匀浆氧化还原能力和脂代谢水平的影响
如表5所示,对各组大鼠肝细胞匀浆中氧化还原酶水平的检测发现,5 mg·kg-1PFOS暴露组大鼠肝脏SOD活性相比对照组显著增高,但随着染毒剂量的增高又出现了显著降低(P<0.05)。与SOD改变不同的是,GSH-Px活性虽然随着PFOS剂量的增加而出现上升,但仅在10 mg·kg-1有显著差异,MDA水平改变与GSH-Px趋势类似,在暴露组中随PFOS浓度增加MDA水平也随之显著升高(P<0.05)。另外对肝脏匀浆中脂肪水平的检测发现,与0 mg·kg-1组相比,10 mg·kg-1组无论是TC还是TG水平都出现了显著增高(P<0.05),同样的情况也出现在5 mg·kg-1组,但差异并不显著(P>0.05)。
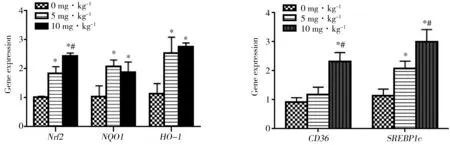
图2 PFOS暴露对基因表达水平影响注:*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1组相比P<0.05。Fig. 2 Effect of PFOS on expression of related gene n=6)Note: * indicates P<0.05 compared with 0 mg·kg-1 group; # indicates P<0.05 compared with 5 mg·kg-1 group.
2.5 PFOS暴露对大鼠肝脏相关基因表达影响
如图2所示,对肝脏中氧化应激相关的调控相关因子Nrf2表达水平进行检测发现,PFOS暴露后大鼠肝脏Nrf2水平与0 mg·kg-1组相比分别上调了约1.8和2.4倍,且随着暴露剂量增加差异更为显著,同时Nrf2信号相关基因醌氧化还原酶抗体(Quinone oxidoreductase 1, NQO 1)和血红素氧合酶1(Hemeoxygenase 1, HO-1)的表达也在暴露后上调2倍左右,但不同剂量组未见显著差异。同时,脂代谢调控基因脂肪酸转移酶(Cluster of differentiation 36, CD36)和SREBP1c的表达也在10 mg·kg-1出现了显著增高,尤其SREBP1c受PFOS影响更为显著,表现出明显的剂量反应关系。
3 讨论(Discussion)
PFOS作为全氟化合物(perfluorocarbons, PFCs)的代表化合物,对生殖发育、免疫神经等多器官间接或直接的损伤近年来备受关注,尤其肝脏作为PFOS的蓄积器官,关于PFOS所诱导的肝脏损伤常有报道,但具体机制尚未完全清楚。本实验中发现PFOS暴露后大鼠AST等肝功能酶发生显著改变,提示肝细胞膜结构和功能的损伤,HE和油红染色病理结果也显示PFOS暴露组具有明显的肝脏形态异常,这和其他啮齿类及鱼类等动物模型中得到的结论一致[16-18]。同时我们还发现,肝脏中TC和TG的水平出现了显著的增高,在高剂量组中较为显著,这和Cui等[16]研究结果一致,以上现象可能与PFOS对脂肪代谢途径中调控因子的影响有关。
表5 PFOS暴露对大鼠肝组织中氧化还原酶和脂代谢的影响Table 5 Effect of PFOS on oxidoreductase and lipid metabolism in rat liver tissue n=6)
注:*表示与0 mg·kg-1组相比P<0.05,#表示与5 mg·kg-1组相比P<0.05。SOD、GSH-Px、MDA、TC、TG表示超氧化物歧化酶、谷胱甘肽过氧化物酶、丙二醛、总胆固醇、甘油三酯。
Note: SOD, GSH-Px, MDA, TC and TG stand for superoxide dismutase, glutathione peroxidase, malondialdehyde, total cholesterol and triglyceride. * indicatesP<0.05 compared with 0 mg·g-1group; # indicatesP<0.05 compared with 5 mg·kg-1group.
本次实验中发现PFOS暴露能显著上调SREBP1cmRNA表达。这与Lv等[17]在宫内暴露子鼠肝脏中发现的结果一致。SREBP是位于内质网质膜上一种膜连接蛋白,具有3种亚型,其中SREBP 1c证明在脂肪合成调节中发挥重要作用,能影响下游乙酰辅酶A羧化酶1(Acetyl-CoA carboxylase1, ACC1)、脂肪酸合成酶(Fatty acid synthetase, FAS)、硬脂酰辅酶A去饱和酶1(Stearyl-CoA desaturase 1, SCD1)等重要脂代谢酶的表达,改变细胞炎症趋化因子配体2(Inflammatory chemokine 2, CCL2)和成纤维细胞生长因子21(Fibrolast growth factor-21, FGF21)水平,诱导肉毒碱棕榈酰基转移酶(Carnitine palmitoyltransferase 1 A, CPT1A)的表达改变,并能通过与胆固醇调节元件结合蛋白裂解激活蛋白(Sterol regulatory element binding proteins cleavage-activating protein, SCAP)的作用调控低密度脂蛋白受体(Low-density lipoprotein receptor, LDLR)及载脂蛋白E(Apolipoprotein E, ApoE)等脂转运相关基因的表达,打破脂蛋白受体(Lipoprotein receptor)和HMGCoA还原酶(HMG-CoA reductase)的反馈平衡[19-23]。这可能是造成PFOS组动物肝中TG和TC指标上升的原因之一。同时实验中也发现PFOS组抗氧化指标和机体抗氧化基因Nrf2的改变,也可能与这种脂代谢紊乱后机体被迫加速脂肪β氧化后产生大量活性氧(reactive oxygen species, ROS)有关。
Nrf2是抗氧化酶表达过程中的关键调控因子,对平衡体内氧化-抗氧化系统,抵抗ROS导致的损害起到关键作用。当出现氧化应激、亲电子物质或者化学物质刺激时,Nrf2可借助胞质接头蛋白(Kelch like ECH associated protein 1, Keapl)的构象改变来完成活化转核,与细胞核内小Maf蛋白结合形成二聚体,借此启动由抗氧化作用元件(Antioxidant response element, ARE)介导的HO1和NQO1等抗氧化反应,参与氧化应激状态下的细胞保护及修复过程[24]。有研究表明,Nrf2的表达可以引起肝脏脂质积聚[25]。More等[26]在长期高脂饮食诱导的肥胖小鼠模型中发现,Keap1敲除小鼠的肝脏中出现较野生型小鼠更加严重的脂质沉积。Pi等[27]在啮齿类动物实验中发现Nrf2可以转录调节过氧化物酶体增殖物激活受体γ(PPAR-γ)和CCAAT/增强子结合蛋白(CEBP)以增强脂肪前体细胞分化,从而导致脂质的合成增加。最近也有研究发现,在双酚A(BPA)暴露的小鼠肝脏中,Nrf2和SREBP1c共同参与了肝脏脂质的沉积,同时在Nrf2转染和萝卜硫素(Nrf2激动剂)处理肝细胞中发现,SREBP1c的表达会显著增加[28]。以往研究中发现PFOS能够诱导细胞氧化应激出现,同时上调Nrf2及下游基因的表达。因此,我们推测PFOS导致的大鼠肝脏脂质沉积可能与Nrf2的激活有关。
同时也有研究表明,Nrf2入核后通过与下游反应原件的结合,能够以不依赖过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor, PPAR)的方式上调CD36表达[29]。本次结果中也发现PFOS暴露组CD36受到显著影响。CD36属于B类清道夫受体家族,能识别包括氧化低密度脂蛋白(Low density lipoprotein, LDL)、长链脂肪酸(Long chain fatty acid, LCFA)、非修饰脂蛋白和淀粉样蛋白等在内的内源性配体,可由ROS激活其3个外显子的转录活性,参与由代谢过剩所触发的多器官慢性低丰度性炎症反应[30]。CD36可通过过氧化物酶MPO-H2O2-NO2系统,与Toll样受体(Toll-like receptor, TLR)TLR4和TLR6结合成异三聚体,进入细胞膜和脂阀后募集形成CD36/Lyn/TLRs多聚体,影响脂质的摄取和转运[31]。小鼠实验发现CD36表达改变能影响心肌、骨骼肌、脂肪等多个组织部位的脂肪储留,而不同药物或RNA干扰动物中上调或降低肝脏CD36表达可造成实验动物出现脂毒性及脂肪转运能力的改变[32]。同时CD36能调控前炎症相关信号通路如核转录因子-κB(Nuclear factor kappa B, NF-κB)、核转录抑制因子(Inhibitory factor kappa B, iκB)和细胞外调节蛋白激酶1/2(Extracellular regulated protein kinases 1/2, ERK1/2)的活化,调节粘附分子、趋化因子、炎症因子、一氧化氮合成酶(NOS)等分子表达改变,激活肝星状细胞诱发自身免疫,导致线粒体解偶联蛋白(Uncoupling protein, UCP)及脂肪酸合成酶Fas配体诱导活化,形成“二次打击”使肝脏损害呈现恶性循环[33]。
综上所述,PFOS具有明显的肝毒性作用,可导致肝脏形态异常并影响肝脂代谢水平,这可能与PFOS引起的氧化应激所导致的损伤有关。

