离子液体的水生生态毒理及其毒性影响因素研究进展
夏一璐,范慧阳,刘惠君
浙江工商大学环境科学与工程学院,杭州 310018
离子液体(ionic liquids, ILs)是指在室温或接近室温下呈现液态的、完全由阴阳离子所组成的盐,也称为室温熔融盐或低温熔融盐。它被认为替代传统挥发性有机溶剂的新型绿色溶剂[1-2],具有极低的蒸汽压、不易燃、导电性强、性质稳定、对许多无机盐和有机物有良好溶解性等诸多优点,在分离过程、有机合成、生物催化、电化学、生物质溶解和转化等领域具有广阔的应用前景。在ILs广泛应用的同时,它的化学和热力学稳定性导致其在环境难以降解,具有潜在环境风险。虽然ILs不易挥发可有效减少大气污染,但由于其较好的水溶性,在实际使用中大量ILs被释放入水环境中[2],其在水中的积累和污染对水环境存在潜在危害。
近年来ILs的环境行为以及生态毒性受到了研究者的广泛关注。有关ILs对水藻、大型溞(Daphniamagna)及斑马鱼(Daniorerio)等水生生物的影响相继已有研究报导[6-7],研究发现ILs的潜在毒性可能与常用的有机溶剂相当或者更高[8],多种ILs对不同营养级水生生物的毒性影响详见表1与表2。ILs的毒性与其自身的结构有关,包括烷基链长度、阳离子类型与阴离子类型,此外,环境因子也是ILs的毒性影响因素[9]。本文从多角度综述了不同类型ILs对水生生物的毒性作用及其毒性影响因子(图1),为环境友好型ILs结构设计和合理控制水环境中的ILs污染提供参考。
1 离子液体的水生生态毒理研究(Aquatic ecotoxicology of ILs)
1.1 离子液体对水生植物的毒性影响
水生植物研究对象主要包括藻类与浮萍,探讨ILs对其生长、叶绿素含量、抗氧化系统、酶活性、细胞超微结构等的毒性效应。1-辛基-3-甲基咪唑六氟磷酸盐([C8mim]PF6)对小球藻(Chlorellavulgaris)生长和叶绿素a的抑制作用随浓度增加而增大,高浓度可致死[10]。1-丁基-3-甲基咪唑氯盐([C4mim]Cl)会导致斜生栅藻(Scenedesmusobliquus)叶绿素含量下降,过氧化氢酶(CAT)和超氧化物歧化酶(SOD)活性降低,藻细胞通透性增大且超微结构受到破坏[11]。[Cnmim]Cl(n=6、8、10、12、16)对斜生栅藻的毒性随ILs浓度的增加和烷基链的增长而增大[12]。手性1-烷基-3-甲基咪唑酒石酸盐(RMIMT)对斜生栅藻有立体选择性,L构型的毒性比D构型强[13]。Chen等[14]提出手性ILs的立体选择性影响可能是由于活性氧自由基(ROS)和藻细胞膜通透性损伤差异所致。研究表明随着1-辛基-3-甲基咪唑溴盐([C8mim]Br)浓度增加,三角褐指藻(Phaeodactylumtricornutum)的生长受到抑制,SOD活性先微小增加而后被抑制,细胞脂质过氧化产物丙二醛(MDA)含量增加,这可能是由于ROS过量造成的[15]。[C8mim]Br对浮萍(Lemnaminor)也有相似的抑制作用[16],有较长烷基链的1-烷基-3-甲基咪唑化合物对浮萍有更强的毒性[17]。Jin等[18]建立了3D定量构效关系模型,通过标准藻类生长抑制实验证实2,3-二硝基酚、2-氯代-4硝基、1,2,3,-三甲基苯和3-溴苯酚这4个取代基的ILs对斜生栅藻有高毒性。
图1 离子液体(ILs)在水中的生态毒性及其影响因子Fig. 1 Aquatic ecotoxicity of ionic liquids (ILs) and factors affecting the toxicity
[C4mim]Cl抑制四尾栅藻(Scenedesmusquaclricauda)酶活性,而对其ROS和细胞膜损伤影响不大[19]。在1-烷基-3-甲基咪唑溴盐([Cnmim]Br, n=4,6,8)对四尾栅藻和莱茵衣藻的研究中显示ILs毒性比丙酮、苯、甲苯和苯酚更大[20]。海绿藻(Ocystissubmarina)和硅藻(Cyclotellameneghiniana)在暴露ILs后恢复能力有显著不同,硅藻比绿藻对ILs更为敏感[21]。在一定的浓度范围内(8~32 PSU),ILs的毒性效应随盐度升高而下降[22]。Pham等[23]对羊角月牙藻(Pseudokirchneriellasubcapitata)的研究显示ILs在生长率上的毒性影响要比光合作用性能上的影响更明显。ILs对羊角月牙藻的毒性强弱和烷基链长、暴露时间以及化学结构明显相关,且毒性比传统有机溶剂要强2~4个数量级[24]。此外,配制时间久的1-丁基-3-甲基咪唑四氟硼酸盐([C4mim]BF4)溶液的半数效应浓度(EC50)值明显低于新配制溶液,可能是溶液中[C4mim]BF4形成了氟化物[25],这意味着ILs进入水环境中产生的毒性影响可能比在实验室中预期的更大。
1.2 离子液体对水生动物的毒性影响1.2.1 离子液体对水生无脊椎动物的影响
Pham等[6]综述了多种ILs对大型溞的毒性试验结果,可得毒性最强的是1-丁基-3-辛基咪唑溴化物(IM18Br),毒性最低的混合物为[C4mim]Cl。咪唑ILs对大型溞有很强毒性,毒性受阳离子侧链长度影响,当侧链长度碳原子数从4增加到12个会导致48 h半数致死浓度(LC50-48 h)降低470倍[26]。侧链氧化会降低ILs对大型溞的毒性[27-28]。随着IM18Br浓度上升,大型溞的3个世代和平均后代数目减少,说明IM18Br可以对大型溞种群造成有毒影响并间接对淡水食物网造成破坏[29]。不同碳链长度[Cnmim]Br都严重影响大型溞的摄食行为,对水生生态产生潜在威胁[30]。Costa等[31]研究发现水螅对ILs的耐性比大型溞和月牙藻强。
3种ILs [Cnmim]Cl(n=4、8、12)暴露对卤虫(Brine Shrimp)个体存活率影响的研究可发现毒性效应随烃基侧链碳链增长而增强[32],这和不同烃链长度ILs对日本三角涡虫(LugesiajaponicaIchikawa et kawakatsu)的毒性影响结果基本一致[33]。Nędzi等[34]发现与只暴露于受[C4mim]Cl污染水中的藤壶(Balanus)相比,当水中有受污染的小球藻时,藤壶的生物浓缩系数会升高80%,而在高浓度的ILs中,油黑壳菜蛤(Mytilustrossulus)的解毒作用比藤壶更有效,可能由于其矿物质表面有特有的物理吸附机制。短期暴露于[Cnmim]Br和[Cn]3MePyBr(1-烷基-3-甲基吡啶溴盐)会减少斑马贻贝(Dreissenapolymorpha)的摄食率[35],[C4mim]Br抑制尖膀胱螺(Physaacuta)的生长速率[36]。ILs在低浓度时可能抑制尖膀胱螺行动,但是一旦浓度高于临界值就会触发其逃跑反应[37]。尖膀胱螺既捕食藻类,也为鱼类和其他脊椎捕食者所摄食,是淡水食物网的重要组成部分。ILs不仅影响尖膀胱螺的行为,也影响了个体健康和水生食物网内部作用。
1.2.2 离子液体对水生脊椎动物的影响
研究表明ILs会对斑马鱼活动产生影响,由于其体积大,耐毒能力变强,所以一些ILs对其属于低毒性[38],抑制率随时间延长而增强[10]。[C8mim]Cl和1-辛基-3-甲基咪唑四氟硼酸盐([C8mim]BF4)处理斑马鱼肝脏,毒性效应随浓度和时间增加而增强,而阴离子对ILs的毒性几乎不产生影响[39]。Pretti等[40]揭示了ILs化学结构不同对鱼类造成不同的影响,斑马鱼活动减弱,丧失平衡性,最后甚至死亡,其主要损伤部位是皮肤和腮。[C8mim]PF6会抑制斑马鱼抗氧化酶活性,造成体内ROS的积累以及脱氧核糖核酸(DNA)损伤[41]。ROS含量与ILs浓度呈良好的剂量-效应关系,较高浓度的ILs会抑制抗氧化酶活性,刺激解毒酶活性以及造成细胞DNA损伤[42]。
[C8mim]Cl对泥鳅(Misgurnusanguillicaudatus)胚胎发育4个阶段(囊胚期、原肠胚中期、神经胚期、尾芽期)及仔鱼期的毒性具有明显的剂量-效应关系。在一定剂量内,[C8mim]Cl对泥鳅胚胎及仔鱼的发育具有明显的致畸、致死作用[43]。结果与IM18Br对黑斑蛙(Pelophylaxnigromaculatus)早期胚胎时期的毒性影响结果一致[44]。[C16mim]Cl处理红细胞微核率、血清谷丙转氨酶(GPT)和谷草转氨酶(GOT)活力均明显高于对照组,对泥鳅具有遗传和生理毒性效应[45]。[C8mim]Br会诱发金鱼(Carassiusauratus)皮肤、腮丝以及小肠绒毛的表面损伤[46],产生氧化损伤并引起脂质过氧化作用[47]。[C8mim]Br对鲤鱼的免疫系统也有毒性效应,早期暴露于浓度为363 μmol·L-1的ILs时,鲤鱼的免疫系统被激活,而暴露于1 090 μmol·L-1的ILs时,会对肝胰脏、肾脏和脾脏造成明显的损伤,抑制其免疫系统[48]。马军国等[49]推断草鱼体内PXR(细胞色素CYP3A的关键转录因子)可能是[C8mim]Br作用于CYP3A的受体。
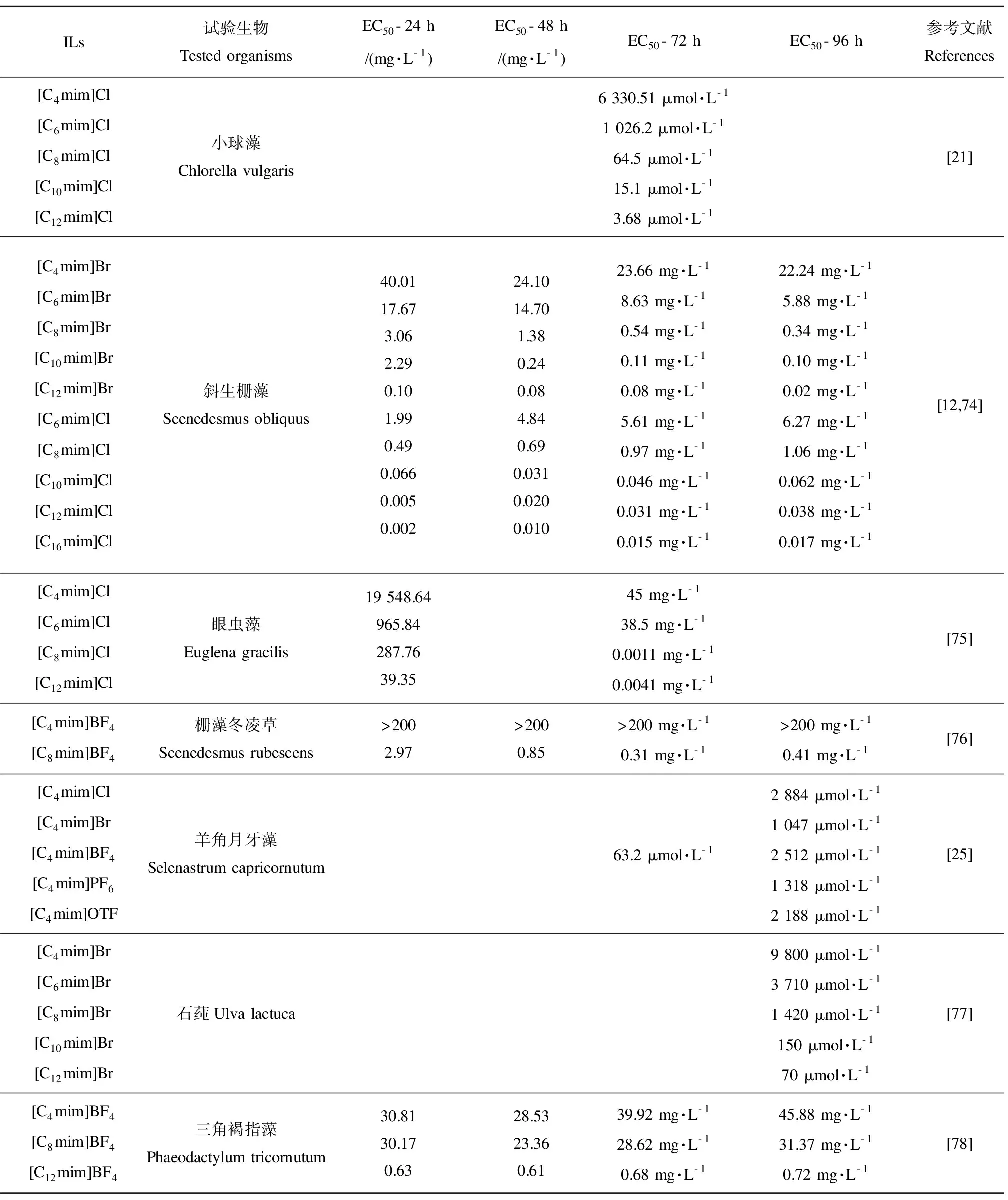
表1 不同ILs对水生藻类的毒性Table 1 The toxicity of different ILs to various aquatic algae
注:[Cnmim]Cl表示1-烷基-3-甲基咪唑氯盐;[Cnmim]Br表示1-烷基-3-甲基咪唑溴盐;[Cnmim]BF4表示1-烷基-3-甲基咪唑四氟硼酸盐;[Cnmim]PF6表示1-烷基-3-甲基咪唑六氟硼酸盐;[Cnmim]OTF表示1-烷基-3-甲基咪唑三氟甲烷磺酸盐。
Note: [Cnmim]Cl stands for 1-alkyl-3-methylimidazolium chloride; [Cnmim]Br stands for 1-alkyl-3-methylimidazolium bromide; [Cnmim]BF4stands for 1-alkyl-3-methylimidazolium tetrafluoroborate; [Cnmim]PF6stands for 1-alkyl-3-methylimidazolium hexafluorophosphate; [Cnmim]OTF stands for 1-alkyl-3-methylimidazolium trifluoromethanesulfonate.
1.3 离子液体对水体微生物的影响
对费氏弧菌(Vibriofischeri)的研究证实了阳离子侧链长度对生物体的影响,侧链长度从[C2mim]Cl的2个碳原子增加到10个碳原子导致其EC50-15 mim降低了6 563倍[50]。Ranke等[51]考察了不同碳链和阴离子的咪唑ILs对费氏弧菌的毒性影响,结果显示化合物与[PF6]-结合比与其他阴离子结合毒性稍强一些,烷基咪唑ILs对费氏弧菌的生物影响比丙酮、乙腈、甲醇和甲基叔丁基醚的影响还大。季铵化合物对费氏弧菌的毒性比吡啶盐和咪唑盐类似物要小[52]。阴离子[(CF3SO2)2N]-本身对费氏弧菌没有固有毒性,而所有被测试的化合物与[(CF3SO2)2N]-结合后毒性增加[53]。与磷盐类、咪唑类不同,胍盐类ILs的毒性不随侧链烷基长度的增加而增强,在烷基侧链上引入含氧基能降低胍盐类和咪唑类ILs的毒性[54]。对恶臭假单胞菌的毒性实验可得,当碳链长度在8以下时,毒性随之增加,而当碳链长度为10时,EC50值却增加了1个数量级。30种具有不同烷基链长度、阴离子基团和阳离子骨架(甲基咪唑、二甲基咪唑和吡啶)的ILs对青海弧菌(Vibrioqinghaiensissp.)的毒性差异很大,毒性取决于烷基链长度,而阴、阳离子骨架对毒性效应无显著影响[55]。
2 离子液体毒性的影响因素(Factors affecting the toxicity of ILs)
2.1 离子液体结构对毒性的影响2.1.1 阳离子的烷基链长度
一般来说,链长的增加增强了ILs的毒性效应[56]。ILs的毒性和其亲脂性有关。亲脂性越强,ILs越易与受试生物表面发生相互作用,则毒性越强。Stock等[57]提出1-癸基-3-甲基咪唑四氟硼酸盐([C10mim]BF4)对乙酰胆碱的抑制作用大于1-丙基-3-甲基咪唑四氟硼酸盐([C3mim]BF4),可能由于长链的阳离子更易与该酶上的阴离子位点结合。

表2 不同ILs对水生动物的毒性Table 2 The toxicity of different ILs to various aquatic animals
注:[Cnmim]NO3表示1-烷基-3-甲基咪唑硝酸盐。
Note: [Cnmim]NO3stands for 1-alkyl-3-methylimidazolium nitrate.
2.1.2 阳离子侧链的功能化程度
在烷基侧链上引进极性功能基团能有效降低毒性[58]。在咪唑烷基链上的1-位上被氢原子取代可以降低毒性[59]。而将甲基基团或羟乙基基团引入咪唑碳链中能增强它的抗菌活性[60]。此外,细胞毒性很大程度上是由极性功能基团在侧链上的位置决定的[53]。
2.1.3 阳离子性质
Bernot等[61]总结出ILs的毒性与阳离子有关。含芳香烃的咪唑和吡啶类ILs比哌啶类似物的总体毒性水平要高[62]。Ismail Hossain等[63]用数学模型对ILs对大型溞的毒性进行研究,定量构效关系(QSAR)表明阳离子组成占ILs的毒性的12%~48%。吡咯类ILs对费氏弧菌的毒性小于咪唑类和吡啶类ILs[64],而咪唑类ILs对其毒性又比季鏻盐类ILs小[65]。
2.1.4 阴离子性质
阴离子对ILs毒性也有一定影响,尤其是较短烷基链的ILs[66]。一般来说,一些氟化物阴离子如四氟硼酸盐[BF4]-、六氟磷酸盐[PF6]-和六氟锑酸盐[SbF6]-通常会增加ILs的毒性。稳定的阴离子如双三氟甲磺酰亚胺盐[NTF2]-毒性很强,由于它的亲脂性增加了破坏细胞膜磷脂的能力[67]。Garcia等[68]以发光细菌(Photobacteriumphosphoreum)为受试对象,发现[C4mim]Br与[C4mim]Cl对其的毒性小于[C4mim]BF4与[C4mim]PF6。
2.1.5 阴离子和阳离子的相互影响
分子结构中阴离子和阳离子的相互影响会影响ILs的毒性[69]。环境友好的ILs可由合适的阴离子和阳离子合成[56]。使用芳香族阳离子和含氟阴离子会增加毒性[70-71]。非质子化的ILs对乙酰胆碱酯酶的抑制作用比质子化的ILs更强[2]。因此,质子化的ILs对环境来说更为安全。
2.2 环境因子的影响
水环境中对ILs毒性的影响因子主要是溶解的有机质和盐度。ILs像表面活性剂一样更倾向于吸附矿物和有机质。因此,污染物在地下水中可以被水介质中固定物吸附,降低地下水污染。相反,若ILs聚合在水相中形成胶体,并吸收有机和非有机胶体则会增强地下水污染[73]。盐度增大时,高氯浓度提供了ILs中阳离子的离子对环境,与细胞壁结构中的羟基竞争,减少了ILs通过细胞壁进入细胞,从而降低了ILs对生物的毒性作用[22]。
3 总结与展望(Summary and future research directions)
本文阐述了不同水生生态营养级上的生物,包括水生植物(水藻和浮萍等)、水生动物(水溞、腹足类、斑马鱼和金鱼等)和水体中微生物(费氏弧菌和青海弧菌等)暴露于不同类型不同结构的ILs后,对其生物体、组织器官、细胞、超微结构和酶活性等产生的毒性效应,以及毒性效应的影响因素如烷基链长、阴、阳离子和环境因子等。
基于目前ILs对水生生态毒性的研究,未来研究可在以下4个方面拓展或加强:
(1)ILs对不同生物级的毒性效应已被广泛研究,应进一步关注其毒性机制的解析。
(2)ILs降解过程中的中间产物以及最终产物对水生环境的毒性。
(3)运用化学统计学工具及模型如定量-构效模型、线性自由能模型来预测ILs毒性。
(4)基于毒理学和降解数据资料,创建绿色结构数据库,以此为生产无毒、可降解性的ILs提供关键信息。

