不同干燥方式与粉碎粒度对玛咖活性成分和气味影响的研究
李爱民,夏凯,郝俊冉,温霖,苑鹏,党艳婷,赵可心,李志军,高晓冬*,段盛林*
1(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 2(中国食品发酵工业研究院,北京,100015) 3(北京市八一学校,北京,100080) 4(新时代健康产业(集团)有限公司,北京,102206)
玛咖,学名LepdiummeyeniiWalp,归类于十字花科(Brassicaceae)、独行菜属,是1年生或2年生草本植物,植株高约15~20 cm,原产于海拔3 500~4 500 m的南美安第斯山区。玛咖是独行菜属中唯一有肥厚的下胚轴的物种,地下膨大的贮藏根是主要食用部分,直径 2~5 cm,表面颜色有黄色、白色、紫色和红色等,味道微甜微辣,具有刺激性气味[1]。现代化学研究证明,玛咖广泛的颜色是该种与生俱来的,与质量没有直接联系,但不同颜色的玛咖中生物活性成分含量和种类有所区别[2]。玛咖含有芥子油苷[3](硫代葡萄糖苷)、玛咖烯、玛咖酰胺[4]以及其他生物碱等功能成分,具备抗疲劳、增强生殖能力、神经保护[5]、调节内分泌[6]等生物活性,且营养丰富,安全无副作用[7],在秘鲁当地有5 800多年的食用历史。从20世纪80年代开始,世界卫生组织等国际组织建议各国推广玛咖产业,随后玛咖保健品在美欧、日本等地流行;1992年玛咖被国际植物遗传资源研究所列为珍稀植物;2002年卫生部正式批准玛咖进入中国,2003年玛咖在中国云南丽江试种成功,2011年卫计委批准玛咖粉作为新资源食品,随后玛咖产业在中国进入发展期,2014年玛咖产业值已达100亿元人民币,国际产业值达到100亿美元。
目前玛咖的采后加工依然沿袭着洗净后自然干燥的传统加工工艺,该方法具有操作简单、成本低廉,在玛咖种植地的高海拔条件下易于实施等优点;但也存在干燥周期长,品控难度大,容易受环境影响等不足。近年来国内外学者针对玛咖干燥工艺做了大量研究,对热风干燥[8]、微波干燥[9]、真空干燥[10]和流化床干燥[11]玛咖的影响因素进行了系统探究,利用响应曲面法设计干燥参数,建立了玛咖块干燥的动力学模型。甘瑾等[12]通过分析和评价自然干燥和真空干燥对玛咖中芥子油苷组分和含量的影响,研究了玛咖干燥过程中生物活性成分物质的变化规律。然而对于玛咖加工过程中,干燥和粉碎工艺对其活性成分和气味特征的影响以及物料表面的颗粒特性仍缺少系统性的研究。
本研究针对玛咖采后干燥和粉碎的加工过程,探究玛咖中芥子油苷、玛咖烯和玛咖酰胺等主要活性成分在加工过程中的变化规律,阐明玛咖超微粉颗粒特性和生物活性成分与加工工艺之间的关系。
1 材料与方法
1.1 材料与试剂
玛咖鲜果,新时代健康产业香格里拉玛咖种植基地提供。甲醇、乙腈(色谱纯),美国Fisher Scientific 公司;硫酸酯酶(H-1)、DEAE Sephadex A-25,美国Sigma 公司;苄基芥子油苷,国药集团;玛咖烯和玛咖酰胺标品,武汉华士特工业生物技术开发有限公司;其他常用试剂为国产分析纯。
1.2 仪器与设备
岛津LC-20AT高效液相色谱系统,日本岛津公司;安捷伦1100 LC-MDS-Trap液质联用系统,美国Agilent公司;BJ-500A高速多功能粉碎机,德清拜杰电器有限公司;高能纳米冲击磨,秦皇岛太极环纳米公司;DQ-103台式方形中药切片机,温岭市林大机械有限公司;台式扫描电子显微镜,美国 Phenom公司;Milli-Q 纯水仪,美国Millipore公司;Fox4000电子鼻,自动进样器HS100和SOFTV9.1软件,法国Alpha MOS公司;Mirco S3500激光粒度分析仪,美国麦克奇公司;水分活度仪LabMaster,瑞士Novasina公司。
1.3 实验方法
1.3.1 玛咖干燥实验
取新鲜玛咖去除须根,经中药切片机切成3 mm的薄片,分别进行热风干燥、冷冻干燥、微波干燥、真空干燥和自然干燥5组处理。热风干燥是将切片后的玛咖块根放入热风干燥箱中,42 ℃热风干燥6 h。冷冻干燥是将切片后的玛咖块根预冻至-60 ℃以下,再放入冷冻干燥机中真空冷冻干燥16 h。微波干燥是放入将切片后的玛咖块鲜样用频率2 450 MHz、功率12 W/g样品处理1 min间隔5 min,重复处理直至完成干燥[13]。真空干燥样品是将冷藏的玛咖块根切片,放入温度42 ℃、真空度2×105Pa的真空干燥箱内干燥24 h。自然干燥样品是将切片后的玛咖块根在常温下自然晾晒,直至水分含量低于5%。采用不同干燥方式完成的玛咖分别测定水分含量,并进行粉碎、过筛、密封冷藏保存待用。
水分含量测定按照国家标准(GB 5009.3—2010)进行[14]。
水活度测定按照国家标准(GBT 23490—2009)进行[15]。
1.3.2 玛咖粉碎实验
以普通粉碎的玛咖干粉为原料,经42 ℃热风干燥后测定其水分含量。水分含量低于5%的玛咖干粉即可进一步超微粉碎。将玛咖干粉放高能纳米冲击磨中,不添加任何抗结剂、助磨剂对其进行干法粉碎,经过不同粉碎时间得到4种玛咖超微粉。
1.3.3 玛咖超微粉颗粒特性表征
采用激光粒度分析仪干法检测玛咖超微粉样品,测定条件如下:进样时间12 s,背景时间8 s,测定模式为普通模式,采样信号强度0.5~6,分散进样控制,空气压力2.0×105Pa,进样速度50%。
1.3.4 玛咖超微粉气味感官表征
利用电子鼻感官评价系统分别分析1.3.2中制备的不同粒径的玛咖超微粉末和1.3.1中不同干燥方式的玛咖粉。准确称取1 g检测样品放入10 mL顶空瓶中加盖密封待检样品的检测条件如下:载气为合成干燥空气,流速150 mL/min,顶空产生时间600 s,产生温度40 ℃,搅动速度300 r/min 样品顶空气体注射体积1.5 mL,注射速度1.5 mL/s,注射针总体积5.0 mL,注射针温度50 ℃,最后数据采集时间120 s,延滞时间360 s,数据采集的时间为120 s。通过18个传感器在采集样品的 120 s 内所感应到的综合响应强度值进行分析,选用主成分分析法(principal component analysis, PCA)对电子鼻各传感器分析得到的样品气味响应数据进行相应统计学分析。
1.3.5 玛咖超微粉表面结构[16]
采用飞纳台式扫描电子显微镜能谱联合测定,观察玛咖超微粉表面微观结构。将样品铺平在粘有导电胶的载物台上,氮气轻吹后,置于样品杯上,调节加速电压15 kV,调整至合适放大倍数,观察样品的微观结构。
1.3.6 玛咖活性成分测定
1.3.6.1 芥子油苷含量测定[17]:
前处理:称取200.0 mg玛咖粉末加入15 mL体积分数80%预沸甲醇溶液,84 ℃水浴30 min,然后取出离心管0 ℃冷却保存;3 000 r/min离心10 min;取2 mL上清液缓缓加入已制备好的离子交换微柱中,平衡0.5 h;待液体排干后,加入2 mL 0.02 mol/L醋酸钠溶液分2次洗涤,每次加入后均让液体排干;加入75 μL硫酸酯酶溶液至离子交换微柱,室温条件下反应16 h;用1.5 mL去离子水冲洗离子交换微柱,将收集液体过0.45 μm滤膜待测。
色谱条件:色谱柱:Waters C18柱(5 μm×3.9 mm×150 mm),流动相:乙腈(B)和水(A),流速:1.0 mL/min;柱温30 ℃;紫外检测器检测波长229 nm。 梯度洗脱程序:0~15 min,0%B~19%B;15~25 min,19%B;25~35 min,19%B~100%B;35~45 min,100%B~0%B。
标准曲线:用苄基芥子油苷作标准对照品。称取100 mg苄基芥子油苷溶解于5 mL水中,得到20 mg/mL的苄基芥子油苷标准液,通过倍比稀释获得10、5、1、0.2 mg/mL的标准液,经液相色谱测定,以峰面积为横坐标,以苄基芥子油苷标准液浓度为纵坐标绘制标准曲线。
1.3.6.2 玛咖烯和玛咖酰胺含量测定[18]
前处理:将玛咖粉末与无水乙醚按照1∶5(g∶mL)比例混合,进行超声萃取30 min,过滤取滤液1 mL,旋转蒸发干燥,加入1 mL甲醇溶解,过 0.45 μm滤膜,然后将样品稀释后进行液相色谱分析。
色谱条件:TC-C18色谱柱(5 μm×4.6 mm×250 mm),流动相:乙腈(B)和水(A);流动相为 90%乙腈,流速为 0.6 mL/min,进样量为 20 μL,检测波长为210 nm。
2 结果与分析
2.1 玛咖干燥实验
2.1.1 玛咖不同干燥方式干燥时间和终水分含量
经过预实验测定,新鲜玛咖中水分含量为54%左右,干制玛咖片含水量在5%左右时,后续的粉碎、过筛处理才能够高效进行。水分含量过高,玛咖片不易粉碎,制粉得率低;延长干燥时间可制备水分含量更低的玛咖干片,但对其生物活性成分的破坏加剧,同时也增加了加工能耗。因此干燥实验中将玛咖的水分目标值设定为5%。如表1所示,不同干燥方式所需时间从长到短依次为:自然干燥>真空干燥>冷冻干燥>热风干燥>微波干燥。干制获得的玛咖片含水量从高到低依次为:微波干燥>热风干燥>自然干燥>冷冻干燥>真空干燥。与自然干燥相比,真空干燥和冷冻干燥含水量显著降低,但这2种干燥方式耗时较长且处理量小,能耗高。微波干燥含水量显著高于自然干燥,且容易出现由于局部过热导致玛咖片焦化。自然干燥和热风干燥终含水量并无显著性差异,从产品含水量和干燥时间上来说,热风干燥和自然干燥都是可选的处理方法。

表1 不同干燥方式制备干制玛咖片水分含量Table 1 Water content of maca dried by different methods
注:不同字母表示含水量存在显著性差异(p<0.05)。
2.1.2 不同干燥方法对于玛咖活性成分的影响
干燥方式是在玛咖加工中影响其活性成分含量的重要因素之一。如图1所示,与新鲜样品相比,冷冻干燥得到的玛咖中芥子油苷含量显著升高,而其他4种干燥方式获得的玛咖中芥子油苷含量均显著低于新鲜样品。冷冻干燥由于其低温真空的特点,能够最大限度的保证在干燥过程中芥子油苷不被分解消耗,然而其能耗大,处理量小,规模生产成本高的缺点也限制了在生产中的规模应用。真空干燥和微波干燥对于芥子油苷的损失极为严重,所得样品中芥子油苷含量远小于其他组。热风干燥和自然干燥制备获得的样品芥子油苷含量并无显著性差异,其芥子油苷含量显著高于微波干燥和真空干燥,显著低于冷冻干燥。总之,热风干燥和自然干燥对于玛咖中芥子油苷保留程度较高,都可以作为玛咖干燥的备选方法。芥子油苷是玛咖中的主要活性成分之一,同时也广泛存在于大多数十字花科植物中。芥子油苷本身是比较稳定的化合物,而十字花科植物中含有内源性的黑芥子酶能够特异性水解芥子油苷。芥子油苷和和芥子酶由于空间上的隔离得以共存;而在干燥过程中,由于组织和细胞失水导致其结构被破坏,黑芥子酶被释放出来;进而降解芥子油苷。

图1 不同干燥方式制备玛咖粉中芥子油苷含量Fig.1 Glucosinolates content of maca dried by different methods注:不同字母表示芥子油苷含量存在显著性差异(p<0.05)。
不同干燥方式对于玛咖酰胺和玛咖烯的影响与芥子油苷不尽相同。如图2所示,与新鲜样品相比,玛咖酰胺在不同干燥方式下的终含量差异较大:自然干燥前后玛咖酰胺含量无显著差异;微波干燥后玛咖酰胺含量显著降低;冷冻干燥、热风干燥、真空干燥后玛咖酰胺含量升高,且3种方法依次显著升高。因此,就玛咖酰胺的保留而言,冷冻干燥、热风干燥和真空干燥都是可选的干燥方法。玛咖烯在玛咖中含量少,且易被加工过程所破坏。热风干燥前后玛咖烯含量无显著性差异,其他4种干燥方式均显著降低玛咖烯的含量。综上所述,热风干燥对于玛咖烯和玛咖酰胺的保留效果都比较理想。

图2 不同干燥方式制备玛咖粉中玛咖烯和玛咖酰胺含量Fig.2 Macamides and macaenes content of maca dried by different methods注:不同小写字母表示含玛咖酰胺量存在显著性差异(p<0.05),不同大写字母表示含玛咖烯量存在显著性差异(p<0.05)。图6、图7同。
综合以上数据,不同干燥方式对于玛咖中芥子油苷、玛咖烯和玛咖酰胺的影响各不相同。如图3所示,新鲜玛咖中芥子油苷主要的生物活性成分之一,含量占80%以上。不同干燥方式对于玛咖粉中主要活性成分的影响各有区别。首先微波干燥对于生物活性成分的破坏非常严重,活性成分总含量和各组分均明显低于新鲜样品;因此微波干燥不适合玛咖的生产加工。真空干燥对于玛咖酰胺的保留很好,但是其芥子油苷大量损失;同时考虑到其干燥时间和生产能耗,真空干燥并不是一个能兼顾生物活性成分保留和生产可操作性的方法。冷冻干燥能够最大限度的保留芥子油苷的含量,而对于玛咖酰胺的保留不如真空干燥和热风干燥。自然干燥和热风干燥对于芥子油苷、玛咖酰胺和玛咖烯均有不错的保留效果,可以作为玛咖干燥的备选方法。

图3 不同干燥方式制备玛咖粉中活性成分含量面积堆积图Fig.3 The content of active components of maca dried by different methods
2.2 玛咖超微粉碎实验
2.2.1 玛咖超微粉表面特征
经超微粉碎制备获得的玛咖超微粉,通过扫描电镜拍摄其表面特征图片,如图4所示。粉粒径随目数增加而降低。800目和1 000目的玛咖超微粉由于其粒径极小,团聚效应相对明显。扫描电镜观察下呈现多个颗粒聚集形成一个大颗粒的现象。这一现象与粉的含水量、吸湿性以及表面电荷等因素有关。

玛咖超微粉:a-200目;b-500目;c-800目;d-1 000目图4 玛咖超微粉扫描电镜图Fig.4 The SEM photographs of maca ultra-fine powder in different particle diameters
2.3 玛咖超微粉特性表征
对于1.2.2中得到的4种不同粒径的玛咖超微粉分别进行粉体特征相关指标的测定,以全面表征玛咖超微粉的特性。
2.3.1 玛咖超微粉的粒径分布
图5-a~图5-d分别为200目,500目,800目和1 000目的玛咖超微粉粒径分布图。200目时粒径分布出现分开双峰,表明此时粉中存在不同目数范围粉。500目时,粉粒径呈现连续分布,粒径范围为1~250 μm,峰值为25~30 μm;800目时,粉粒径分布进一步集中,向正态分布靠近,峰值在15 μm左右;1 000目时,粉进一步细化,大颗粒明显减少,粒径基本呈正态分布。
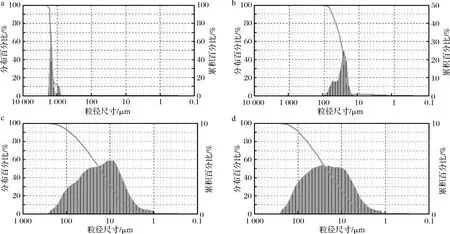
图5 玛咖超微粉的粒径分布图Fig.5 The drop diameter distribution graphs of maca ultra-fine powder in different particle diameter
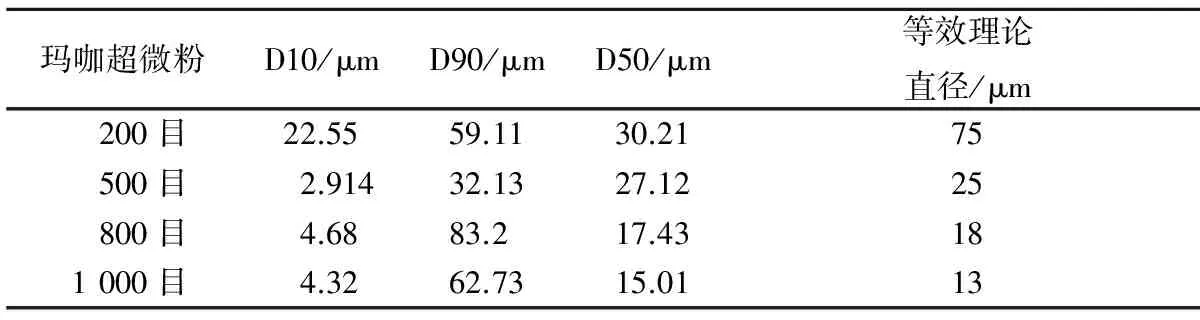
玛咖超微粉D10/μmD90/μmD50/μm等效理论直径/μm200目22.5559.1130.2175500目2.91432.1327.1225800目4.6883.217.43181000目4.3262.7315.0113
注:D10,D90,D50分别表示小于某粒径的微粒在全微粒群中的含量百分量为10%,50%,90%;D10,D90,D50越小,表示粉末的整体粒径越小。通常用d50,即中位径来表示超微粉的粒径大小。
2.3.2 水活度测定结果
经过水分活度仪测定,不同粒径大小的玛咖粉水活度结果如表3所示。

表3 不同粒径玛咖超微粉的水分活度Table 3 water activity of maca dried powders withdifferent particle diameter
水分活度是确定贮藏期限的一个重要因素。当温度、酸碱度和其他几个因素影响产品中的微生物快速生长的时候,水分活度可以说是控制腐败最重要的因素。总的趋势是,水分活度越小的食物越稳定,较少出现腐败变质现象。水活度低于0.6的情况下,绝大多数微生物无法生长。可见从200目到1 000目的玛咖粉的水活度均小于0.6,不容易出现因微生物滋生所导致的腐败变质。
2.4 不同粒径玛咖粉活性成分含量
2.4.1 不同粒径玛咖粉中芥子油苷含量
如图6所示,随粒径减小,玛咖超微粉中芥子油苷含量显著增加。芥子油苷是一种广泛分布于十字花科植物各个组织器官中的次生代谢产物,这类植物存在特殊的富硫细胞专门贮存芥子油苷[19]。超微粉碎制备的玛咖粉粒径小,比表面积大;通过破坏细胞壁及细胞膜,使得芥子油苷容易穿透细胞结构从组织中游离出来。

图6 不同粒径的玛咖超微粉芥子油苷含量Fig.6 Glucosinolates content of maca dried powders with different particle diameter
2.4.2 不同粒径玛咖粉中玛咖烯和玛咖酰胺含量测定
如图7所示,与芥子油苷含量趋势相反;随粒径减小,玛咖超微粉中玛咖烯和玛咖酰胺含量均显著下降。玛咖烯和玛咖酰胺是玛咖中特有的一类内源性活性生物碱,研究发现该类化合物具有抗疲劳[17]和神经细胞保护[20]等生物活性。然而相关研究表明[21-22],玛咖烯和玛咖酰胺并不是玛咖内源性的活性成分;而是玛咖在加工和贮藏过程中由玛咖中的营养物质和活性成分经内源性酶作用分解,生成的降解产物二次合成产生。结合2.4.1中的结果可以推断,超微粉碎是芥子油苷保留的有利因素,是玛咖酰胺生成的不利因素。
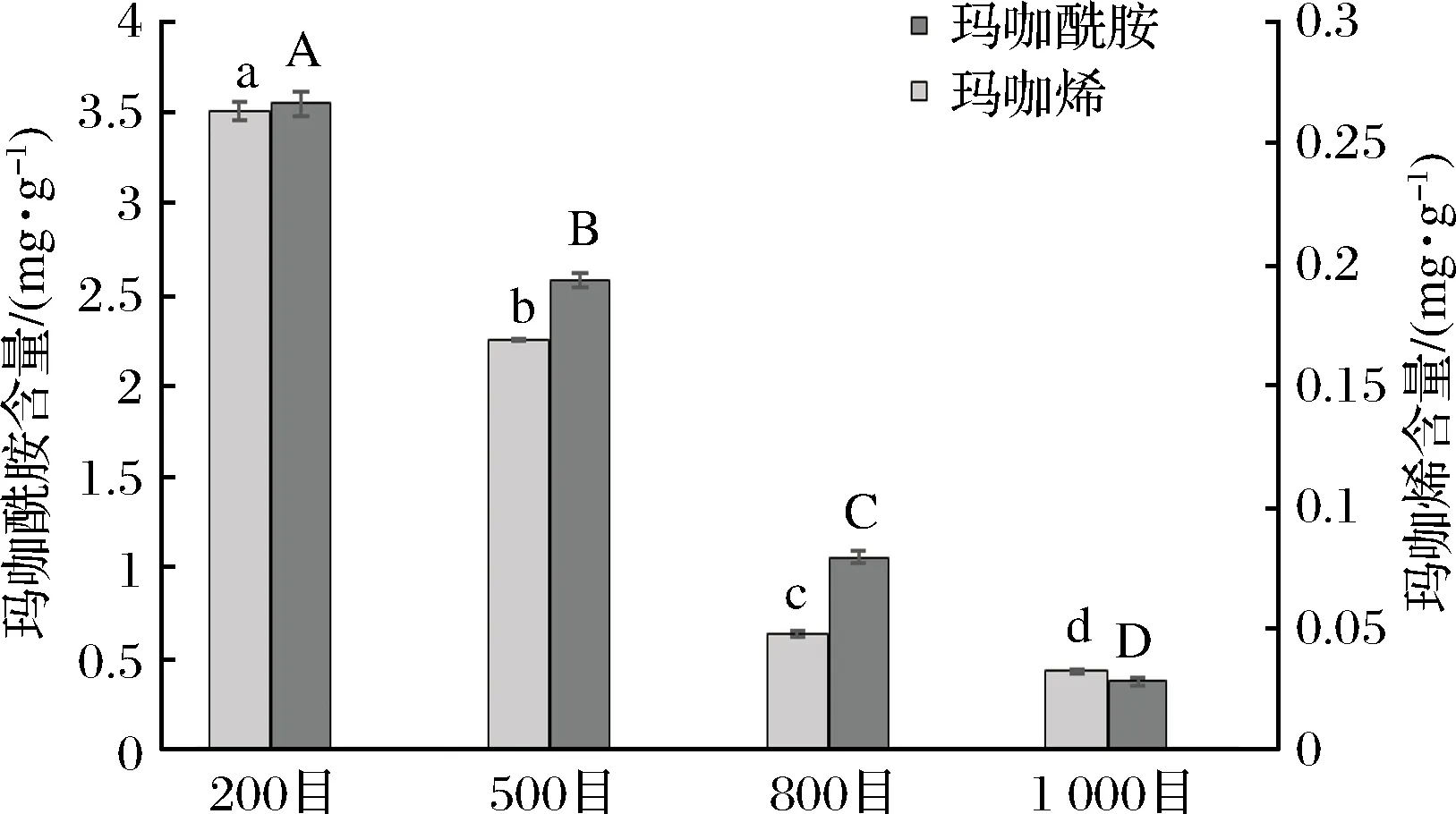
图7 不同粒径的玛咖超微粉中玛咖烯和玛咖酰胺含量Fig.7 Macamides and macaenes content of maca dried powders with different particle diameter
不同粒径的玛咖超微粉对于活性成分的保留具有选择性(见图8)。随粒径增大,玛咖超微粉中芥子油苷、玛咖烯和玛咖酰胺总含量呈上升趋势。其中,芥子油苷含量随粒径增大而增加;玛咖烯和玛咖酰胺含量随粒径增大而减少。
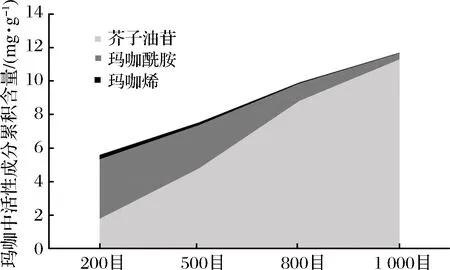
图8 不同粒径的玛咖超微粉中活性成分含量面积堆积图Fig.8 The content of active components of maca dried powders with different particle diameter
2.5 玛咖超微粉气味客观感官评价
利用电子鼻评价不同干燥方式制备的玛咖粉的气味变化,所得数据经多元统计分析结果如图9所示。PCA得分图可以看出冷冻干燥和自然干燥与其他4种干燥方式在气味感官状态上存在较大差异,同时冷冻干燥和自然干燥之间也明显不同。微波干燥、热风干燥和真空干燥3种方式在气味感官状态方面比较接近。
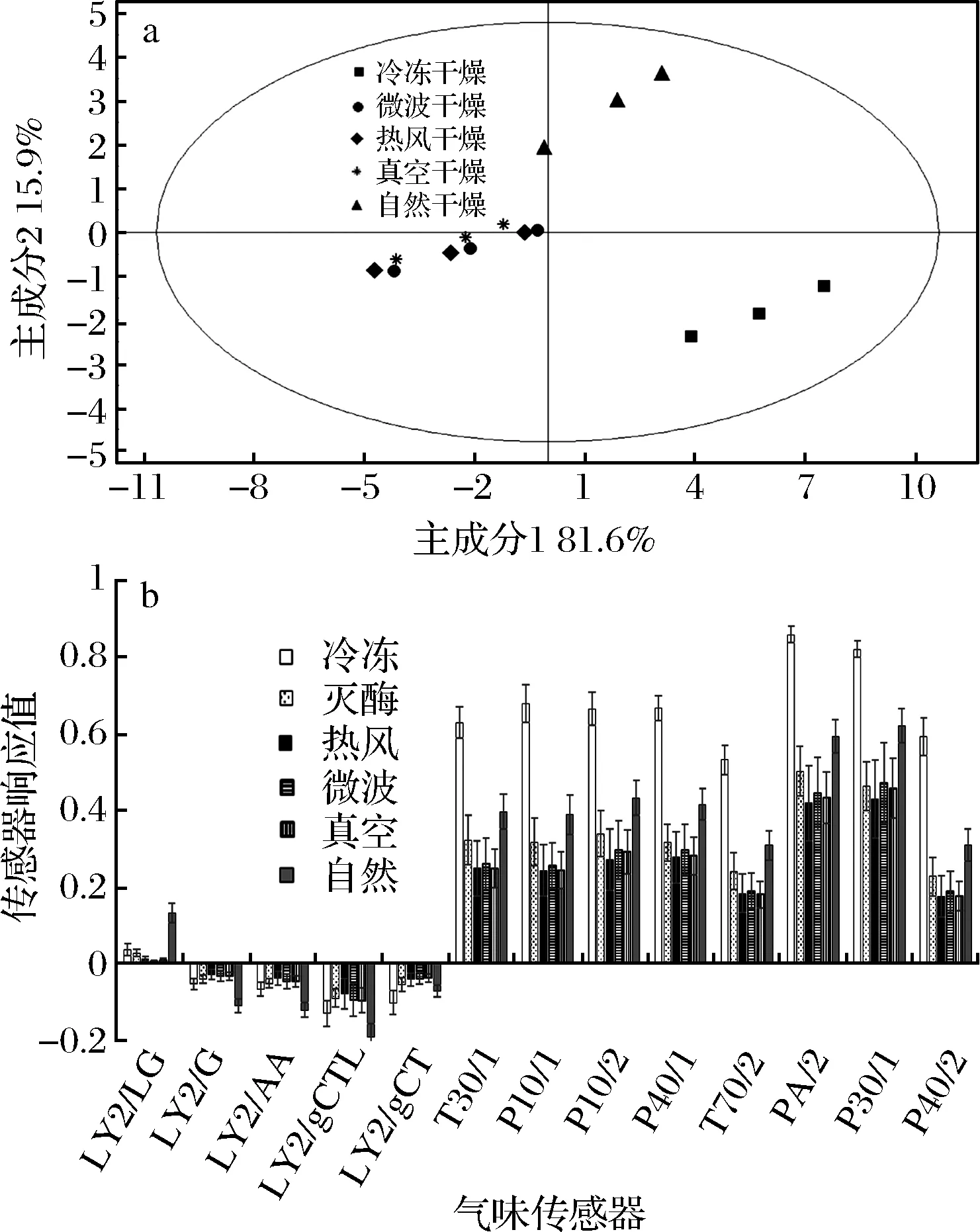
a-PCA得分图;b-传感器响应图图9 不同干燥方式玛咖粉电子鼻气味表征Fig.9 Sensory evaluation of maca dried by different methods
结合传感器响应图不难看出,在终含水量相同的情况下,不同干燥方式对玛咖气味的影响程度依次为:冷冻干燥>自然干燥>微波干燥>真空干燥>热风干燥。即冷冻干燥能够最大程度地保留玛咖的原有气味;自然干燥次之,热风干燥、微波干燥和真空干燥对于玛咖气味物质的影响比较相似,效果都弱于冷冻干燥和自然干燥。
类似的,不同粒径的玛咖粉PCA分析可视化地显示中多种气味物质的差别如图10所示:200目、500目、800目和1 000目的玛咖超微粉体气味存在明显区别。故推测不同粒度的玛咖粉,释放特征性气味物质的种类和含量有所不同,从PCA图谱上也显示出一定规律性。从传感器响应图可以看出,在终含水量相同的情况下,不同粒径对玛咖气味的影响程度依次为:1 000目>800目>500目>200目。即玛咖的风味物质呈现出随粒径减小而提高的趋势。然而值得注意的是,这一趋势在不同传感器的测定值中也有部分例外,比如在LY型传感器中,出现200目的响应值远高于其他粒径的超微粉体的相反趋势。这一现象可能是因为LY型传感器主要测试的丙烷、丁烷、酒精、硫化氢等物质气味信息,推测气味物质在超微粉体的小尺寸效应下,以高于正常扩散或氧化代谢的速度被消耗掉了,导致500目以上的超微粉体中这类气味物质响应很低。另外,超微粉碎化的玛咖干粉,主观气味比普通干粉辛辣味明显减轻,更容易被消费者所接受。
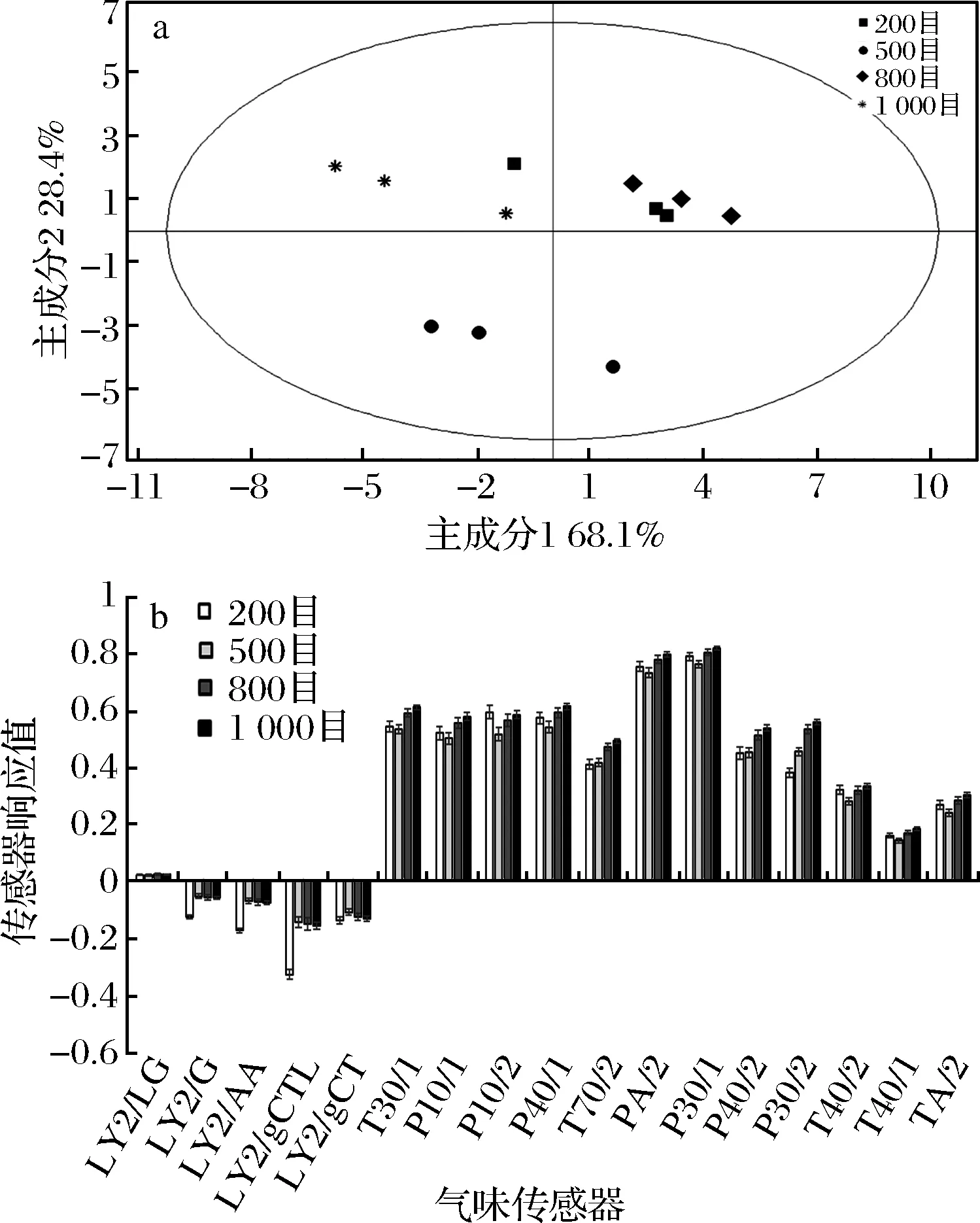
a-PCA得分图;b-传感器响应图图11 不同粒径玛咖粉电子鼻气味表征Fig.11 Sensory evaluation of maca with different particle diameter
3 讨论
玛咖中蛋白质含量较高,氨基酸组成合理和必需氨基酸含量高,富含支链氨基酸和牛磺酸;脂肪含量低,但不饱和脂肪酸含量高;矿物质含量丰富,钾、钙、镁、锌等微量元素都较为显著[23]。此外,玛咖中含有芥子油苷[24]、玛咖烯、玛咖酰胺[25]、多糖[26]等生物活性成分。从含量上来说,芥子油苷和玛咖酰胺是玛咖中最主要的活性成分;同时也是多种生物活性的重要物质基础。芥子油苷是十字花科植物中广泛存在的一种次生代谢产物,由硫代β-D-吡喃型葡萄糖基多变的侧链组成。玛咖中最为主要的2种芥子油苷是苄基芥子油苷和间甲氧基芥子油苷,两者总含量占玛咖中芥子油苷含量的90%以上;同时这2种芥子油苷也是玛咖中特有的,在其他十字花科植物中极少发现;可以说苄基芥子油苷和间甲氧基芥子油苷是玛咖中的特征活性成分之一。玛咖酰胺是另一类玛咖中特有的活性成分;从结构上说,玛咖酰胺由脂肪酸链以酰胺键连接含氮基团组成。通过对玛咖干燥过程中相关营养和活性成分的变化规律研究推断,玛咖酰胺中脂肪酸链来自于细胞膜中磷脂的分解;含氮基团来源于芥子油苷经黑芥子酶的水解产物卞胺;新鲜玛咖中玛咖酰胺含量很低,采摘后的传统加工过程是玛咖酰胺富集的重要环节。本研究发现,不同干燥方式对玛咖中活性成分的影响各不相同。新鲜玛咖中芥子油苷含量很高而玛咖酰胺相对较低,干燥过程应该尽量避免其水解损失同时兼顾玛咖酰胺的富集。真空干燥和微波干燥对于芥子油苷、玛咖烯和玛咖酰胺的破坏都很严重;冷冻干燥不利于玛咖酰胺和二次合成;自然干燥和热风干燥可以兼顾2种活性成分,设备易于实现,使用成本低,也便于在生产中应用。
超微粉碎是利用机械力或流体动力的方法将毫米级别的物料颗粒粉碎至粒径10~25 μm的粉碎加工技术。基于超微粉碎技术制备的超微粉体比表面积和空隙率增加,溶解性、分散性和吸附性等理化性质大幅提升。本研究中制备获得的玛咖超微粉体活性成分芥子油苷含量显著增加,感官气味也得到进一步改善;生物利用率和产品质量也相应地提高。由于玛咖酰胺的部分来源于芥子油苷的水解含氮产物,超微粉碎所产生的破壁效应对于黑芥子酶的灭活作用可能是芥子油苷损失较少的原因之一,同时也是玛咖酰胺富集的不利因素。
[1] WANG Y, WANG Y, MCNEIL B, et al. Maca: an andean crop with multi-pharmacological functions [J]. Food Research International, 2007, 40(7): 783-792.
[2] CLÉMENT C, DIAZ D, MANRIQUE I, et al. Secondary metabolites in maca as affected by hypocotyl color, cultivation history, and site [J]. Agronomy Journal, 2010, 102(2): 431-439.
[3] LI G, AMMERMANN U, QUIR S C F. Glucosinolate contents in maca (LepidiumperuvianumChacon) seeds, sprouts, mature plants and several derived commercial products [J]. Economic Botany, 2001, 55(2): 255-262.
[4] MCCOLLOM M M, VILLINSKI J R, MCPHAIL K L, et al. Analysis of macamides in samples of Maca (Lepidiummeyenii) by HPLC-UV-MS/MS [J]. Phytochemical Analysis, 2005, 16(6): 463-469.
[5] ALMUKADI H, WU H, B HLKE M, et al. The macamideN-3-methoxybenzyl-linoleamide is a time-dependent fatty acid amide hydrolase (FAAH) inhibitor [J]. Molecular Neurobiology, 2013, 48(2): 333-339.
[6] BROOKS N A, WILCOX G, WALKER K Z, et al. Beneficial effects ofLepidiummeyenii(Maca) on psychological symptoms and measures of sexual dysfunction in postmenopausal women are not related to estrogen or androgen content [J]. Menopause, 2008, 15(6): 1 157-1 162.
[8] 代春艳, 鲁惠珍, 蔡良辉, 等. 干燥技术对玛咖品质的影响 [J]. 中国医药工业杂志, 2016, 47(6): 702-705.
[9] 张弘, 于连松, 郑华, 等. 秘鲁参微波-真空干燥特性及工艺优化 [J]. 化工进展, 2011(S1): 15-20.
[10] 张弘, 郑华, 于连松, 等. 玛咖真空干燥特性及工艺参数优化 [J]. 农业工程学报, 2012(S1): 267-272.
[11] 涂行浩, 郑华, 张弘, 等. 玛咖块根流化床干燥特性及动力学研究 [J]. 热带作物学报, 2015, 36(8): 1 426-1 431.
[12] 甘瑾, 冯颖, 张弘, 等. 三种色型玛咖芥子油苷组分及含量分析 [J]. 中国农业科学, 2012, 45(7): 1 365-1 371.
[13] CUI Z-W, XU S-Y, SUN D-W. Microwave-vacuum drying kinetics of carrot slices [J]. Journal of Food Engineering, 2004, 65(2): 157-164.
[14] GB 5009.3—2010. 食品安全国家标准食品中水分的测定 [S] [D], 2010.
[15] GB/T 23490—2009. 食品水分活度的测定 [S].北京:中国标准出版社, 2009.
[16] 王艳丽, 刘凌, 孙慧, 等. 膳食纤维的微观结构及功能特性研究 [J]. 中国食品添加剂, 2014(2): 98-103.
[17] 转基因植物及其产品食用安全检测 抗营养素 第3部分: 硫代葡萄糖苷的测定 [S]. 农业标准, 2006.
[18] YANG Q, JIN W, LV X, et al. Effects of macamides on endurance capacity and anti-fatigue property in prolonged swimming mice [J]. Pharmaceutical Biology, 2016, 54(5): 827-834.
[19] KISSEN R, ROSSITER J T, BONES A M. The ‘mustard oil bomb’: not so easy to assemble?! Localization, expression and distribution of the components of the myrosinase enzyme system [J]. Phytochemistry Reviews, 2009, 8(1): 69-86.
[20] WU H, KELLEY C J, PINO-FIGUEROA A, et al. Macamides and their synthetic analogs: evaluation of in vitro FAAH inhibition [J]. Bioorganic & Medicinal Chemistry, 2013, 21(17): 5 188-5 197.
[21] ESPARZA E, HADZICH A, KOFER W, et al. Bioactive maca (Lepidiummeyenii) alkamides are a result of traditional Andean postharvest drying practices [J]. Phytochemistry, 2015, 116:138-148.
[22] SENDKER J, NAHRSTEDT A. Generation of primary amide glucosides from cyanogenic glucosides [J]. Phytochemistry, 2009, 70(3): 388-393.
[23] DINI A, MIGLIUOLO G, RASTRELLI L, et al. Chemical composition ofLepidiummeyenii[J]. Food Chemistry, 1994, 49(4): 347-349.
[24] DINI I, TENORE G C, DINI A. Glucosinolates from Maca (Lepidiummeyenii) [J]. Biochemical Systematics and Ecology, 2002, 30:1 087-1 090.
[25] MUHAMMAD I, ZHAO J, DUNBAR D C, et al. Constituents ofLepidiummeyenii‘maca’ [J]. Phytochemistry, 2002, 59(1): 105-110.
[26] ZHA S, ZHAO Q, CHEN J, et al. Extraction, purification and antioxidant activities of the polysaccharides from maca (Lepidiummeyenii) [J]. Carbohydrate Polymers, 2014, 111: 584-587.

