小檗碱改善高糖诱导血管内皮细胞和微血管内皮细胞损伤*
侯聪聪 梁红玉 赵丽丽 赵 丁
糖尿病并发症是糖尿病治疗的难题,而糖尿病血管病变几乎与其所有并发症均密切相关。周围神经病变是糖尿病神经系统最常见的并发症,目前认为血管功能障碍是引起糖尿病神经病变的重要原因[1]。正常状态的血管(微血管)内皮细胞对维持血管动态平衡和神经周围内环境的稳定起到重要作用。提示血管内皮因素在糖尿病及其并发症当中发挥重要作用,而目前以血管为糖尿病治疗靶标的临床药物及相关研究甚少。
小檗碱(Berberine)是黄连的主要有效成分,近年研究表明小檗碱具有降血糖、降血脂、抗氧化、改善胰岛素抵抗、抑制醛糖还原酶活性等作用[2],并可通过抗氧化应激改善受损血管内皮功能而改善血管病变[3-4],用于糖尿病及各种并发症的治疗。在人类视网膜细胞和神经胶质细胞中,小檗碱可以下调诱导型一氧化氮合酶(iNOS),起到一定的抗炎症作用[5-6]。但在血管内皮细胞,尤其是微血管内皮细胞中,小檗碱对iNOS的调控作用尚不明确。本文旨在探讨小檗碱对高糖引起的人脐静脉血管内皮细胞(HUVEC)和人心脏微血管内皮细胞(HCMEC)损伤的改善作用及可能机制,为糖尿病及其并发症的治疗提供参考。
1 材料与方法
1.1 实验细胞株
HUVEC由协和细胞所购入; HCMEC由美国ScienCell购入。
1.2 主要试剂和仪器
DMEM低糖培养液购自Gibco公司,生产批号:1139385;内皮细胞培养基ECM(内含ECGS、胎牛血清、青霉素、链霉素溶液)购自Sciencell公司,生产批号:20285;胎牛血清购自德国PAN-Biotech,生产批号:P130912;D-(+)-葡萄糖购自购自Sigma公司,生产批号:WXBB1163V;胰蛋白酶购自Amresco公司,批号: 2533C173;MTT购自Sigma公司,生产批号:M-2128;iNOS检测试剂盒购自南京建成生物工程研究所,生产批号:20150423。
CO2培养箱(HF240,Heal Force);洁净工作台(SW-CJ-2FD,苏州安泰空气技术有限公司); 倒置
显微镜(CX31,日本Olympus 公司);超纯水机(Milli Q, 美国Millipore 公司);酶标仪(sunrise ,瑞士Tecan公司);冷冻离心机(D3024R,美国SCILOGEX公司);细胞超声仪(FS-450N,上海生析超声仪器有限公司)。
1.3 细胞培养与实验分组
1.3.1细胞培养:使用含10%胎牛血清、100U/ml 青霉素、100g/ml 链霉素的低糖(5mM葡萄糖)DMEM完全培养基培养HUVEC,使用含5%胎牛血清、100units/ml 青霉素、100g/ml 链霉素的ECM完全培养基培养HCMEC,将细胞置于37℃、含5% CO2、饱和湿度的培养箱中常规培养,待细胞70%-80%融合时,按1∶4-1∶5传代培养。
1.3.2实验分组:以含5mM葡萄糖的DMEM完全培养基或ECM完全培养基正常培养的细胞为对照组,以分别加入含有不同浓度D-(+)-葡萄糖(30、50、100、200mM)的完全培养基培养的细胞为各高糖组、以在加入100mM D-(+)-葡萄糖的同时加入含有不同浓度小檗碱(0.01、0.1、1.0μM)的完全培养基培养的细胞为各小檗碱组。
1.4 MTT法检测细胞活力
取对数生长期的HUVEC和HCMEC按105cells/孔的密度分别接种于96 孔板中,并孵育24 h。每组6个复孔,各组细胞按以上分组条件培养24h和48h后,加入MTT 至其终浓度为0.5mg/ml,并继续培养4h。吸除上清液,在留下的紫色甲臜结晶中加入200μl/孔的DMSO,置于37℃ 环境中作用30min使紫色甲臜结晶充分溶解,然后用酶标仪测定570nm 的吸光度值(OD值),取其平均值,计算细胞活力。细胞活力=处理组细胞的OD平均值/同期对照组细胞的OD平均值×100%。
1.5 iNOS活性检测
取对数生长期的HUVEC,以2×106cells /皿接种于直径10cm的培养皿中。细胞贴壁后,以含5mM葡萄糖完全培养基培养的细胞为对照组,以加入100mM D-(+)-葡萄糖的完全培养基培养的细胞为高糖组、以加入100mM D-(+)-葡萄糖和0.1μM小檗碱的完全培养基培养的细胞为小檗碱组,每组各设置4皿。各组细胞培养24h后收集细
胞,细胞超声仪超声裂解细胞,离心,测定样品蛋白浓度,按照iNOS检测试剂盒说明书进行低温操作,用酶标仪于530nm处,准确测定各组OD值,计算出各组的iNOS活性,单位用U/ml表示。
1.6 统计学处理

2 结果
2.1 不同浓度葡萄糖对HUVEC和HCMEC细胞活力损伤作用
各组HUVEC的OD值:处理24h或48h后,各组HUVEC的OD值差异有统计学意义(F值=17.992、83.346,P<0.01)。处理24h后,与对照组比较,30mM和50mM高糖组差异无统计学意义(t值=-0.393、5.503,P>0.05);100mM和200mM高糖组HUVEC的OD值均降低,差异均有统计学意义(t值=7.940、17.217,P<0.05)。处理48h后,与对照组比较,30mM、50mM、100mM、200mM高糖组HUVEC的OD值均降低,差异有统计学意义(t=0.207、0.356、0.834、1.266,P<0.05)。各组HUVEC的OD值及细胞活力呈对照组>30mM组>50mM组>100mM组>200mM组趋势,可见随着葡萄糖浓度的增大,细胞活力减弱越明显。与同组处理24h比较,处理48h后,随着葡萄糖作用时间的延长,各组HUVEC细胞活力下降。见表1。
各组HCMEC的OD值及细胞活力变化趋势与HUVEC一致。见表2。

表1 不同浓度葡萄糖对HUVEC细胞活力的影响均=6)
注:与对照组相同时间比较,1)P<0.05

表2 不同浓度葡萄糖对HCMEC细胞活力的影响均=6)
注:与对照组相同时间比较,1)P<0.05
2.2 小檗碱对100mM葡萄糖引起的细胞活力损伤的影响
各组HUVEC的OD值:处理24h或48h后,各组HUVEC的OD值差异有统计学意义(F=4.863、40.118,P<0.01)。处理24h后,与对照组
比较,高糖组HUVEC的OD值降低,差异有统计学意义(t=2.441,P<0.05)。0.01μM、0.1μM小檗碱组与高糖组差异无统计学意义(t=-0.169、-0.305,P>0.05),1μM小檗碱组较高糖组的OD值明显增加(t=-1.087,P<0.01)。处理48h后,与
对照组比较,高糖组HUVEC的OD值降低,差异有统计学意义(t值=2.816,P<0.05)。0.01μM、0.1μM小檗碱组较高糖组细胞OD值明显升高(t值=-0.257、-1.107,P<0.01),1μM小檗碱组与高糖组差异无统计学意义(t值=-0.189,P>0.05)。小檗碱对细胞活力的影响没有明显的浓度依赖作用;0.01μM、0.1μM 小檗碱处理24h细胞活力较高糖组无明显变化,而随着作用时间的延长,处理48h后对细胞活力的影响较高糖组有了显著增加。1μM小檗碱作用24h较高糖组细胞活力增加显著,延长作用至48h后,细胞活力较高糖组无改善作用。见表1。
各组HCMEC的OD值及细胞活力变化趋势与HUVEC一致。见表4。

表3 小檗碱对100 mM葡萄糖引起HUVEC细胞活力损伤改善的比较均=6)
注:与对照组相同时间比较,1)P<0.05;与高糖组相同时间比较,2)P<0.01

表4 小檗碱对100 mM葡萄糖引起HCMEC细胞活力损伤改善的比较均=6)
注:与对照组相同时间比较,1)P<0.05;与高糖组相同时间比较,2)P<0.05
2.3 葡萄糖对HUVEC细胞iNOS的影响及小檗碱的作用
iNOS活性:三组HUVEC细胞iNOS 活性差异有统计学意义(F=9.818,P<0.01),高糖组较对照组iNOS活性显著增加(t值=-6.786,P<0.01),小檗碱组较高糖组iNOS活性明显降低(t值=6.786,P<0.01)。见表5。
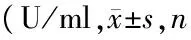
表5 各组HUVEC细胞iNOS活性比较均=4)
注:与对照组比较,1)P<0.01;与高糖组比较,2)P<0.01
3 讨论
血管和微血管的损害在糖尿病周围神经病变及各种并发症的发病机制中占据重要地位。血管内皮细胞功能紊乱是导致糖尿病血管病变和神经病变的重要因素[7]。内皮功能异常的动脉显著特征就是一氧化氮(NO)生物利用度的降低,内皮依赖的血管扩张受损,NO参与了血管内皮的损伤[8-10]。NOS/NO信号通路已经成为新药的突破途径之一,但在血管内皮研究中关注点落在对内皮型一氧化氮合酶(eNOS)的调节,对病理状态iNOS的过表达较少提及。而病理情况或损伤状态下iNOS过量生成NO,被认为是产生细胞毒性作用的主要来源,常出现iNOS表达的明显增加[11]。
本实验检测了不同浓度葡萄糖和不同浓度小檗
碱对细胞活力的影响,100mM葡萄糖作用24h后即可产生显著的细胞损伤作用,故而后续实验选择100mM葡萄糖作为高糖损伤模型用于观察小檗碱的效应。小檗碱三个浓度梯度对细胞活力的改善作用没有明显的剂量-效应关系,综合比较发现0.1μM小檗碱较其他两个浓度效果最佳,因此选择0.1μM小檗碱用于iNOS的检测。由于高糖和小檗碱对HUVEC和HCMEC两种细胞活力的影响均呈现一致的趋势,因此只在HUVEC中检测了iNOS活性。
小檗碱作为有潜力的抗糖尿病药物,有报道指出,其对糖尿病大鼠肠系膜小血管和微血管及周围组织的病理变化有一定改善作用[12],对早期糖尿病大鼠胃壁神经和心脏微血管损伤也有一定保护作用[13]。但小檗碱的作用机制不甚明了,本研究在细胞层次上进一步说明小檗碱对(微)血管内皮细胞的损伤具有保护作用,并通过下调iNOS活性改善了高糖引起的血管内皮细胞损伤。小檗碱可能通过对高糖状态下血管内皮细胞iNOS的调节,从而抑制NO的过量生成,减少炎症发生,进而改善血管内皮细胞活力。
综上,小檗碱对高糖引起的HUVEC和HCMEC损伤有改善作用,其机制与下调iNOS密切相关。这一结果为其防治糖尿病周围神经病变及各种并发症提供了参考。
◀
本文第一作者简介:
侯聪聪(1987-),女,汉族,硕士研究生,研究方向为中药及天然药物活性物质药理毒理作用
1 Grisold A, Callaghan BC, Feldman EL. Mediators of diabetic neuropathy: is hyperglycemia the only culprit? [J]. Current Opinion in Endocrinology Diabetes & Obesity, 2017, 24(2): 103-111.
2 Yao J, Kong WJ, Jiang JD. Learning from berberine: Treating chronic diseases through multiple targets [J]. Science China Life Sciences, 2015, 58(9): 854-859.
3 Cheng F, Wang Y, Li J, et al. Berberine improves endothelial function by reducing endothelial microparticles-mediated oxidative stress in humans [J]. International Journal of Cardiology, 2013, 167(3): 936-942.
4 Wang Q, Zhang M, Liang B, et al. Activation of AMP-activated protein kinase is required for berberine induced reduction of atherosclerosis in mice: the role of uncoupling protein 2[J]. PLoS One, 2011, 6(9): e25436.
5 Jiang Q, Liu PQ, Wu, XQ, et al. Berberine attenuates lipopolysaccharide-induced extracelluar matrix accumulation and inflammation in rat mesangial cells: Involvement of NF-kappa B signaling pathway[J]. Molecular and Cellular Endocrinology, 2011, 331(1): 34-40.
6 Lu DY, Tang CH, ChenYH, et al. Berberine Suppresses Neuroinflammatory Responses Through AMP-Activated Protein Kinase Activation in BV-2 Microglia[J]. Journal of Cellular Biochemistry, 2010, 110(3):697-705.
7 Roustit M, Loader J, Deusenbery C, et al. Endothelial Dysfunction as a Link Between Cardiovascular Risk Factors and Peripheral Neuropathy in Diabetes [J]. Journal of clinical endocrinology & Metabolism, 2016, 101(9): 3 401-3 408.
8 Tesfamariam B, Defelice AF. Endothelial injury in the initiation and progression of vascular disorders [J]. Vascular Pharmacology, 2007, 46(4): 229-237.
9 Forstermann U, Munzel T. Endothelial nitric oxide synthase in vascular disease: from marvel to menace [J]. Circulation, 2006, 113(13): 1 708-1 714.
10 Huang, PL. Endothelial nitric oxide synthase and endothelial dysfunction [J]. Current Hypertension Reports, 2003, 5(6): 473-480.
11 韩雨薇, 张媛媛, 赖秀英, 等. 中药对一氧化氮合酶/一氧化氮系统调节作用的研究进展[J].中国药科大学学报, 2017, 48(1): 8-15.
12 展晓亮, 刘 帅, 祗明花, 等. 小檗碱对糖尿病大鼠肠系膜血管形态改变的作用[J]. 微循环学杂志, 2017,27 (1): 6-10.
13 祁艳艳, 郝璋森, 梁红玉,等. 小檗碱对糖尿病大鼠胃壁神经元及肠系膜和心脏微血管损伤的保护作用[J]. 微循环学杂志, 2015, 25(2): 5-7.