五味苦参肠溶胶囊对溃疡性结肠炎小鼠半胱天冬氨酸蛋白酶1、白细胞介素-1β蛋白的影响
罗 丹,高 路,仝战旗,张 晨
1解放军总医院 南楼中医针灸科,北京 100853;2天津中医药大学,天津 300913
溃疡性结肠炎(ulcerative colitis,UC)是一种病因及发病机制尚不完全明确的慢性反复发作性、非特异性、炎症性肠病,以腹泻、黏液脓血便、里急后重等为主要症状,其与克罗恩病不同,结肠镜下病变主要见于直肠和乙状结肠,甚至可达全结肠,病变局限于黏膜和黏膜下层。现代医学普遍认为本病主要由免疫异常、感染、环境、遗传、心理等因素导致[1],常用治疗药物有水杨酸制剂、糖皮质激素、免疫抑制剂等方法,但仍存在反复发作、不良反应较多、耐药等问题[2]。本实验所用五味苦参肠溶胶囊为仝战旗老师及其团队针对溃疡性结肠炎研制而成的一种国家新药,由苦参、白芨、青黛、地愉、生甘草5味药组成。通过多中心、随机、双盲、对照研究试验发现,此药总有效率高达92%,疗效并不劣于艾迪莎[3]。故本文进一步探讨五味苦参肠溶胶囊治疗UC的疗效及作用机制,为其药理研究提供实验基础。
材料和方法
1 实验动物 选用SPF级别BALB/C雄性小鼠50只,体质量20 ~ 22 g,由军事科学院医学研究院实验动物中心提供,实验动物许可证号:SCXK-(军 )2012-0004。
2 药物与主要仪器 五味苦参结肠溶胶囊(药物组成:苦参、地榆、青黛、白及、生甘草,北京中惠药业有限公司生产,批号:20160601);Mouse IL-1βELISA试剂盒(Andygene,北京欣怡公司,批号:HTLR20532)、Mouse Caspase-1 ELISA试剂盒(Andygene,北京欣怡公司,批号:HTLV21002);3%戊巴比妥钠(德国,k2208);葡聚糖硫酸钠(dextran sulfate sodium salt,DSS):(分子量 36 000 ~ 50 000,批号:9011-18-1);匹拉米洞半定量检测盒(BA-20200)。TLL-C台式高速冷冻离心机(北京四环科学仪器厂有限公司),长风水浴箱(XMTD-6000),多功能酶标仪(Thermo,C400044),显微镜。
3 动物分组与UC模型制备 将50只小鼠随机分为5组:空白对照组(10只)、模型组(10只)、五味苦参低剂量组(10只)、五味苦参中剂量组(10只)、五味苦参高剂量组(10只)。小鼠适应性饲养7 d后,除空白组外,均自由饮用3% DSS,每日观察小鼠的体质量、精神状态以及粪便性状、隐血情况等。7 d后随机取3只模型组小鼠处死,确认是否造模成功,若造模成功则开始干预。造模成功标准:小鼠一般情况较差,粪便隐血试验阳性,肉眼观察结肠组织有水肿、溃疡,结肠组织病理显示结肠组织结构紊乱,腺体减少或消失,杯状细胞减少,大量炎症细胞浸润。
4 干预方法 空白组、模型组分别以等量0.9%氯化钠注射液灌肠。将五味苦参肠溶胶囊内容物溶于0.9%氯化钠注射液,按临床成人日剂量的10、20、40倍剂量换算,五味苦参组低、中、高剂量组分别给予 1.92 g/(kg·d)、3.84 g/(kg·d)、7.68 g/(kg·d),混悬于0.9%氯化钠注射液,每日灌肠1次。灌肠方法:采用头皮针与一次性注射针组合的灌肠器灌肠[4],从肛门插入,深度约2 cm左右推入灌肠液并倒立约1 min。干预7 d后禁食24 h,取全结肠(回盲部至肛门口上1 cm)病理观察。
5 结肠长度和脾系数、结肠系数检测 称取各组小鼠处死前体质量并做好记录,麻醉解剖后取出其结肠、脾,于预冷0.9%氯化钠注射液中洗净,滤纸吸干后称取质量、结肠用直尺量出长度并做好记录。脾系数增大,提示脾充血、水肿、肥大等炎性病变;结肠系数减小,提示结肠萎缩[5]。
脾系数=脾质量(g)/小鼠体质量(g)
结肠系数=结肠质量(g)/小鼠体质量(g)
6 小鼠结肠病理观察 如上述取病变最明显处组织置于4%多聚甲醛溶液固定,常规石蜡包埋,切片,苏木精-伊红染料染色,脱水封固后,用于结肠组织形态观察、光镜观察。
7 结肠组织Caspase-1、IL-1β蛋白含量的检测
取50 mg结肠组织,样本质量与匀浆液PBS (pH 7.2)按1∶9的比例采用玻璃匀浆器充分匀浆后,4℃,3 000 r/min离心20 min,仔细收集上清,分装待测。检测方法按照ELISA试剂盒说明书进行,终止反应后,将酶标板放入酶标仪槽内,选择450 nm波长进行检测,确定标准品和空白对照区域,检测相应的吸光度(OD)值,绘制标准曲线并计算相应的浓度。
8 统计学方法 采用SPSS 22.0统计软件进行统计学处理,计量资料以-x±s表示(数据均为正态分布),多组间样本均值比较采用单因素方差分析,组间两两比较使用LSD法,P<0.05为差异有统计学意义。绘图采用GraphPad Prism 5绘图软件。
结 果
1 各组结肠长度比较 图1、表1可见,与空白对照组比较,造模后各组小鼠结肠长度均有不同程度缩短。与模型组相比,五味苦参低、中、高剂量组结肠长度均有不同程度的增长。结果提示,模型组结肠长度与中、高剂量组有统计学差异(P均<0.01),而中剂量组与高剂量组之间无统计学差异(P>0.05)。
2 各组脾系数和结肠系数比较 由表1可见,与空白对照组相比,造模后各组脾系数均有不同程度升高,结肠系数均有不同程度降低。与模型组相比,五味苦参低、中、高剂量组脾系数均有不同程度的降低,其中中剂量组降低显著(P<0.01)。与模型组比较,五味苦参各组结肠系数均有不同程度的升高,其中五味苦参中、高剂量组均显著升高(P均<0.05)。
3 结肠组织病理形态分析 制作病理切片,HE染色后光镜下观察,模型组标本可见结肠黏膜结构紊乱,杯状细胞减少,有炎症细胞浸润,其中以中性粒细胞为主,伴有淋巴细胞、嗜酸性细胞等,大量腺体被破坏,腺腔消失,局部有水肿,病变主要累及黏膜及黏膜下层,少数可达浆膜层,可见淋巴细胞聚集形成的淋巴滤泡。大多数小鼠远端结肠损伤程度比近端结肠严重。由图2可见,经五味苦参灌肠干预后,与模型组对比,治疗组小鼠的结肠黏膜结构排列较整齐,炎症细胞浸润较少,溃疡浅而少。
4 各组结肠组织Caspase-1、IL-1β蛋白水平比较 由表1可见,与空白组比较,模型组小鼠结肠组织中Caspase-1、IL-1β蛋白水平升高;与模型组比较,五味苦参各组均有不同程度降低,由此可推测,UC可导致小鼠结肠黏膜中Caspase-1、IL-1β蛋白表达的升高,而五味苦参肠溶胶囊能够有效降低这些炎性因子,其中五味苦参中剂量组疗效最佳。
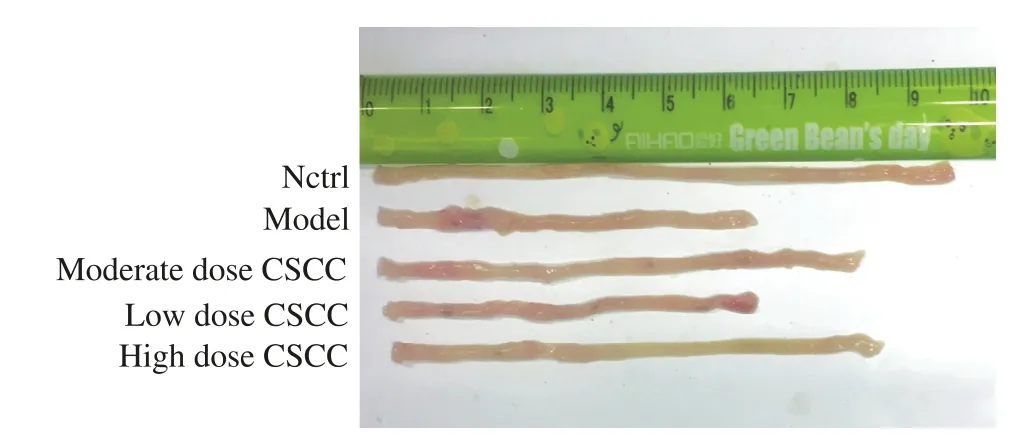
图1 各组UC模型小鼠五味苦参作用后结肠长度比较Fig. 1 Comparison of colonic length of mice with UC in each group
讨 论
中医学认为溃疡性结肠炎归属于“下痢”、“肠僻”等范畴。《医贯》云:“利为湿热甚于肠胃,怫郁而成,其冰皆热证也,俗以白痢为寒误也。”《诸病源候论》曰:“凡痢皆由荣卫不足,肠胃虚弱,冷热之气,乘虚入客于肠间,肠虚则泄,故为痢也。”中医认为本病多虚实夹杂、本虚标实,脾胃虚弱为本,肠道湿热蕴结为标,湿热与水谷相互搏结,耗气伤津,损伤肠络,下痢为血。因本病往往缠绵难愈,反复发作,日久气血亏虚,严重影响患者日常生活质量,甚至可发展为结肠癌[6]。
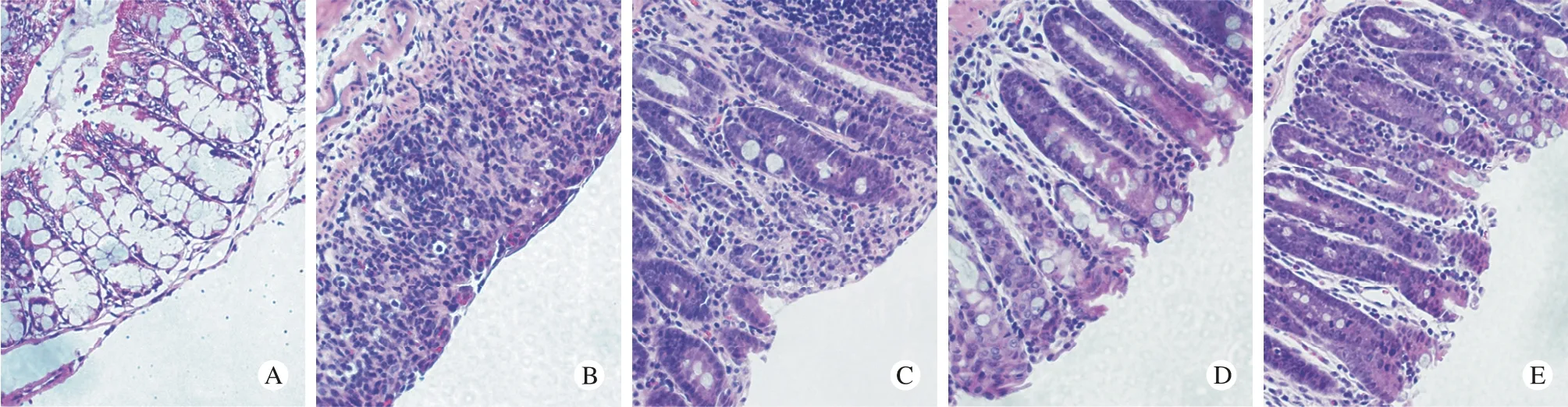
图2 各组小鼠结肠病理学观察(HE×400) A:空白对照组; B:模型对照组; C:五味苦参低剂量组; D:五味苦参中剂量组; E:五味苦参高剂量组)Fig. 2 Pathological changes of colon tissue in mice in each group (HE×400) A:Nctrl group; B:model group; C:low dose of CSCC group; D:moderate dose of CSCC group; E:high dose of CSCC group

表1 各组结肠组织检测指标比较Tab.1 Comparison of detecting indicators in colonic tissue in each group (-x±s)
本实验所用五味苦参肠溶胶囊由苦参、白芨、青黛、地愉、生甘草5味药组成,其中以苦参为君药,入大肠、心、膀胱经,可清热燥湿、止血止痢;地愉入大肠、肝经,可凉血止血、解毒敛疮,青黛与地愉同用,可增强其清热解毒、凉血止血之效,乃臣药;白芨有收敛止血、消肿生机之效,佐助君臣药;生甘草可调和诸药,清热解毒,并缓急镇痛。现代药理研究亦发现,苦参碱具有抗炎抑菌、抗肿瘤、免疫抑制等作用[7]。本实验结果显示,与空白组相比,模型组的结肠长度缩短,结肠系数降低,脾系数升高,Caspase-1和IL-1β蛋白表达增加,提示炎症反应的存在。而与模型组相比,五味苦参各组均有不同程度的改善。其中高剂量组疗效不是最佳,可能是因为浓度过高,而该组方中含白芨、青黛等生药,其性收敛,吸水性强,故混悬液太黏稠可能致结肠吸收效果不佳。
现代研究普遍认为肠道黏膜免疫异常是UC发病的关键因素[8],其中较热门的有固有淋巴细胞NLRP3炎性小体、T淋巴细胞等[9]。有学者认为成熟的IL-1β可诱导表达Th17细胞[10],Th17细胞是一种CD4+辅助T淋巴细胞,分泌IL-17、IL-6等促炎性因子,从而导致UC[11]。而Caspase-1是一种半胱氨酸天冬氨酸特异性蛋白水解酶,参与细胞凋亡、调控炎症反应。正常情况下,细胞质中存在无活性的Caspase-1,即pro-Caspase-1[12]。pro-Caspase-1可在激活的NLRP3(NACHT、LRR and PYD domains-containing protein 3)炎性小体作用下转为有活性的Caspase-1,而被激活的Caspase-1可将IL-1β、IL-18促炎性因子的前体等剪切加工成熟,从而介导UC[13-16]。也有研究提出,NLRP3炎性小体只在早期炎症反应中起作用,并不能阻止其病情的发展[17]。另有研究发现Caspase11与NLRP3炎性小体结合同样可分泌IL-1β、IL-18[18],但最新研究提示Caspase11只在急性炎症反应中起作用[19-20]。而有研究发现通过巨噬细胞THP-1炎性小体细胞模型筛选出的一种活性较好的小分子化合物Fclla-2,Fclla-2能够抑制NLRP3炎性小体释放IL-1β,其机制是通过抑制Caspase-1活化从而抑制NLRP3炎性小体介导IL-1β的释放[21]。由此可推测,被NLRP3炎性小体激活的Caspase-1可通过剪切加工成熟IL-1β,诱导表达Th17细胞,分泌IL-17、IL-6等促炎性因子,介导UC的发生。综上所述,五味苦参肠溶胶囊可能是通过下调Caspase-1表达,减少成熟IL-1β蛋白的含量,从而阻断Th17细胞诱导下游炎性细胞因子的释放,从而有效缓解UC症状,减轻炎症反应。故本实验组拟进一步研究五味苦参肠溶胶囊是否也能够下调NLRP3炎性小体,减少Th17细胞的表达。
1 Ordás I, Eckmann L, Talamini M, et al. Ulcerative colitis[J].Lancet, 2012, 380(9853): 1606-1619.
2 罗丹, 仝战旗. 中医药治疗溃疡性结肠炎的临床研究进展[J].医学综述, 2017, 23(2): 336-339.
3 Tong ZQ, Yang B, Chen BY, et al. A multi-center, randomized,single-blind, controlled clinical study on the efficacy of composite sophora colon-soluble capsules in treating ulcerative colitis[J].Chin J Integr Med, 2010, 16(6): 486-492.
4 广布加甫·藏登, 布图雅. 灌肠疗法研究中小鼠灌肠器的制作与应用[J]. 亚太传统医药, 2014, 10(6): 29-30.
5 樊星. 炎症模型在结肠炎治疗药药效学评价及何首乌毒性评价中的应用[D]. 北京: 中国人民解放军军事医学科学院, 2015.
6 陈新林, 张长荣, 王丹丹, 等. 溃疡性结肠炎证候分布的文献研究[J]. 中华中医药学刊, 2017, 35(2): 378-381.
7 陈晓峡, 向小庆, 叶红. 苦参碱及氧化苦参碱抗肿瘤作用的研究进展[J]. 中国实验方剂学杂志, 2013, 19(11): 361-364.
8 Elinav E, Henao-Mejia J, Flavell RA. Integrative inflammasome activity in the regulation of intestinal mucosal immune responses[J].Mucosal Immunol, 2013, 6(1): 4-13.
9 Aguilera M, Darby T, Melgar S. The complex role of inflammasomes in the pathogenesis of Inflammatory Bowel Diseases - lessons learned from experimental models[J]. Cytokine Growth Factor Rev, 2014,25(6): 715-730.
10 Lim MA, Lee J, Park JS, et al. Increased Th17 differentiation in aged mice is significantly associated with high IL-1β level and low IL-2 expression[J]. Exp Gerontol, 2014, 49 : 55-62.
11 Shaw MH, Kamada N, Kim YG, et al. Microbiota-induced IL-1β,but not IL-6, is critical for the development of steady-state TH17 cells in the intestine[J]. J Exp Med, 2012, 209(2): 251-258.
12 邬皓晨, 陈勇军, 徐易尘, 等. Caspase-1在炎症及程序性细胞死亡过程中的作用[J]. 中国细胞生物学学报, 2011, 33(2):182-189.
13 Masters SL. Specific inflammasomes in complex diseases[J]. Clin Immunol, 2013, 147(3): 223-228.
14 Márquez-Flores YK, Villegas I, Cárdeno A, et al. Apigenin supplementation protects the development of dextran sulfate sodiuminduced murine experimental colitis by inhibiting canonical and noncanonical inflammasome signaling pathways[J]. J Nutr Biochem,2016, 30 : 143-152.
15 Kersse K, Bertrand MJ, Lamkanfi M, et al. NOD-like receptors and the innate immune system: coping with danger, damage and death[J].Cytokine Growth Factor Rev, 2011, 22(5-6): 257-276.
16 Atianand MK, Rathinam VA, Fitzgerald KA. SnapShot:inflammasomes[J]. Cell, 2013, 153(1): 272.
17 Bauer C, Duewell P, Lehr HA, et al. Protective and aggravating effects of Nlrp3 inflammasome activation in IBD models: influence of genetic and environmental factors[J]. Dig Dis, 2012, 30(Suppl 1):82-90.
18 Broz P, Monack DM. Noncanonical inflammasomes: caspase-11 activation and effector mechanisms[J]. PLoS Pathog, 2013, 9(2):e1003144.
19 Oficjalska K, Raverdeau M, Aviello G, et al. Protective role for caspase-11 during acute experimental murine colitis[J]. J Immunol, 2015, 194(3): 1252-1260.
20 Williams TM, Leeth RA, Rothschild DE, et al. Caspase-11 attenuates gastrointestinal inflammation and experimental colitis pathogenesis[J]. Am J Physiol Gastrointest Liver Physiol, 2015,308(2): G139-G150.
21 Liu W, Guo W, Wu J, et al. A novel benzo[d]imidazole derivate prevents the development of dextran sulfate sodium-induced murine experimental colitis via inhibition of NLRP3 inflammasome[J].Biochem Pharmacol, 2013, 85(10): 1504-1512.

