不同保存条件对血中乙醇含量稳定性的影响
杨广丽 ,李小波 ,孙岩 ,邓嘉敏 ,杨丽玲 ,周湘君
(1、广东康怡司法鉴定中心,广东 东莞 523000;2、广东金域法医物证司法鉴定所,广东 广州 510000;3、东莞市第五人民医院,广东 东莞 523000;4、广东医科大学,广东 东莞 523000)
酒后驾车为交通事故的一大“杀手”[1-3],长期大量饮酒会造成心、脑、肝、肾、周围神经的损害,引起酒精中毒、出现幻觉、人格障碍等精神症状[4]。新《交通法》的实施使酒驾检测更日渐普遍[5,6],而最能反映是否酒驾的标准是血液乙醇含量,因此实验室检测的结果是否准确,关系到司法判定的正确性及公正性。由于乙醇具有很强的挥发性,血样检测应当越快越好。但在实际检案中,由于肇事现场的各种复杂因素导致样本送检被延误或保存不当,或样本存放一段时期后因案件需要须复检的,故对于样本的检测时机、保存方式以及复检时反复冻融等因素是否会引起乙醇含量改变而影响司法判定,笔者仍存在困惑。为保证检测结果的准确性,对样本中乙醇含量的稳定性研究是非常有必要的。由于样本的保存温度一直存在争议[7,8],而关于光照和解冻时间是否会影响乙醇含量稳定性目前尚未有文献报道,笔者意在通过检测不同保存方式(温度、时间、光照以及解冻时长)下乙醇的含量变化情况以确定影响其稳定性的因素,为样本的保存方式提供参考依据。
1 材料与方法
1.1 材料
1.1.1 空白溶液 空白血液。
1.1.2 叔丁醇内标溶液 精密称取叔丁醇2.5126g于500ml容量瓶中,用超纯水定容至刻度,摇匀,得叔丁醇内标储备液;精密量取叔丁醇内标储备液8.0ml于1000ml容量瓶中,用超纯水定容至刻度,摇匀,作为叔丁醇内标溶液。
1.1.3 对照品溶液 乙醇标准品(Cerilliant Corporation,浓度:10mg/100ml、20mg/100ml、50mg/100ml、80mg/100ml、100mg/100ml、200mg/100ml、300mg/100ml)。
1.1.4 供试品溶液 精密称取无水乙醇 0.2002g于250ml容量瓶中,用空白血液定容至刻度,摇匀,得80mg/100ml乙醇供试品溶液。
1.2 仪器与试剂
1.2.1 仪器 Agilent 7890A气相色谱仪,附 FID检测器 (安捷伦科技有限公司);Agilent 7694E自动顶空进样器(安捷伦科技有限公司);QL-500氢气发生器(山东赛克赛斯氢能源有限公司);AG系列空气发生器(济南格润实验仪器有限公司);Sartorius BS124S电子天平 (德国赛多利斯集团);PURELAB Ultra超纯水仪(威立雅水处理技术有限公司);硅橡胶垫 (安捷伦科技有限公司,批号:00230064);铝帽 (安捷伦科技有限公司,批号:0000970929)。
1.2.2 试剂 无水乙醇、叔丁醇 (色谱纯,纯度≥99.9%)购自天津市科密欧化学试剂有限公司;乙醇 标 准 品 (10mg/100ml、20mg/100ml、50mg/100ml、80mg/100ml、100mg/100ml、200mg/100ml、300mg/100ml)购自 Cerilliant Corporation;超纯水(18.2MΩ)由超纯水仪(PureSure纯水系统)制备。
1.3 方法
1.3.1 色谱条件 色谱柱 DB-624 (30m×0.32mm×1.8um 柱),柱温 40℃,进样口温度 150℃,检测器温度250℃,氮气流量25ml/min,氢气流量30ml/min,空气流量300ml/min。
1.3.2 顶空自动进样条件 顶空瓶预热温度70℃,定量环温度80℃,传输线温度90℃,循环时间1.0min,顶空瓶加热平衡时间 6.0min,顶空瓶加压时间 0.20min,定量圈定量时间 0.20min,定量圈平衡时间 0.05min,进样时间 1.00min。
1.3.3 专属性实验 分别精密移取叔丁醇内标溶液0.50ml于 3 个 10ml顶空进样瓶中,依次加入“1.1”项下空白溶液、80mg/100ml乙醇对照品溶液及供试品溶液0.10ml,加盖密封,按上述实验条件测定。
1.3.4 重复性实验 分别精密移取叔丁醇内标溶液0.50ml于6个10ml顶空进样瓶中,依次加入供试品溶液0.10ml,密封,按上述实验条件测定。
1.3.5 气密性实验 分别精密移取叔丁醇内标溶液0.50ml于60个10ml顶空进样瓶中,依次加入供试品溶液0.10ml,硅橡胶垫和铝帽密封,轻缓摇匀, 在室温的条件下分别放 置 0.0h、0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h、4.5h、5.0h、6.0h、7.0h、8.0h 和 9.0h 后再进样,每个时间点做 3 个平行样,监测其含量的变化情况。
1.3.6 光照实验 在室温条件下分别取供试品溶液5.0ml置于2个5ml的容量瓶中,分为光照组和避光组,同法操作,每隔2h顶空进样,每个时间点做3个平行样,记录8h之内乙醇含量的变化情况。
1.3.7 不同保存温度和保存时长实验 分别取供试品溶液1.0ml于90个1.5ml的离心管中,将这90个离心管随机分成3组,每组30个,分别在室温(24-28℃)、冷藏(4℃)和冷冻(-20℃)条件下保存30d,各组每天检测一个样本,每个样本做3个平行样,冷冻样本至少冷冻24h,且做样前要提前解冻,记录各样本含量的变化情况。
1.3.8 解冻时长实验 分别取供试品溶液 5.0ml置于6个5ml的容量瓶中,冷冻样本至少冷冻24h。记录样本在室温条件下自然解冻 0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h、4.5h、5.0h、6.0h、8.0h 和10.0h乙醇含量的变化情况,每个时间点做3个平行样。
1.4 统计学处理 采用SPSS 20.0统计软件进行重复测量方差分析和配对t检验,结果以均数±标准差表示,P<0.05 表示差别有统计学意义。多变量方差分析先进行Mauchly的球形度检验,若P<0.001,则采用Huynh-Feldt调整后的F值和P值。
2 结果
2.1 专属性实验 由图1可以看出,在上述条件下,各色谱峰分离度均达基线分离(R>1.5),且峰形尖锐美观,无杂峰干扰。根据中华人民共和国公共安全行业标准《生物样品血液、尿液中乙醇、甲醇、正丙醇、乙醛、丙酮、异丙酮和正丁醇的顶空-气相色谱检验法》(GA/T 1073-2013)[9]中规定,检材与校准样或控制样的保留时间偏差应小于2%。结果表明,该供试品溶液符合要求,由此可确定供试品溶液中含有乙醇成份,乙醇出峰时间为3.5min,叔丁醇出峰时间为5.1min。
2.2 重复性实验 按上述实验条件测定,结果表明,其RSD<2%,重复性良好。

图1 气相色谱图A.空白溶液;B.对照品溶液;C.供试品溶液
2.3 气密性实验 对室温的条件下放置9h内样本中乙醇含量变化情况进行单方向方差分析,如表1所示,各时间点测量值在统计学上无显著性差异(P>0.05),说明室温条件下硅橡胶垫和铝帽密封放置9h内气密性良好。

表1 气密性实验(mg/100ml)
2.4 光照实验 对8h之内光照组和避光组中乙醇含量变化情况进行配对t检验分析,结果如表2所示:8h之内光照与否对乙醇含量无影响 (均有P>0.05)。
2.5 不同保存温度和保存时长实验 对30d内室温组、冷藏组和冷冻组中乙醇含量变化情况进行统计分析,结果见表3。研究结果发现,①整体比较:Mauchly 的球形度检验 P<0.001, 拒绝球形假设,采用H-F调整P值(表3),结果提示不同保存时间点的乙醇含量变化很大,不同保存温度对乙醇含量也有影响,且时间和温度之间有交互作用(均有 P<0.001),其交互效应轮廓图见图 2。②不同时间点比较(组内):各温度组的不同时间点(1-30天)总体比较发现(表 3),冷冻组30d之内的P=0.25,无统计学差异,说明样本中乙醇在冷冻时保存稳定;而室温和冷藏下不同时间点有统计学差异(均有P<0.001)。将室温组和冷藏组的不同时间点与初始浓度(第1d)相比,发现室温组7d内乙醇含量稳定(均有 P>0.05),第 8d开始随时间呈下降趋势(均有 P<0.05),而冷藏组乙醇含量变化初期相对平缓(19d 内均有 P>0.05),第 20d 起乙醇含量也随时间呈下降趋势(均有 P<0.05)(图 2)。③不同保存温度比较(组间):各时间点的不同温度间(室温、冷藏、冷冻)相互比较结果显示(表3),各温度组7d内的P值均大于0.05,在统计学上无显著性差异,说明7d内温度对乙醇含量影响很小;而第8d起各温度组间均有P<0.05,有统计学差异,表示第8d后乙醇含量在不同保存温度下变化很大。将第8d后各温度组两两比较发现,8-19d内室温组含量明显低于另两组(均有 P<0.05),冷藏和冷冻含量无差别(P>0.05);20-27d 内含量室温组<冷藏组<冷冻(均有 P<0.05),28-30d 内室温组与冷藏组无差别(P>0.05),冷冻组含量仍然稳定。

表2 光照实验(mg/100ml)

图2 保存温度和时间交互效应轮廓图
2.6 解冻时长实验 对室温条件下自然解冻10.0h之内样本中乙醇含量变化情况进行单因素重复测量方差分析,如表4所示:冷冻状态下解冻0.5h时样本中可见冰块状,仍有部分溶液未完全解冻,其乙醇含量与同组最终浓度 (解冻10.0h)相比P<0.05,解冻1.0h时样本外壁仍可感觉到明显的冰冻感,冷冻4组-6组的乙醇含量与同组最终浓度(解冻 10.0h)相比 P<0.05,而解冻 1.5h 以后样本中未见冰块状且无冷冻感,各时间点间两两比较均有P>0.05,说明样本在解冻1.5h后乙醇含量相对稳定。
3 讨论
3.1 供试品浓度的选择 李萱等[10]认为当乙醇的初始浓度较高或较低时,对乙醇稳定性影响较大。而80mg/100ml的乙醇浓度是评判酒驾还是醉驾的标准[11,12],故为选择具有代表性的初始浓度且又减少初始浓度对其稳定性的影响,本次实验选择80mg/100ml乙醇供试品溶液作为样本。
3.2 气密性对乙醇含量的影响 乙醇具有挥发性,且易氧化反应生成乙醛[13,14],因此容器的气密性可能会引起乙醇含量变化。在实际工作中样本配制完后经常会存在因样本数量过多而不能立即检验的情况,故本文对此进行了考察,结果发现室温放置9h乙醇含量无变化,说明硅胶垫和铝帽在9h之内气密性良好。
3.3 光照对乙醇含量的影响 采血管一般为无色透明的玻璃管或塑料管,血液采集过程中或样本送检过程中避免不了会暴露在光照中,故光照也可能是影响因素之一。本实验结果显示8h之内有无光照对乙醇含量无影响,说明8h之内光照与否不是影响乙醇含量稳定性的因素。
3.4 不同保存温度和保存时长对乙醇含量的影响乙醇容易被微生物污染,在微生物作用下既可新生又可损耗乙醇[15-17],而微生物的生成受温度影响较大[18-20],故温度是影响样本乙醇含量稳定性因素之一。实验结果显示室温和冷藏条件下乙醇含量会随时间而变化,室温下7d内乙醇含量稳定,冷藏下19d内稳定,而冷冻条件下可稳定保存30d。有文献报道[21]冷藏样本存储14d后乙醇含量出现明显下降,与本文结果有所出入,考虑可能是由于本实验初便将同一样本分装成90份存放,各组每天检测一份样品,不存在反复开瓶冻融情况,从而避免了因开瓶冻融次数过多而导致乙醇含量降低的现象,检测结果更为全面和接近真实情况。
3.5 解冻时长对乙醇含量的影响 笔者在日常的司法检测过程中经常会存在样本需重新鉴定的现象,所以解冻时间的长短对样本检测结果也存在影响。研究表明冷冻样本解冻0.5h时与真实值偏相差较大,解冻1.0h时部分样本含量与真实值依旧相差较大,而解冻1.5h后乙醇含量接近真实值,考虑可能是1.0h内样本还没有完全解冻,乙醇分配不均匀所致。
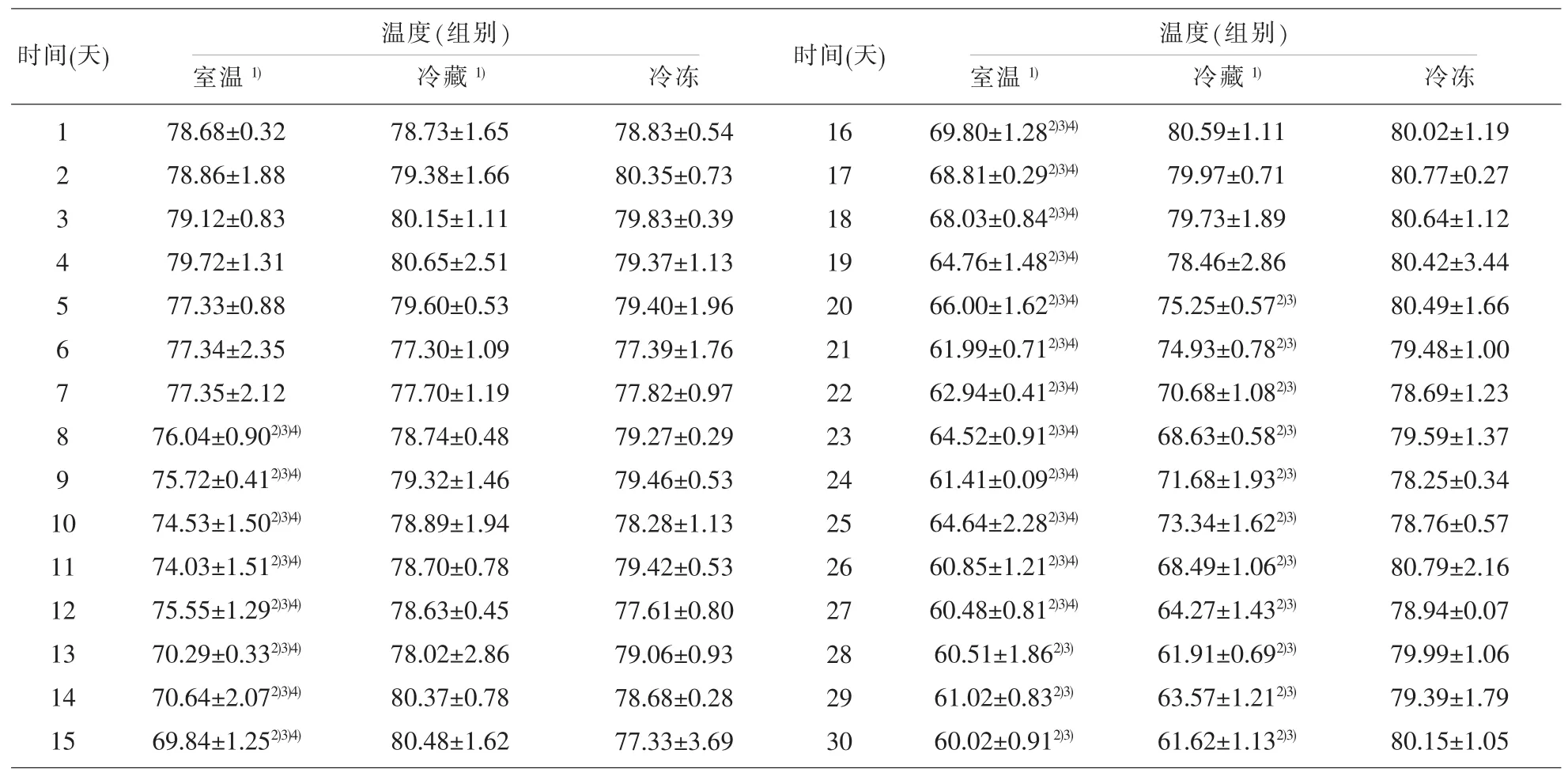
表3 不同保存条件对样本中乙醇浓度的影响(mg/100ml)
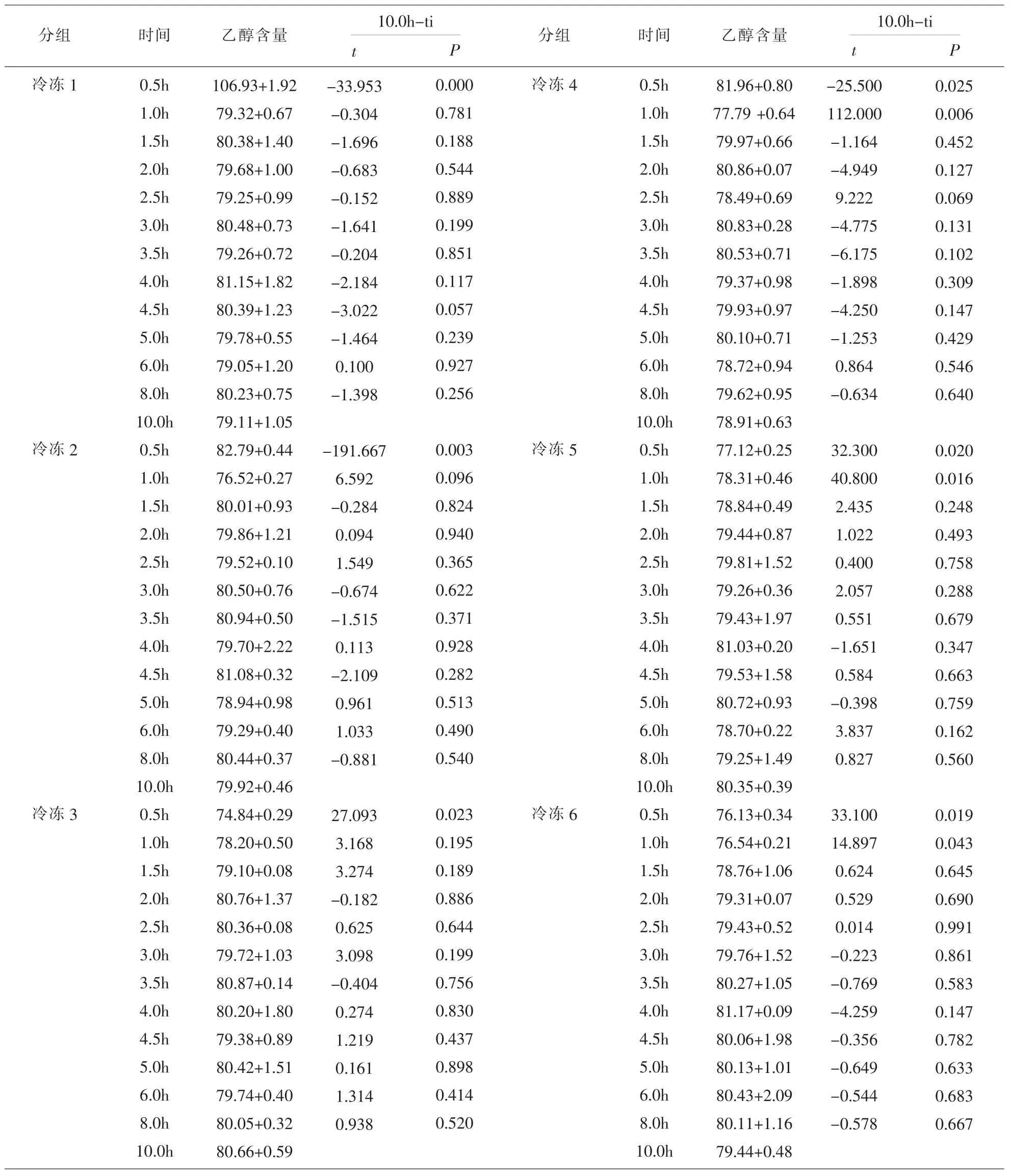
表4 冷冻样本(-20℃)在室温条件下解冻时长对乙醇含量的影响(mg/100ml)
本实验方法线性良好,校正曲线y=0.0464580x-0.00379693, 相关系数为 0.99998,线性范围(10-300)mg/100ml,检测限为 0.51mg/100ml,定量限为1.45mg/100ml,精密度和重复性实验的RSD均小于2%,为本次实验的进行奠定了良好的基础,使检测结果更为科学。通过在不同的保存温度、保存时长、有无光照以及不同解冻时长下检测乙醇的含量变化情况,发现保存温度、保存时长和解冻时长对乙醇含量影响较大。7d内样本均可保存在室温、冷藏和冷冻条件中,19d之内可保存在冷藏和冷冻条件中,而30d之内最佳的保存条件是冷冻,冷冻后的样本最短解冻时长为1.5h。
[1]刘文龙,郭翊炀,江龙,李常明,陈文斌,王建武.2011-2014年湖南省长沙市长沙县酒后驾驶交通事故的流行病学调查[J].中国健康教育,2016,32(9):811-814.
[2]颜小銮.江苏省酒后驾驶现况调查及影响因素研究[D].东南大学,2015.
[3]顾云.关于酒驾以及其检测手段[A].中国法医学会法医临床专业委员会.中国法医学会·全国第十七届法医临床学学术研讨会论文集[C].中国法医学会法医临床专业委员会:,2014:2.
[4]沈晔,黄卫权.酒精依赖患者血液流变学的变化[J].实验与检验医学,2011,29(3):303.
[5]中华人民共和国道路交通安全法 [N].人民日报,2011-08-06(006).
[6]关于检查《中华人民共和国道路交通安全法》实施情况的报告(节选)[J].中国应急管理,2017,(1):68-70.
[7]马栋,卓先义,卜俊,向平,沈保华.血液中乙醇保存稳定性研究[J].法医学杂志,2007,(2):117-119.
[8]刘晓霞.乙醇在犬体内的死后再分布及保存人血液中稳定性的研究[D].山西医科大学,2007.
[9]GA/T 1073-2013,生物样品血液、尿液中乙醇、甲醇、正丙醇、乙醛、丙酮、异丙酮和正丁醇的顶空-气相色谱检验法[S].
[10]李萱,孟祥志.不同保存方法对血液样本中乙醇浓度的影响[J].数理医药学杂志,2013,26(5):554-556.
[11]黄勇.酒驾和醉驾酒精含量判断标准[A].中国法医学会法医临床专业委员会.法医临床学专业理论与实践——中国法医学会·全国第十八届法医临床学学术研讨会论文集 [C].中国法医学会法医临床专业委员会:,2015:1.
[12]GB19522-2010.车辆驾驶人员血液、呼气酒精含量阈值与检验[S].
[13]王阳.金—铜双金属催化剂催化乙醇氧化脱氢制乙醛的研究[D].大连理工大学,2016.
[14]钟俭鸿,殷瑜,陈代杰.乙醇诱导对鼠李糖乳杆菌HCCB 20591代谢乙醛的影响[J].生物技术通报,2017,33(7):133-137.
[15]卓先义,卜俊,向平,沈保华,陈聪.血液中乙醇检测结果的法医学分析[J].中国司法鉴定,2010,(1):22-25.
[16]孙蓉.一株硫代双乙醇降解菌遗传学特征及降解性能的研究[D].云南大学,2012.
[17]万思诺(Cristiano Varrone).微生物混合菌群促进粗甘油生物转化同步产氢产乙醇工艺[D].哈尔滨工业大学,2015.
[18]黄光照.法医毒理学[M].北京:人民卫生出版社,2004,109-115.
[19]吴静.有机物料、氮肥添加及温度对土壤微生物呼吸的影响[D].南京信息工程大学,2016.
[20]范分良,黄平容,唐勇军,李兆君,梁永超.微生物群落对土壤微生物呼吸速率及其温度敏感性的影响 [J].环境科学,2012,33(3):932-937.
[21]杜娟.血液中乙醇含量检测结果的影响因素及质量控制研究[D].南方医科大学,2015.

