蛋白芯片法与化学发光法在检测消化道肿瘤标志物的相关性分析
马永能,彭秀娟,杨自力,刘姗,任皓月,曾华军,陈娟娟,刘国雄
(绵阳市第三人民医院(四川省精神卫生中心)检验科,四川 绵阳 621000)
肿瘤标志物是指在肿瘤发生和增殖过程中异常升高的能反映肿瘤存在的化学类物质。肿瘤标志物在正常人含量很低,当肿瘤发生时其在血液中的浓度明显升高。由于单个肿瘤标志物对相关疾病的诊断灵敏度和特异性的问题,采用多肿瘤标志物联合检测能提高检测的灵敏度和特异性,减少漏诊和误诊[1-3]。目前蛋白芯片法由于其具有多指标联合检测的优点,被广泛应用于肿瘤高危人群的筛查、肿瘤病人术后的复发评估中。蛋白芯片法是基于蛋白质微阵列技术与化学发光免疫分析法联合检测人血清中的多种肿瘤标志物,如CA19-9、CA125、T-PSA、F-PSA、NSE、AFP、CEA、CA724、Cyfra21-1、PG I、PG II、pro-GRP 等 12 种肿瘤标志物。能对常见的肿瘤(肝癌、肺癌、胃癌、食管癌、胰腺癌、结直肠癌、黑色素瘤、前列腺癌等)进行临床辅助诊断及治疗效果的预后监测。
消化道肿瘤是常见的恶性肿瘤之一,其相关标志物 CA19-9、AFP、CEA、CA724 被广泛关注[4-6]。本文拟采用蛋白芯片和本实验室应用成熟的化学发光法对其进行检测,评价蛋白芯片多肿瘤标志物检测法与本实验室已开展成熟的的贝克曼化学发光仪和罗氏电化学发光法在单一消化道肿瘤标志物检测上的可比性。
1 资料与方法
1.1 试验对象 正常对照组:选择健康体检者,该组人群无明确的肿瘤病史和其他常见慢性疾病史,相关常规体检和实验室检测结果均在正常范围内。良性疾病对照组:选择的血清样本来源于患有除恶性肿瘤外的其他消化道疾病的住院病人。这些良性疾病包括肝炎、肝硬化、胃溃疡、萎缩性胃炎、肠炎等。因为炎症的存在,该组患者的血清样本可能会出现单一检测结果阳性。恶性肿瘤组:该组是临床已确诊的恶性肿瘤患者,包括:食道癌、肝癌、胃癌、结直肠癌消等化道肿瘤患者。
1.2 样本的采集与保存 采集受试者血液3~5ml,3500r/min,离心10min分离血清,每份血清体积不小于500μl。溶血样本和黄疸血样本不宜检测。尽量采用新鲜血清,若样本当天不检测而在一周内检测,则应放置在2~8℃保存;检测前样品应与室温平衡。
1.3 样本的排除标准和数据剔除标准 溶血、高胆红素、高血脂或黄疸血的样本;类风湿因子阳性的样本。
1.4 试剂和方法 蛋白芯片法试剂:江苏三联生物工程有限公司生产的SLXP-001型全自动生物芯片阅读仪及配套的蛋白芯片试剂盒。标准方法试剂及仪器:⑴罗氏诊断产品有限公司生产的肿瘤标志物定量检测试剂盒:CA724试剂及其定标品,仪器为Roche电化学发光全自动免疫分析仪Cobas e 411;⑵贝克曼有限公司生产的肿瘤标志物定量检测试剂盒(CA19-9、AFP、CEA等)及其定标品,仪器采用DXI800全自动化学发光免疫分析仪。以上操作均按相关实验技术产品说明书和本实验室操作规程进行。室内质量控制 (精密度控制)采用伯乐第三方质控品,按照质量管理体系控制室内质量控制;参加卫生部室间质量评价评价各检测项目的准确性。
1.5 统计学方法
1.5.1 定性结果的一致性分析 对检测结果的阴阳性判断,对照方法(考核试剂盒)采用的试剂盒以“男芯”试剂盒提供的参考数值为判断依据,标准方法(参比试剂盒)采用的试剂盒则以厂家提供的单指标检测设定的参考值(Cut off)作为判断依据,详见表1。

表1 肿瘤标志物检测的阴阳性判断截域参考值(Cutoff)
1.5.2 统计单个指标的阳性检出率,阳性一致率、阴性一致率、总符合率。以四格表的形式总结两种试剂的定性检测结果并对结果进行四格表的kappa检验以验证两种试剂定性结果的一致性。
1.5.3 建立回归方程并分析 用回归分析验证两种试剂结果的相关性,以y=a+bx和R2的形式给出回归分析的拟合方程,其中:y是对照方法的试剂检测结果,x是标准方法的试剂检测结果,b是方程斜率,a是y轴截距,R2是判定系数,同时应给出b的95%置信区间,定量值结果应无明显统计学差异。
2 结果
2.1 两种试剂盒测定结果 分别用对照试剂(蛋白芯片)与标准试剂(贝克曼/罗氏)对血清样本进行消 化 道 常 见 肿 瘤 标 志 物 (CA19-9、AFP、CEA、CA724)测定,它们的检测结果如表2所示:

表2 样本类型分组测定结果
恶性肿瘤组消化道癌(包括食道癌、结肠癌、直肠癌、胰腺癌、贲门癌、胃癌)、肝癌以及其它癌症等。相关良性疾病组消化道器官疾病,包括肠梗阻、肠息肉、肠瘘、肠炎、胃炎等。
2.2 两种方法检测常见肿瘤的阳性率 两种试剂盒检测常见肿瘤的阳性率见表3。

表3 肿瘤组中常见肿瘤的阳性率
2.3 两种方法测定值常见肿瘤的阳性率定性判定结果统计分析表 4a,b,c,d。
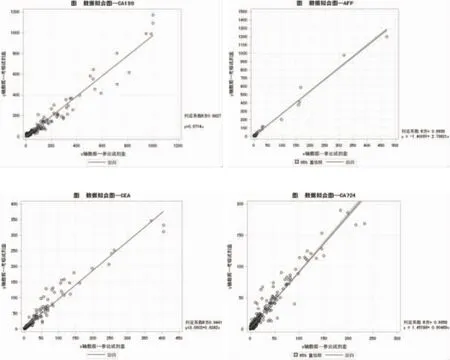
2.4 以对照方法(考核试剂)作Y轴,标准方法(参比试剂)作X轴,作散布图如下。从相关系数r和散点图的统计结果可看出,两种产品的相关性较好。

表4a两种方法定性判定结果统计-CA19-9
表4b两种方法定性判定结果统计-AFP

表4c两种方法定性判定结果统计-CEA

表4d两种方法定性判定结果统计-CA724
4 讨论
肿瘤标志物检测已成为继影像学和病理学诊断之后临床最常用的肿瘤诊断方法,在肿瘤普查、诊断、判断预后和转归以及评价疗效等方面具有较高的实用价值。
采用放射免疫分析或化学发光免疫分析系统检测血清中的肿瘤标志物,是高危人群筛查、肿瘤病人治疗或预后评估的常用的检测手段。近年来采用的蛋白芯片联合检测多种肿瘤标志物,具有样本用量少[7],检测通量大的优点,在高危人群的筛查中越来越受到关注。
蛋白芯片法的检测原理是利用抗原抗体特异性结合后在固相基质上结合肿瘤标志物的抗体,捕获被检血清中对应的肿瘤标志物,再通过特定的化学反应产生光信号,检测光信号从而检测血清中的肿瘤标志物[8],具有微型化、高速度、高通量、高灵敏度等特点,其对肿瘤的早期诊断和预后监测具有辅助作用[9]。尽管蛋白芯片检测有诸多优点,但蛋白芯片的应用也有一定争议,有研究者表示其与单个血清肿瘤标志物比较存在一定的假阳性[10],分析其可能的原因可能是不同的抗体反应需要的时间是不一样的,而蛋白芯片法将多种抗体置于同一基质片采用相同的时间反应,会带来结果的影响[11]。
肿瘤标志物检测是诊断消化道恶性肿瘤的重要参考依据,对于消化道肿瘤的诊治和预后判断具有重大意义[12],研究者们对肿瘤标志物在消化道肿瘤标志物检测中广泛关注[13]。然而单独检测肿瘤标志物具有一定局限性,本研究目的是探讨多种肿瘤标志物联合检测对胃消化道肿瘤的早期诊断价值和两个检测系统的可比性。对CEA的研究表明CEA在多种肿瘤患者血清中都可表现为升高,尤其是胃肠道肿瘤,并且较高血清CEA水平的胃癌有较高的转移率[14-17]。CA724是目前公认较好的胃癌相关肿瘤标志物[18],研究显示CA724可作为胃癌转移的一项敏感肿瘤标志物[19]。CA199属于血液循环的胃肠道肿瘤相关抗原[20],在残胃癌、无法手术切除的患者中阳性率为64.9%[21],联合检测有利于提高疾病诊断敏感性和特异性。本实验中我们对不同人群(包括恶性肿瘤组、良性疾病组和正常人群)的血清标本采用蛋白芯片法和传统的贝克曼化学发光法和罗氏电化学发光法单指标肿瘤标志物测定的结果作比较,探讨蛋白芯片法在本实验室应用的可行性。研究结果显示对照试剂(蛋白芯片)与标准试剂(贝克曼/罗氏)对血清样本进行消化道常见肿瘤标志物 CA19-9、AFP、CEA、CA724测定具有高度的一致性性:CA19-9符合率93.55% ;AFP 符 合 率 99.04% ;CA724 符 合 率95.50%;CEA 符合率 100.00%。
本临床研究中仅很少数样本检测结果存在差异。在本次实验中,我们对两种方法测值存在差异的样本进行了重复实验,复测结果与原值部分不相符,对不符合的样本进行分析发现测定值在参考值范围的上限或下限附近,存在“灰区”效应。因两种方法正常值范围不尽相同,而且可能存在人群、地区等的差异。
综上所述,蛋白芯片法联合检测CA19-9、AFP、CEA、CA724与化学发光法检测单个肿瘤标志物具有高度一致性,蛋白芯片法可用于消化道肿瘤标志物的联合检测,为临床在消化道疾病的治疗和预后上采取准确的治疗措施提供重要数据。
[1]陈海燕.CA724、CEA、CA242、CA199肿瘤标志物联合检验在胃癌中的诊断价值[J].中国医药导报,2012,9(31):97-98.
[2]王瑶,高文,肖峰.CEA、CYFRA21-1、NSE 联合检测在肺癌诊断中的临床价值研究[J].实用临床医药杂志,2011,15(9):135-136.
[3]何思春,庞红全,焦鑫,等.胃液肿瘤标志物CEA、CA199及CA724在胃癌诊断中的意义 [J].国际检验医学杂志,2011,32(8):857-858.
[4]Zhang PY,Zhu MJ,Wang JD,et al.Xanthogranulomatous cholecystitis:a clinicopathological study of its association with gallbladder carcinoma[J].J Dig Dis,2013,14:45-50.
[5]Zou L,Qian J.Decline of serum CA724 as a probable predictive factor for tumor response during chemotherapy of advanced gastric carcinoma[J].Chin J Cancer Res,2014:404-9.
[6]Chen XZ1,Zhang WK,Yang K,et al.Correlation between serum CA724 and gastric cancer:multiple analyses based on Chinese population[J].Mol Biol Rep,2012,39(9):9031-9.
[7]Uzoma I,Zhu H.Interactome mapping: using protein microarray technology to reconstruct diverse protein networks[J].Genomics Proteomics Bioinformatics,2013,11(1):18-28.
[8]张亚南,冀杨,贾楠,等.多肿瘤标志物蛋白芯片检测系统在消化系统疾病的应用评价 [J].中国实验诊断学,2011,15 (3):500-503.
[9]孙旭东,王含章.膀胱肿瘤标志物检测方法的研究进展[J].现代泌尿外科杂志,2012,17(3):319-321.
[10]龚倩,王金金.多肿瘤标志物蛋白芯片技术在健康体检人群防癌普查中的应用评价[J].免疫学杂志,2012,28(10):896-900.
[11]娄加陶,顾军,高春芳,等.蛋白芯片检测肿瘤标志物及其与其他方法的比较[J].检验医学,2009,24(6):466-469.
[12]李金明.肿瘤标记的临床应用及思考[J/CD].中华临床医师杂志:电子版,2009,3(8):1272-1273.
[13]陶晓军,冯晓鸿,孙业富.CA72-4、CA19-9、CA50、CA242 联合检测在胃癌诊断中的应用 [J].实验与检验医学,2012,30(2):169-171.
[14]Kim DY,Kim HR,Shim JH,et al.Significance of serum and tissue carcinoembryonic antigen for the prognosis of gastric carcinoma patients[J].J Surg Oncol,2000,74(3):185-192.
[15]Koga R,Yamamoto J,Ohyama S,et al.I iver resection for metastatic gastric Cancer:experience with 42 patients including eight long term survivors[J].Jpn J Clin Oncol,2007,37(11):836-842.
[16]Tiberio GA,Coniglio A,Marchet A,et al.Metaehronous hepatic metastases from gastric carcinoma:a multicentric survey[J].Eur J Surg Oncol,2009,35(5):486-491.
[17]Kim DY,Kim HR,Shim JH,et al.Singnigicance of gastric carci-noma patients[J].J Surg Oncol,2000,74(3):185-192.
[18]范凝芳,田学智,陈健,等.多肿瘤标志物对早期胃癌诊断及与进展期胃癌鉴别诊断中的价值 [J].中国医疗前沿,2012,7(16):63-64.
[19]刘洵祺,袁霞.胃癌复发转移相关的血清肿瘤标志物研究进展[J].现代肿瘤医学,2012,20(10):2191-2194.
[20]王洋,王欢,莫佳美,等.血清肿瘤标志物在胃癌诊断中的价值[J].现代肿瘤医学,2014,22(4):883-885.
[21]Marrelli D,Roviello E,de Stefano A,et al.Prognostic significance of CEA,CA199,and CA724 preoperative serum levels in gastric carcinoma[J].Oncology,1999,57(11):55-62.

