结直肠癌肝转移患者动态CT增强扫描影像学表现
姜海涛,张彦梅,范 璐
结直肠癌是全球常见的恶性肿瘤之一,近年来其发病率呈逐渐上升趋势[1,2]。由于肠系膜静脉血流回流入肝,超过一半结直肠癌患者会发生肝转移,这也是导致患者死亡的主要原因[3,4]。掌握肝转移瘤的增强CT表现特征,及早发现肝内转移灶,为患者的早期治疗赢得时间,提高总体生存率。
1 资料与方法
1.1 一般资料 2011年1月~2016年12月在我院行CT增强扫描检查的结直肠癌肝转移患者94例,男65例,女29例;年龄15~76岁,平均年龄(52.2±11.3)岁。经术后组织病理学检查诊断原发病灶为结直肠癌和肝转移癌。发现转移灶距离发现原发病灶时间为0~13年,平均(2.6±0.7)年。排除除肝转移外全身多处转移者。
1.2 检查方法 使用Philips Brilliance Ict 256型螺旋CT机进行三期增强扫描。在充分准备后,患者仰卧于检查床,先行常规轴位平扫。然后,于左肘正中静脉团注对比剂碘海醇(速率4.0 ml/s,总剂量为90 ml),行动态三期增强扫描。扫描范围:膈顶至盆底。扫描参数:电压120 kv,电流250 mAs,扫描层厚5mm,扫描视野14~16cm。分别在注射对比剂后30 s(动脉期)、60s(静脉期)和 120 s(平衡期)行全肝扫描。放射科医师挑选患者第一次发现肝转移灶的图像进行分析。医师均在未知患者原发病灶的情况下记录肝转移瘤的位置、数目、影像学特征、以及肠系膜下静脉(IMV)汇入门静脉的解剖位置。自下腔静脉左缘至胆囊窝中点的正中裂,将肝脏分为左叶和右叶,以脾曲为界将结肠分为左侧结肠和右侧结肠。
1.3 统计学处理 应用SPSS 15.0统计软件进行数据分析,计数资料以率或构成比(%)表示,两组之间比较采用x2检验,P<0.05表示具有统计学差异。
2 结果
2.1 结直肠癌原发病灶分布和IMV解剖位置情况 原发病灶位于右侧结肠者33例,包括盲肠癌3例,升结肠癌22例,横结肠癌8例;原发病灶位于左侧结肠者61例,包括降结肠癌7例,乙状结肠癌34例,直肠癌20例。CT三维重建图像显示,IMV汇入脾静脉(SpV)者26例,汇入肠系膜上静脉(SMV)者31例,汇入SpV与SMV汇合处者4例。
2.2 结直肠癌肝内转移灶CT影像学表现特征 在94例患者中发现肝内转移病灶389个,其中肝内单发转移灶18例(19.1%),多发转移灶76例(80.9%);CT平扫表现为低密度灶324个(图1A),等密度灶9个,高密度灶56个,多数边缘较清晰。增强后显示,动脉期瘤体无明显强化(图1B)。边缘环形强化灶224个(57.6%,图1C),结节状强化灶122个(31.4%),其他病灶内不规则强化43个(11.1%)。检出病灶最多的时相是静脉期,检出率为94.2%。CT诊断正确的病灶360个,总体诊断正确率为92.3%。
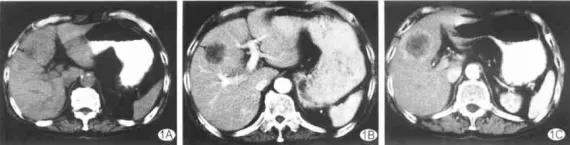
图1 结直肠癌肝转移灶CT平扫和增强扫描表现
1A:CT平扫显示肝右叶前段一圆形低密度灶;1B:CT增强扫描显示动脉期瘤灶无明显强化;1C:CT增强扫描显示静脉期瘤灶周围呈环形强化
2.3 结直肠癌肝内转移灶分布特征 左右结肠癌肝内转移灶分布具有统计学差异(P<0.01,表1)。

表1 左右结肠癌肝内转移灶分布(%)比较
2 讨论
目前,螺旋CT已常规用于肿瘤的筛查和随访。虽然对于1 cm以下的病灶其检测能力有限,敏感性不如磁共振成像(MRI)[5,7],但它可以快速提供患者胸腔、腹腔、盆腔的影像学资料,且容易开展,成本相对较低[8]。随着结肠癌侵犯病灶周边血管,癌细胞进入各级小静脉后经肠系膜静脉、门静脉系统入肝,而肝脏接受肝动脉和门静脉双重供血,营养丰富,为癌细胞的生长提供了良好的环境[9]。
CT平扫显示,结肠癌肝转移病灶表现为高、等、低密度灶,以低密度灶为主,大多数病灶边界清楚。CT动态增强扫描后病灶表现为边缘环形强化灶、结节性强化灶和其他不规则强化灶。边缘环形强化灶所占比例超过一半可能与瘤体边缘主要由门静脉供血有关[10],结节性病灶可表现为普通型、血管瘤样型和囊肿样型等多种形式。典型的结肠癌肝转移瘤通过CT增强表现特征容易得出初步诊断,但对于微小病灶和CT增强表现不典型病例诊断较为困难,仍需结合病史和其他检查进一步确诊。整个CT动态三期增强中,门静脉期肝转移瘤检出率最高,这是由于结肠癌肝转移瘤多为少血供,静脉期大量对比剂到达肝脏,肝实质显著增强,转移瘤病灶相对呈现低密度影而易于被检出[11]。
本研究显示,原发病灶位于右侧结肠者,其肝内转移灶主要分布于肝右叶,而原发病灶位于左侧结肠者,其肝内转移病灶在肝左、右叶分布无明显差异。有研究认为这主要与门静脉血流回流特点有关[12,13],右侧结肠主要由SMV支配,SMV血流大多沿门静脉右侧进入肝右叶,因此右侧结肠癌转移灶随血流进入肝右叶的几率大大增加。左侧结肠主要由IMV支配,IMV汇入门静脉的解剖位置有三种[14],即汇入SMV、
汇入SpV、和汇入SpV与SMV汇合处。当IMV汇入SMV时,左侧结肠癌细胞易随着SMV血流汇入肝右叶;当IMV汇入SpV时,左侧结肠癌细胞易随着SpV血流汇入肝右叶;当IMV汇入SMV与SpV交汇处时,左侧结肠癌细胞随着血流在门静脉混合随机进入肝脏。本研究结果也证实了这一规律:即IMV汇入SMV者,转移瘤病灶主要位于肝右叶,IMV汇入SpV者,转移瘤病灶主要位于肝左叶,IMV汇入SMV与SpV交汇者,转移瘤病灶被随机分布于肝左、右叶。
[1]王新团,耿智敏,王华.一期切除结直肠癌并发肝转移癌的临床应用. 实用肝脏病杂志,2015,18(4):422-423.
[2]胡怡然,赵会玲,张红雁,等.合肥市社区居民结直肠癌筛查及其患病危险因素分析.中华全科医学,2017,5(2):282-285.
[3]Han CW,Shin AS,Lee JH,et al.Dietary calcium intake and the risk of colorectal cancer:a case control study.BMC Cancer,2015,15(1):1-11.
[4]Kuo IM,Huang SF,Chiang JM,etal.Clinicalfeaturesand prognosis in hepatectomy for colorectal cancer with centrally located liver metastasis.World J Surg Oncol,2015,13(1):1-12.
[5]刘婷,腾飞,王冠,等.结直肠癌肝转移瘤的CT动态增强强化特点及病灶分布规律.放射学实践,2016,31(5):407-410.
[6]钟芸诗,曾蒙苏,许剑民.结直肠癌肝转移行肝转移灶切除术前影像学评估. 中国实用外科杂志,2013,33(8):650-653.
[7]贾彦斌,王书行,李杨,等.CT灌注成像评价结直肠癌肝转移瘤肝动脉栓塞化疗前后临床应用研究.河北医学,2016,22(10):1649-1652.
[8]Wicherts DA,de Haas RJ,vanKessel CS,et al.Incremental value of arterial and equilibrium phase compared to hepatic venousphase CT in the preoperative of colorectal liver metastases:an evaluation with different reference standards.Eur J Radiol,2011,77(2):305-311.
[9]王屹.结直肠癌肝转移影像学评估及意义.中国实用外科杂志,2016,36(4):391-396.
[10]贾彦斌,王书行,齐晓辉,等.双源CT灌注成像在肝转移瘤TACE前后的临床应用研究.河北医科大学学报,2016,37(4):427-430.
[11]郑志勇.结肠癌多发肝转移肝动脉介入治疗研究.中国医药导报,2013,10(1):67-68,75.
[12]姬军军,王兴华,康卫华.乏血供肝转移瘤超声造影与CT增强扫描的对比研究.中国中西医结合影像学杂志,2012,10(2):120-122.
[13]Konopke R,Distler M,Ludwig S,et al.Location of liver metastases reflects the site of the primary colorectal carcinoma.Scand J Gastroenterol,2008,43(2):192-195.
[14]李金平,王彦民,李大庆,等.不同部位结直肠癌肝转移瘤肝内分布规律分析.中华结直肠疾病电子杂志,2015,4(3):69-73.

