盐胁迫对葡萄苗期多胺和激素代谢的影响
孙琳琳,郁松林,赵丰云,杨 湘,杨 夕
(石河子大学农学院,新疆石河子 832003)
0 引 言
【研究意义】通过对一年生葡萄苗期进行盐胁迫处理,研究盐胁迫条件下葡萄叶片中多胺含量、多胺氧化酶活性、多胺脱羧酶活性以及激素含量变化规律,为研究多胺和激素如何响应盐胁迫提供试验依据,从不同角度探索葡萄的耐盐机制。同时为在葡萄生产上合理使用外源多胺类调节物质来缓解盐胁迫的危害性提供依据。【前人研究进展】在葡萄栽培发展过程中,盐害是制约其生长发育的重要环境因素,当土壤含盐量达到0.3%时,植株生长会受到抑制,土壤含盐量在0.5%以上时,会发生植株死亡,产量降低等现象[1]。在胁迫下,多胺和激素类物质对植物逆境调节都表现着积极的作用。多胺(polyamines,PAs)是生物体代谢过程中一类具有生物活性的低分子量脂肪族含氮碱[2],主要由腐胺(putrescine,Put)、精胺(spermine,Spm)和亚精胺(spermidine,Spd)组成。多胺的多聚阳离子特性,能促进植物的生长发育,作为信号物质参与植物调节,延缓植物衰老以及提高植物抗逆性等从而得到学术界的普遍关注。近年来,我国在植物抗逆性生理研究中也开始不断的注意到逆境胁迫后发生的多胺代谢规律[3],当植物遭受到盐胁迫、水分胁迫、低温胁迫、离子胁迫等各种逆境时,多胺合成酶活性会有大幅度增加,植物体内将积累大量多胺类物质,多胺含量和形态迅速变化,来调节细胞内离子平衡,清除活性氧,稳定膜系统以及蛋白质的构象等,从而增强植物逆境抵抗能力[4]。植物激素也是一类可以调节植物生长和代谢,又可以调节生物逆境和非生物逆境的化合物。植物激素是由植物体内多种重要代谢途径中衍生出来的,极低的含量便可以调节植物生长和发育,提高植物体对胁迫的抗性[5]。其中脱落酸(abscisic acid,ABA)和细胞分裂素(cytokinin,CTK)是被人们认知植物感知逆境的重要信息物质,在逆境中起着重要作用[6]。【本研究切入点】前人在盐胁迫对植物形态特征、对营养器官细胞质膜透性、保护酶活性以及叶片光合作用特性的影响等方面作了探讨,而对多胺及内源激素代谢的影响及其生理生化效应的研究较少。激素和多胺类物质在植物体正常生长发育中起着重要调节作用。研究激素及多胺代谢规律对逆境胁迫的影响。【拟解决的关键问题】不同盐胁迫条件下,通过葡萄叶片中多胺含量、多胺氧化酶、多胺合成酶活性以及激素的动态变化,研究葡萄叶片中多胺和激素代谢变化规律。
1 材料与方法
1.1 材 料
供试材料为一年生维多利亚(VitisviniferaL.Victoria)葡萄扦插营养袋苗,所用苗木生长量基本一致。栽培于石河子大学农学院试验站的日光温室中(45°19′ N,86°03′ E)。温室内相对湿度75%~80%,昼夜时长15 h / 9 h,昼夜温度25℃/ 18℃。
1.2 方 法
1.2.1 试验设计
试验采用盆栽基质培养。于2017年5月19日选取长势一致的维多利亚当年生扦插营养袋苗移进温室,缓苗适应培养5 d后移入桶装容器(上口径28 cm,底面直径19 cm,高25 cm)中。基质配比为珍珠岩∶蛭石以3∶7混合,所用基质先用清水冲洗干净,含盐量为0。将基质晾干,称重确定每桶基质重量一致,栽2株幼苗,先用清水浇灌,待长出新叶后,用1/2 Hoagland改良营养液浇灌,称重记录浇灌营养液后的重量。之后每隔3 d通过称重来确定浇灌营养液的体积, 每桶重量保持一致,浇灌的原则秉持少量多次,其他按常规管理。待葡萄幼苗长到10~13片叶片的时候,选择生长健壮生长量一致的植株作为试验材料。设置4个NaCl处理梯度:0 (CK)、1 (处理1, T1)、2 (处理2, T2)和3 g/kg (处理3, T3)。为避免植物盐激反应,每盆中浇灌的NaCl溶液分三次等量均匀浇入,每次间隔3 d,全部处理于同一天同一时间达到目标浓度(设此时为NaCl处理的0 d),于最后一次处理后第0、5、10、15、20 d选取葡萄自上而下的第3~6片功能叶进行植株相关指标的测定,每个指标测定3次重复。
1.2.2 测定指标
多胺含量的测定参照白泽晨等[7]的高效液相色谱法,其中多胺(PA)总量=Put+Spm+spd;ADC、ODC和SAMDC酶活性测定参照赵福庚[8]紫外分光光度计比色的方法上略加改动,单位以nmol/(g·h)来表示;PAO、DAO酶活性在汪天等[9]的比色法上略加改动进行测定,结果以“U/g”来表示。植物激素含量的测定参照张占畅等[10]的高效液相色谱法测定。
1.3 数据处理
试验数据用 SPSS 19 进行处理及分析,多重比较采用 Duncan’s新复极差法。用Microsoft Excel进行数据处理,作图软件使用Origin9。
2 结果与分析
2.1 盐胁迫对葡萄叶片中多胺含量的影响
研究表明,盐胁迫下,维多利亚葡萄幼苗叶片中多胺(PA)的含量大幅度增加,随胁迫时间的增加呈先上升后下降的趋势。处理后0天,由于为避免植物盐激反应,每盆中追施的NaCl盐溶液为分次等量均匀浇入,达到目标浓度时,植株已经经历了胁迫反应,除亚精胺(Spd)外,经盐处理后均显著高于对照。多胺含量于胁迫后10 d时最高,随处理程度的增加比CK增加了73.05%、78.74%和85.94%,其中腐胺(Put)增加了70.27%、77.47%和84.19%;精胺(Spm)比CK增加了79.92%、82.40%、90.28%;亚精胺(Spd)含量增加了76.96%、80.40%、82.85%。腐胺前期增加明显,增长趋势与精胺相似,亚精胺在处理后10 d达到峰值后缓慢下降,精胺略缓,腐胺极速下降。多胺含量较CK达到了显著水平(P<0.05),各处理之间也存在显著差异性,重度胁迫T3显著于T1和CK;T3和T2显著于CK,整体表现为T3 > T2 > T1 > CK。进行显著性分析,多胺(PA)总量与Put、Spm、Spd含量相关系数为0.989、0.944、0.810,呈极显著正相关。图1
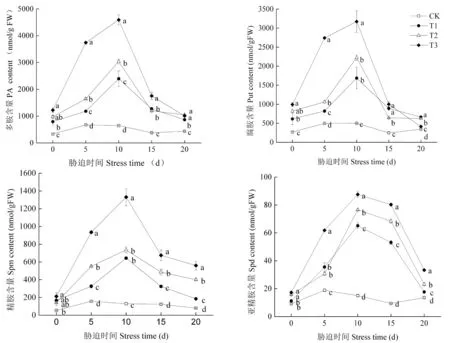
注: 数据后标注的小写字母表示5%水平下的显著差异性
Note:The lowercase letters after the data indicate significant differences at the 5% level
图1 盐胁迫下葡萄叶片中多胺含量变化
Fig.1 Effects of salt stress on polyamines content in grape leaves
2.2盐胁迫对葡萄叶片中多胺氧化酶活性影响
研究表明,盐胁迫下,葡萄叶片中的PAO活性和DAO活性都有明显的提升,在处理期间其上升幅度随胁迫程度加重而增大,随胁迫时间的延长,PAO活性表现为前期急速上升10 d后缓慢上升的趋势,DAO活性是先上升后下降的趋势。盐胁迫处理后,叶片中PAO活性在前10 d急剧上升并于第5 d便表现出显著差异性,第10 d T3和T2处理之间差异不显著,但也较CK分别增长了78.66%和77.42%,其余差异性一直十分显著,DAO活性在处理后10 d达到峰值,达到峰值时,各浓度间存在着显著差异性,分别比CK增加了56.44%、78.72%和82.51%。对其进行相关性分析,叶片中PAO活性与Spm和Spd呈显著正相关,相关系数分别为0.755和0.789;DAO是腐胺氧化分解的关键酶与Put呈极显著正相关(0.734)。图2
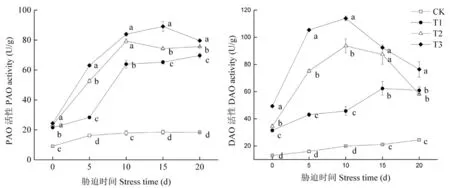
图2 盐胁迫下葡萄叶片中多胺氧化酶活性变化
Fig.2 Effects of salt stress on polyamine oxidase activity in grape leaves
2.3盐胁迫对葡萄叶片中多胺合成酶活性影响
研究表明,盐胁迫下,叶片中三种酶活性随胁迫程度的增大而增大,随胁迫时间的延长呈先升后下降的趋势,但增加的幅度却有略微的差异,ODC活性的T2处理下波动较大,但整体在T3处理下活性最大,处理10 d时T1处理与CK都没有显著差异性,但ADC活性在处理完成当天便表现出显著差异性,盐处理后的各指标酶活性均显著高于CK。三种酶活性皆约在处理完成后10 d左右达到峰值。在第10 d时,随盐浓度增加,ODC活性比CK增加了15.6%、28.14%、28.51%;SAMDC活性增长了10.49%、19.3%、36.04%;ADC活性增长了29.14%、36.26%、48.74%,显著分析后各处理间存在着显著差异性。综合比较,ADC活性增加幅度较ODC和SAMDC增加的大。对叶片中腐胺与其两种途径合成酶ADC和ODC活性进行相关分析,相关系数为0.734和0.590,呈显著正相关;精胺及亚精胺和其合成酶SAMDC活性相关系数为0.974和0.813,极显著正相关。图3
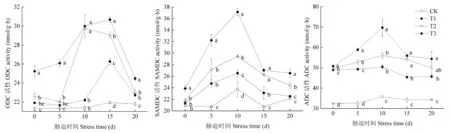
图3 盐胁迫下葡萄叶片中多胺合成酶活性变化
Fig.3 Effects of salt stress on polyamine synthetase activity in grape leaves
2.4 盐胁迫对葡萄叶片中激素含量的影响
研究表明,盐胁迫处理促使葡萄叶片中玉米素(zeatin,ZT)含量降低,玉米素含量在处理完成当天时便显著低于对照,但T1与T2却无显著差异性,处理后5 d T2与T1差异显著,却不显著于T3,第10 d盐处理的各指标存在显著差异性,在处理后15 d时各处理相对下降幅度较大,随盐浓度的增加分别比CK减少了46.85%、59.60%、85.24%。脱落酸(ABA)在处理后与玉米素相反含量升高,并且随处理时间的延长呈先上升后下降的趋势,盐胁迫程度越大,脱落酸含量增加越大。脱落酸含量在胁迫后15 d含量最高,比CK增加了76.01%、88.97%和90.01%。脱落酸含量在处理完成当天T3与T2处理间不显著却显著于T1与CK,在5 d后才存在差异性,在后期高盐间的差异性不显著,但整体表现为:处理3 >处理2 >处理1 >对照,而玉米素含量表现与之相反。对多胺总量和激素含量分别进行显著性分析,葡萄叶片中多胺(PA)含量与玉米素(ZT)含量呈显著负相关,相关系数为-0.473;与脱落酸(ABA)含量变化相似呈正相关,相关系数为0.584。图4
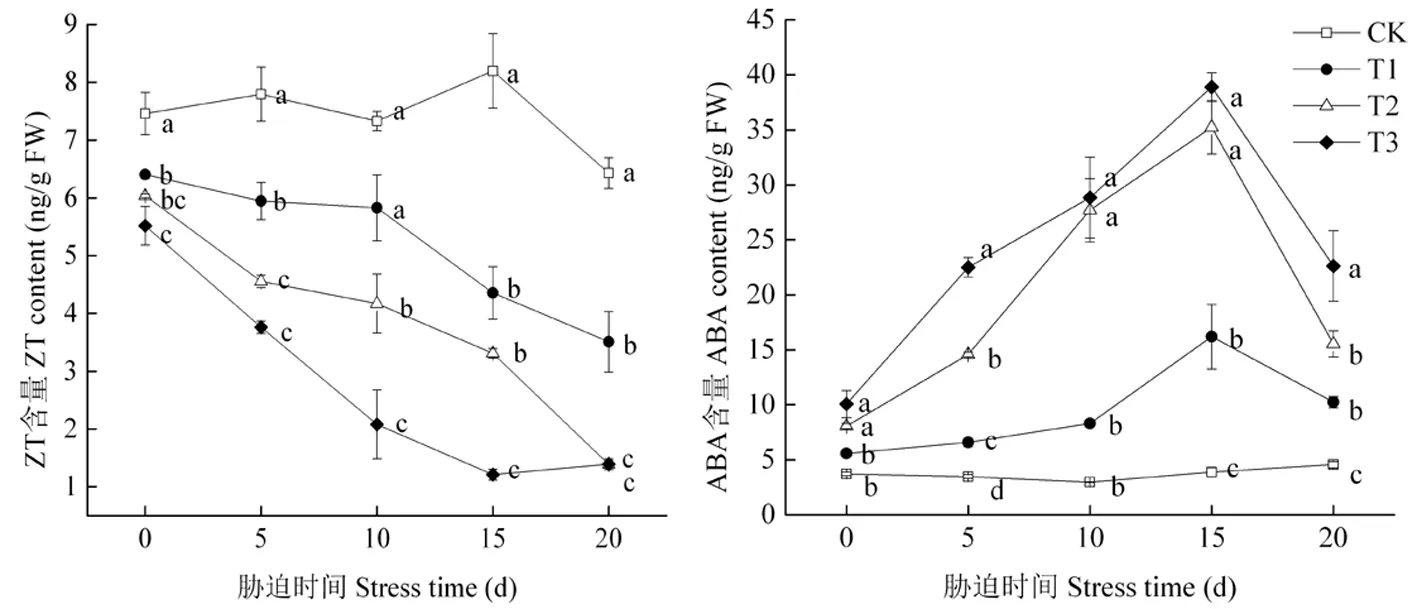
图4 盐胁迫下葡萄叶片中激素含量变化
Fig.4 Effects of salt stress on hormone content in grape leaves
3 讨 论
葡萄属于对盐敏感的非盐生植物[11],耐盐程度较大。一般耐盐性强的植物能够在盐胁迫的条件下积累较高含量的多胺[12]。多胺的主要合成途径一般有两条:一条是精氨酸(Arg)在精氨酸脱羧酶(ADC)作用下经过一系列反应水解形成腐胺(Put),腐胺又可进一步形成精胺(Spm)与亚精胺(Spd),其间主要发生作用的是S-腺苷蛋氨酸脱羧酶(SAMDC),这条代谢途径是可逆的。另一条是鸟氨酸途径:精氨酸水解产生鸟氨酸(Orn),再经鸟氨酸脱羧酶(ODC)作用脱羧生成腐胺[13]。多胺的代谢主要是腐胺、精胺、亚精胺的氧化分解。腐胺(Put)在二胺氧化酶(DAO)的作用下可以生成氨基醛和双氧水,环化形成二氢吡咯;亚精胺(Spd)在多胺氧化酶(PAO)的作用下氧化分解成二胺丙烷、二氢吡咯和双氧水;精胺(Spm)在多胺氧化酶(PAO)的氧化作用下形成二铵丙烷、氨丙基二氢吡咯和双氧水[14]。
在胁迫条件下,多胺更倾向于向低元胺的转化(Put是二元胺,Spd是三元胺,Spm是四元胺),来参与植物的渗透调节[15]。这与研究结果一致,盐胁迫处理使葡萄叶片中多胺含量尤其是腐胺含量明显增加,通过前人研究表明,这对逆境调节具有积极的意义,多胺通过调节相关酶实现清除受胁迫植物体内的自由基和活性氧,调节细胞渗透势,维持膜稳定性,同时使乙烯的合成受到抑制,从而提升葡萄耐盐能力[16]。当植物遭受到逆境胁迫时,植株体内ADC、ODC和SAMDC活性会升高,腐胺合成酶ADC和ODC活性增强,腐胺合成量就会增多,较高含量的Put又可以经SAMDC转化成为Spd与Spm,最终引起多胺总量增加。在试验中,盐胁迫使ADC活性显著增强,而ODC和SAMDC增幅又相对较小,在低盐胁迫下差异不显著,这是因为ADC是诱导酶,ODC和SAMDC是限速酶,盐胁迫促使ADC活性增强,腐胺积累量增多ODC和SAMDC酶活性相对被抑制[17]。试验中三种酶都能积极响应盐胁迫,但主要发生作用的还是ADC。前人在对盐胁迫下大麦[16]、苹果[18]等作物体内多胺含量的研究中发现不同植株在不同环境下多胺积累量有所差异,这可能与植物种间抗逆性差异有关,耐盐能力强的植物体内通常会积累较多的精胺与亚精胺,而盐敏感植物则会积累较多的腐胺[19]。
研究发现,NaCl处理前期腐胺明显增加,精胺与亚精胺也有不同程度的增加,随着处理时间的延长,出现峰值后,腐胺与精胺急速下降,但亚精胺含量却减少缓慢,这可能与腐胺转化成精胺与亚精胺有关,还可能与精胺与亚精胺的过度积累激活PAO活性有关,经显著性分析,PAO活性与精胺、亚精胺含量呈极显著正相关,PAO活性在处理后期下降幅度不大,促使多胺氧化活性增强,这是因为腐胺、精胺及亚精胺的过度积累作为底物激发DAO和PAO活性,使多胺氧化分解过程中积累大量自由基,从而加剧了细胞膜质过氧化,叶绿体中希尔反应被抑制,CO2固定能力降低[17],从而对植物组织产生毒害作用,由此可见,作物是为适应逆境下生态环境而改变了多胺含量及其平衡,因此,植物体内多胺含量的多少并不能决定植物对盐胁迫的抵抗能力。试验中,ADC、ODC和SAMDC活性的高低以及其在盐胁迫下的增加幅度却能反映植物本身在逆境胁迫下的抵抗能力。
脱落酸和细胞分裂素是被人们认知的植物感知逆境的信息物质,在试验中盐胁迫程度增强影响了植物体内内源激素的含量及其平衡,分析结果表明,盐胁迫条件下,植物体内玉米素含量降低。这可能由于植物在盐胁迫条件下,受细胞分裂素调控的基因和酶活性被抑制,促使植株的体内细胞分裂素合成和运输的量减少,使植物生长受到抑制的同时发生早衰[20]。试验还表明盐胁迫处理后能显著提高脱落酸含量,这与前人研究一致,产生这种现象的原因是由于逆境环境提升了叶绿体膜的通透性,加快了根系脱落酸的合成以及向叶片中的运输和积累。盐胁迫下,脱落酸可以促进植物由C3途径向CAM光合途径的转变,脱落酸的大量积累,增加了其信号转导作用,使植株体内Ca2+含量增加,膜的稳定性得到维持的同时调节了气孔运动,加快保卫细胞的离子流入,促进气孔关闭,延缓了SOD、CAT酶活性的下降[21]。同时还降低叶片中Cl-含量,从而抑制了乙烯的合成减少了叶片的脱落[22]。Biondi等在研究樱桃生根时发现多胺与乙烯的合成关系密切,SAM既是乙烯合成的前体,又是多胺中精胺与亚精胺合成的前体,乙烯合成时产生了与SAMDC竞争同一C源SAM而降低多胺脱羧酶活性,减少精胺与亚精胺的积累[23]。同时ABA与多胺的合成关系也十分密切,脱落酸能够促进多胺含量的增加以及向非质体的大量运转[24]。总而言之,多胺和激素含量在盐胁迫下的变化关系十分密切,但其调控过程还需进一步探索。胁迫下的多胺与激素代谢和运转过程是复杂而精细的,研究多胺与激素代谢规律能为探讨盐胁迫的分子生态学机制提供重要的研究前景。
4 结 论
维多利亚葡萄幼苗响应了盐胁迫下的多胺及激素代谢,盐胁迫诱使幼苗叶片中多胺含量增加尤其是腐胺含量大量增加,高盐胁迫更易积累较多的多胺,随时间的延长,处理末期高盐下多胺含量与中盐胁迫无显著差异性。DAO、ADC、ODC、SAMDC活性呈先上升后下降的趋势,PAO呈上升趋势,后期下降缓慢,盐胁迫下多胺过程代谢中PAO对多胺分解起主要作用;ADC对多胺合成起主要作用,SAMDC和ODC在低盐处理前期与CK差异不显著,其余指标均与CK存在显著差异性;盐胁迫下玉米素含量降低,脱落酸含量与之相反,但都是随胁迫程度越大变化越激烈。通过相关性分析,处理强度与多胺(PA)总量呈极显著正相关(0.62),与ZT含量呈极显著负相关(-0.793),与ABA呈极显著正相关(0.753)。盐胁迫下,3种多胺经酶的合成代谢和激素共同缓解葡萄苗所遭受到的盐胁迫,期间主要发生作用的是多胺合成酶,因此,多胺的合成代谢和激素含量变化与葡萄抗盐性关系密切。
)
[1] 赵可夫.植物抗盐生理[M].北京:中国科学出版社,1993:1-320.
ZHAO Ke-fu. (1993).Plantsaltresistancephysiology[M]. Beijing: China Science Press: 1-320. (in Chinese)
[2] 杨洪强,接玉玲.多胺与果树生长发育的关系[J].山东农业大学学报,1996,27(4):514-520.
YANG Hong-qiang, JIE Yu-ling. (1996). Relationship between polyamines and growth of fruit trees [J].JournalofShandongAgriculturalUniversity, 27(4): 514-520. (in Chinese)
[3] 段辉国,袁澎,刘文娟,等.多胺与植物逆境胁迫的关系[J].植物生理学通讯,2005, 41(4): 531-536.
DUAN Hui-guo, YUAN Peng, LIU Wen-juan, et al. (2005). Communication, learning and polyamines in plant abiotic stress [J].PlantPhysiology, 41(4): 531-536. (in Chinese)
[4] 李秀,巩彪,王允,等.高温胁迫下外源-氧化氮对生姜叶片多胺代谢及PSII的调控作用[J].中国农业科学,2014,47(6):1 171-1 179.
LI Xiu, GONG Biao, WANG Yun, et al. (2014). Effects of exogenous nitric oxide on polyamine metabolism and PSII regulation in Ginger Leaves under high temperature stress [J].ChinaAcademyofAgriculturalSciences, 47(6): 1,171-1,179. (in Chinese)
[5]Santner, A., Calderon-Villalobos, L. I., & Estelle, M. (2009). Plant hormones are versatile chemical regulators of plant growth.NatureChemicalBiology, 5(5):301-307.
[6]张丽,罗孝明,蒙辉, 等.盐胁迫下植物激素水平的研究进展[J].蔬菜,2017,(3):29-32.
ZHANG Li, LUO Xiao-ming, MENG Hui, et al. (2017). Research progress of plant hormone levels under salt stress [J].Vegetables, (3): 29-32.
[7]白泽晨,郁松林,赵妮, 等. 不同程度水分胁迫对赤霞珠幼苗游离态多胺含量的影响[J].新疆农业科学,2015,52(6):1 040-1 049.
BAI Ze-chen, YU Song-lin, ZHAO Ni, et al. (2015). Effects of water stress on the content of free polyamines in seedlings of Cabernet Sauvignon [J].XinjiangAgriculturalSciences, 52 (6): 1,040-1,049. (in Chinese)
[8]赵福庚,刘友良.精氨酸脱羧酶和谷酰胺转移酶活性的测定方法[J].植物生理学通讯,2000,36(5):442-445.
ZHAO Fu-geng, LIU You-liang. (2000).Arginine decarboxylase and amide transferase activity determination of [J].PlantPhysiologyCommunications, 36(5): 442-445. (in Chinese)
[9]汪天,郭世荣,刘俊,等.多胺氧化酶检测方法的改进及其在低氧水培黄瓜根系中的应用[J].植物生理学通讯,2004,40(3):358-360.
WANG Tian, GUO Shi-rong, LIU Jun, et al. (2004). Improvement of detection method of polyamine oxidase and its application in cucumber root culture in low oxygen water [J].PlantPhysiologyCommunication, 40(3): 358-360. (in Chinese)
[10]张占畅,孙志红,郑小能, 等. 高效液相色谱法测定库尔勒香梨幼果中的4种内源激素[J]. 新疆农业科学,2017,54(5):886-892.
ZHANG Zhan-chang, SUN Zhi-hong, ZHENG Xiao-neng, et al. (2017). An HPLC method for the determination of Korla pear fruit in 4 kinds of endogenous hormones [J].XinjiangAgriculturalSciences, 54(5): 886-892. (in Chinese)
[11]邢庆振,郁松林,牛雅萍,等.盐胁迫对葡萄幼苗光合及叶绿素荧光特性的影响[J].干旱地区农业研究,2011,29(3) :96-100.
XING Qing-zhen, YU Song-lin, NIU Ya-ping, et al. (2011). Effects of salt stress on Photosynthesis and chlorophyll fluorescence characteristics of grape seedlings [J].AridAreaAgricultureResearch, 29(3): 96-100. (in Chinese)
[12] Maiale, S., Sánchez, D. H., Guirado, A., Vidal, A., & Ruiz, O. A. (2004). Spermine accumulation under salt stress.JournalofPlantPhysiology,161(1): 35-42.
[13] Kasinathan, V., & Wingler, A. (2004). Effect of reduced arginine decarboxylase activity on salt tolerance and on polyamine formation during salt stress in arabidopsis thaliana.PhysiologiaPlantarum, 121(1):101-107.
[14] 李广敏,檀建新,贾荣革.高等植物的多胺代谢[J].河北农业大学学报,1993, 1(1): 86-92.
LI Guang-min, TAN Jian-xin, JIA Rong-ge. (1993). Polyamine metabolism of higher plants [J].JournalofAgriculturalUniversityofHebei, 1(1): 86-92. (in Chinese)
[15] Tiburcio, A. F., Altabella, T., Bitrián, M., & Alcázar, R. (2014). The roles of polyamines during the lifespan of plants: from development to stress.Planta, 240(1): 1-18.
[16] 汪月霞,袁利刚,赵一丹. 多胺与盐胁迫及渗透胁迫关系的研究进展[J].安徽农业科学,2010,38(24):12 969-12 980. WANG Yue-xia, YUAN Li-gang, ZHAO Yi-dan. (2010). Research progress on the relationship between polyamines and salt stress and osmotic stress [J].AnhuiAgriculturalSciences, 38 (24): 12,969-12,980. (in Chinese)
[17] 林文雄,吴杏春,梁康迳,等. UV-B辐射增强对水稻多胺代谢及内源激素含量的影响[J]. 应用生态学报,2002,(7):807-813.
LIN Wen-xiong, WU Xing-chun, LIANG Kang-jing, et al. (2002). Effects of enhanced UV-B radiation on polyamine metabolism and endogenous hormone content in rice [J].ActaEcologySinica, (7): 807-813. (in Chinese)
[18] Liu, J. H., Nada, K., Honda, C., Kitashiba, H., Wen, X. P., & Pang, X. M., et al. (2006). Polyamine biosynthesis of apple callus under salt stress: importance of the arginine decarboxylase pathway in stress response.JournalofExperimentalBotany, 57(11): 2 589-2 599.
[19] Krishnamurthy, R., & Bhagwat, K. A. (1989). Polyamines as modulators of salt tolerance in rice cultivars.PlantPhysiology, 91(2):500-504.
[20] 姚曼红,刘琳,曾幼玲.五大类传统植物激素对植物响应盐胁迫的调控[J].生物技术通报,2011,(11):1-5,25.
YAO Man-hong, LIU Lin, ZENG You-ling. (2011). Several Kinds of Phytohormone in Plants Responses to Salt-stress [J].BiotechnologyBulletin, (11): 1-5,25. (in Chinese)
[21] Chen, S. L., Li, J., Wang, S. S., Huttermann, A., & Altman, A. (2001). Salt, nutrient uptake and transport, and aba of populus euphratica; a hybrid in response to increasing soil nacl.Trees, 15(3):186-194.
[22] Gómez-Cadenas, A., Arbona, V., Jacas, J., Primo-Millo, E., & Talon, M. (2002). Abscisic acid reduces leaf abscission and increases salt tolerance in citrus plants.JournalofPlantGrowthRegulation, 21(3):234-240.
[23] Biondi, S., Diaz, T., Iglesias, I., Gamberini, G., & Bagni, N. (2010). Polyamines and ethylene in relation to adventitious root formation in prunus avium shoot cultures.PhysiologiaPlantarum, 78(3): 474-483.
[24] Michel, B. E. (1973). The osmotic potential of polyethylene glycol 6000.PlantPhysiology, 51(5): 914-916.
EffectsofSaltStressonPolyamineandHormoneMetabolisminGrapeSeedlingStage

