姜黄素对过度训练大鼠肾脏细胞凋亡的调控作用及其机制*
胡 戈, 曹 卉, 周海涛, 曹建民, 郭 娴, 牛衍龙, 包欣悦, 任 奕, 李 倩, 张 涛, 赵佳晖
(1. 北京体育大学, 北京 100084; 2. 北京联合大学, 北京 100023; 3. 北京联合大学 生物活性物质与功能食品北京市重点实验室, 北京 100191; 4. 赣南医学院, 江西 赣州 341000)
科学、合理的运动训练可以有效提高运动能力和健康水平。但在实际过程中,人们为了追求超负荷训练后的超量恢复,常常忽视两者之间的平衡关系,引发过度训练综合症。近年来,马拉松等高强度极限运动已不再为专业运动员“专属”,更多民众参与其中,享受极限运动带来的健康生活方式和快乐。部分爱好者由于对马拉松等高强度极限运动特点及运动风险认知不足,缺乏科学、专业的指导和科学训练,缺乏对自身能力和身体状况的了解,盲目挑战和超越自我,受运动负荷、训练周期、恢复时间、重视程度等多种因素影响,“跑马”人群过度训练综合症及运动性肾损伤频发[1],已引起社会及相关领域专家学者的高度重视。研究表明过度训练可诱发氧化应激和炎症反应,破坏肾脏局部组织结构,导致肾脏组织细胞凋亡增加,不仅不利于肾脏机能的提高,反而易造成多种病理及功能改变[2-4]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是体内调节氧化应激反应的重要转录因子之一,通过识别靶基因启动子中的抗氧化反应元件(antioxidant response element,ARE),调节下游众多抗氧化酶的基因表达,增强细胞抗氧化作用。Nrf2也可与B淋巴细胞瘤因子-2(B cell lymphoma-2 protein,Bcl-2)抗氧化反应元件结合,通过上调Bcl-2表达,下调Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达,阻止细胞凋亡[5]。姜黄素作为一种多酚类化合物,具有抗氧化、抑炎及抑制肿瘤生长等多种药理作用[6]。本团队前期研究和其他学者的研究均表明,姜黄素对大鼠运动性肾损伤具有一定保护作用,其机制与抑制氧化应激和炎症反应有关[7-9]。本实验结合前期研究,通过观察肾脏组织病理学改变并检测肾脏损伤标志物,结合肾组织氧化应激指标以及细胞凋亡水平变化,探讨姜黄素通过缓解过度训练所致氧化应激,进而降低大鼠肾脏细胞凋亡水平的机制。
1 材料与方法
1.1 实验动物与分组
SPF级雄性Wistar大鼠63只(49 d龄),体重(218.4±10.7 )g,由北京大学医学部实验动物科学部提供(生产合格证编号SCXK(京)2016-0010)。北京体育大学SPF级动物实验室饲养,温度(22±2)℃,相对湿度55%~75%,正常昼夜节律。实验大鼠首先进行4 d适应性饲养,然后以20 min/d的运动量进行3 d适应性游泳训练,剔除无法完成适应性训练的3只大鼠,剩余60只大鼠随机分为安静对照组(C组,12只)、过度训练组(OM组,24只)和姜黄素+过度训练组(COM组,24只)。
1.2 训练方案与营养干预
OM、COM组采用8周递增负荷游泳训练,具体方案[9-11]见图1。训练过程中,若发现大鼠出现力竭表现,即沉入水下10 s不能上浮,则托出水面休息5~10 min后再继续进行游泳训练,直至完成训练方案。
姜黄素购自陕西源泰生物科技公司(纯度>99%,批号17012571),用0.5%羧甲基纤维素纳配成混悬液,4℃存放备用。C组常规饲养,不进行任何运动干预。根据文献[8]及预实验结果,确定训练期间COM组大鼠姜黄素干预剂量为200 mg/(kg·d),灌胃体积为5 ml/kg;其他组灌胃等体积0.5%羧甲基纤维素纳。采用专业灌胃器每天灌胃一次。
1.3 实验动物取材
训练结束后,受训练强度、频度、负重情况、恢复时间等因素影响,OM、COM组大鼠出现意外死亡,分别剩余11只和14只。末次训练结束后24 h,各组大鼠乙醚适度麻醉,颈总动脉取血,37℃自然凝固,待血清出现后放入冰箱24 h。4℃,3 000 r/min离心10 min,分离制备血清,置-20℃冰箱中保存待测。取左侧肾脏浸入4%多聚甲醛固定液中。取右侧肾脏,置于预冷的生理盐水中洗净血污,准确称量重量后按照组织块重量W(g)/匀浆介质V(ml)为1 / 9 的比例加入PBS缓冲液,以玻璃匀浆器在冰上充分研磨后进行超声破碎,5 000 r/min离心5 min取上清待测。

Fig.1Swimming training program of rats
swimming time (min) * load percentage of the body weight (body weight %) * frequency of training
1.4 指标测试方法及仪器
各指标的测定和计算严格按照试剂盒说明书进行。使用仪器包括Allegra 25R台式高速离心机(美国Beckman Coulter公司),Wellscan MK3 酶标仪(美国雷博公司),Pannoramic MIDI全自动数字切片扫描系统(匈牙利3D HISTECH公司),r-911全自动放免计数仪(中国科技大学实业总公司),722分光光度计(上海分析仪器三厂),NR-B17CC超低温冰箱(日本松下),ISO9001电子天秤(北京赛多利斯仪器系统有限公司),DY89-Ⅱ电动玻璃匀浆机(宁波新芝生物科技股份有限公司),DK-2000-Ⅲ L型电热恒温水浴锅(天津市泰斯特仪器有限公司),LEICA RM2016病理切片机(德国RM公司)。
1.4.1 肾脏病理变化评价 将肾脏从固定液中取出,流水洗涤12 h,梯度酒精脱水后透明,石蜡包埋,制成4 μm切片,HE染色。在400倍光镜下,观察肾脏组织病理变化。
1.4.2 肾脏细胞凋亡检测 采用Tunel法检测细胞凋亡。石蜡切片脱蜡至水,经修复、破膜后,将适量末端脱氧核苷酸转移酶、脱氧尿苷三磷酸按2∶29比例混合,覆盖组织。切片平放于湿盒内,37℃ 孵育2 h后加入3%过氧化氢溶液,室温避光孵育15 min。适量converter-POD 37℃孵育30 min。洗涤,DAB显色,Harris苏木素复染细胞核后脱水封片。试剂盒由瑞士Roche公司提供。
1.4.3 蛋白免疫组化分析 采用免疫组化法检测Nrf-2、血红素氧合酶(heme oxygenase-1,HO-1)、Bcl-2、Bax表达情况。石蜡切片脱蜡至水经抗原修复后,加入3%双氧水溶液室温避光孵育25 min后脱色洗涤3次进行血清封闭,随后加入一抗、二抗,进行DAB显色,Harris苏木素复染细胞核后脱水封片。抗体由武汉谷歌生物科技有限公司提供。
1.4.4 H-score评分方法 采用病理切片扫描仪将每张切片内阳性的细胞数量及其染色强度转化为相应的数值,应用公式计算H-score从而对其进行定量分析。每张切片随机观察5个高倍视野,每个视野100个细胞,其中细胞核呈深棕色为强阳性,棕黄色为中度阳性,浅黄色为弱阳性,蓝色细胞核为阴性。进而对每个组织点进行识别分析出强阳性、中度阳性、弱阳性及阴性的面积(单位:像素)和阳性百分比,最后进行H-score评分评定。H-score=(弱阳性细胞密度×1)+(中阳性细胞密度×2)+(强阳性细胞密度×3)。
1.4.5 其他指标测试方法 采用放射免疫法测定血清睾酮(testosterone,T)和皮质酮(corticosterone,Cor),Jaffe 苦味酸法测定血清肌酐(creatinine,Cr),二乙酰-肟法测定血清尿素氮(blood urea nitrogen,BUN),酶联免疫吸附法测定总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)活性以及丙二醛(malondialdehyde,MDA)浓度。以上试剂盒由北京华英生物技术研究所提供。
1.5 统计学处理
2 结果
2.1 过度训练对大鼠肾脏组织结构的影响
光镜下观察显示,C组大鼠肾脏组织形态正常,肾小球无淤血、变性和水肿,肾小管管腔内未发现管型;OM组大鼠肾脏组织形态发生改变,肾小球出现淤血,肾小管严重损伤,上皮细胞出现水肿、空泡变性和管腔扩张现象,管腔中出现多种管型;COM组大鼠肾脏组织形态损伤程度轻于OM组,肾小管上皮细胞出现轻度水肿、空泡变性和管腔扩张,无蛋白管型和细胞管型(图2,见彩图页Ⅱ)。
2.2 过度训练对大鼠肾脏损伤指标的影响
与C组相比,OM组血清Cr和BUN水平均显著升高(P<0.01)。与OM组相比,COM组血清Cr和BUN水平均显著降低(P<0.05,表1)。
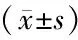
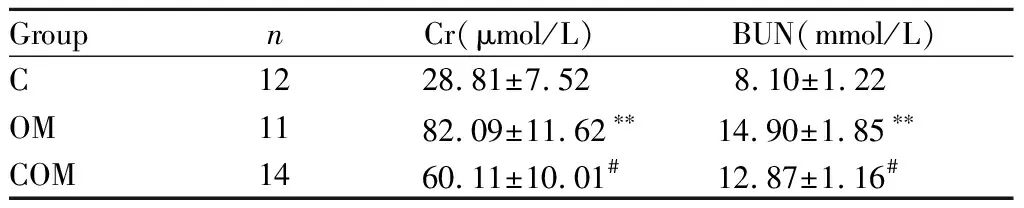
GroupnCr(μmol/L)BUN(mmol/L)C1228.81±7.528.10±1.22OM1182.09±11.62∗∗14.90±1.85∗∗COM1460.11±10.01#12.87±1.16#
C: Control group; OM: Overtraining group; COM: Curcumin + overtraining group; Cr: Creatinine; BUN: Blood urea nitrogen
**P<0.01vsC group;#P<0.05vsOM group
2.3 过度训练对大鼠血清睾酮/皮质酮的影响
与C组相比,OM组血清T水平显著降低(P<0.01),Cor水平显著升高(P<0.01)。与OM组相比,COM组血清T水平显著升高(P<0.01),Cor水平显著降低(P<0.01)。组间T/Cor比值变化与T变化一致(表2)。
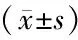

GroupnT(ng/ml)Cor(ng/ml)T/Cor(10-2)C121.82±0.7123.81±3.918.34±4.37OM110.50±0.12∗∗45.95±6.93∗∗1.14±0.44∗∗COM141.22±0.66##30.11±8.41##4.40±4.26##
C: Control group; OM: Overtraining group; COM: Curcumin + overtraining group; T: Testosterone; Cor: Corticosterone
**P<0.01vsC group;##P<0.01vsOM group
2.4 过度训练对大鼠肾脏氧化应激指标的影响
OM组T-AOC和SOD活性均显著低于C组(P<0.01),COM组T-AOC和SOD活性均显著高于OM组(P<0.01)。MDA浓度,OM组显著高于C组(P<0.01),COM组显著低于OM组(P<0.05,表3)。
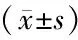

GroupnT-AOC(U/mg)SOD(U/mg)MDA(nmol/mg)C1236.44±3.5669.77±3.146.04±1.03OM1120.28±3.53∗∗34.58±2.68∗∗14.74±2.46∗∗COM1424.84±4.16##38.42±4.17##12.85±2.02#
C: Control group; OM:Overtraining group; COM: Curcumin + overtraining group; T-AOC: Total antioxidant capacity; SOD: Superoxide dismutase; MDA: Malondialdehyde
**P<0.01vsC group;#P<0.05,##P<0.01vsOM group
2.5 过度训练对大鼠肾脏细胞凋亡水平及Bcl-2/Bax表达水平的影响
肾脏细胞凋亡水平,OM组显著高于C组(P<0.01),COM组显著低于OM组(P<0.05)。肾脏Bcl-2表达,OM组显著低于C组(P<0.01),COM组显著高于OM组(P<0.05)。肾脏Bax表达,OM组显著高于C组(P<0.01),COM组显著低于OM组(P<0.01)。组间Bcl-2/Bax比值变化与Bcl-2表达变化一致(表4,图3,图4,图3见彩图页Ⅱ,图4见彩图页Ⅲ)。

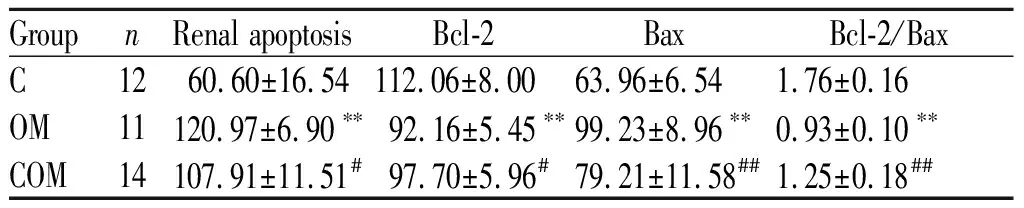
Groupn Renal apoptosisBcl-2BaxBcl-2/BaxC1260.60±16.54112.06±8.0063.96±6.541.76±0.16OM11120.97±6.90∗∗92.16±5.45∗∗99.23±8.96∗∗0.93±0.10∗∗COM14107.91±11.51#97.70±5.96#79.21±11.58##1.25±0.18##
C: Control group; OM: Overtraining group; COM:Curcumin + overtraining group; Bcl-2: B cell lymphoma-2 protein; Bax: Bcl-2 associated X protein
**P<0.01vsC group;#P<0.05,##P<0.01vsOM group
2.6 过度训练对大鼠肾脏Nrf-2和HO-1表达水平的影响
OM组Nrf2表达水平与C组无显著差异(P> 0.05),COM组显著高于OM组(P<0.05)。OM组HO-1表达水平显著低于C组(P<0.05),COM组显著高于OM组(P<0.05,表5,图5,图5见彩图页Ⅲ)。


GroupnNrf2HO-1C1277.86±5.1380.13±5.36OM1176.28±8.4872.51±9.16∗COM1484.50±9.16#80.47±7.54#
C: Control group; OM: Overtraining group; COM: Curcumin + overtraining group; Nrf2: Nuclear factor erythroid 2-related factor 2; HO-1: Heme oxygenase-1
*P<0.05vsC group;#P<0.05vsOM group
3 讨论
肾脏是保证机体内环境稳定的重要脏器,作为高灌注器官,对缺血、缺氧十分敏感。研究表明运动状态下,全身血流分配发生明显改变,肌肉组织血流量迅速增加,肾脏血流量急剧下降,下降幅度最高可达肾血流总量的40%~75%。运动终止后,血液从骨骼肌等运动器官回流到肾脏,伴随缺血/再灌注过程,氧化应激增强,线粒体功能出现障碍,自由基产生增多,SOD等抗氧化酶活性下降,机体抗氧化能力降低,无法有效的清除自由基,导致自由基过量堆积。过量的自由基会进一步加剧氧化应激过程,引发蛋白质和脂质过氧化以及DNA损伤,触发凋亡信号[12-13],细胞凋亡加剧进而导致肾脏结构、功能受损[14-15]。
T/Cor比值是监控运动者机能状况的敏感指标,可以有效反映机体合成和分解代谢的平衡情况,本研究中OM组大鼠T/Cor比值较C组下降达 86.33%,超过文献中报道的过度训练诊断标准[16],证明本研究成功建立过度训练动物模型。Cr和BUN是明确肾脏损伤程度的常用指标[17-19]。本研究中,OM组大鼠血清Cr和BUN较C组显著升高,同时肾脏组织出现一系列病理学改变,进一步说明8周递增负荷游泳训练引发大鼠过度训练的同时导致肾脏结构、功能受损。Nrf2是机体氧化应激反应的重要调节中枢,受kelch样ECH相关蛋白1(kelch-like ECH-associated protein-1,Keap1)调控,通过与ARE相互作用,调节抗氧化蛋白和Ⅱ相解毒酶的表达,在氧化应激反应中发挥重要作用[20-21]。HO-1作为Nrf2下游靶标,广泛参与Nrf2介导的抗氧化应答过程[22]。作为重要的细胞凋亡调节因子,以Bcl-2为代表的抗凋亡蛋白和以Bax为代表的促凋亡蛋白,其比值变化决定细胞凋亡发生的走向[23-24]。本研究中,与C组相比,OM组大鼠肾脏Nrf2表达水平无明显变化,但HO-1表达水平显著降低,同时肾脏T-AOC和SOD活性显著降低,MDA浓度显著升高。说明过度训练使氧化应激反应加剧,Nrf2转录活性降低,造成其下游抗氧化蛋白HO-1表达下降,机体抗氧化能力也随之降低,脂质过氧化产物增多。同时,与C组相比,OM组大鼠肾脏细胞凋亡水平明显上升,Bcl-2表达下调,Bax表达上调,Bcl-2/Bax比值显著降低。进一步说明,长时程、高强度运动引发过度训练所致运动性肾损伤中,机体氧化应激水平增强,抗氧化能力下降,肾脏细胞凋亡加剧,是运动性肾脏损伤发生与发展的主要因素。
姜黄素是我国最早被允许使用的天然色素之一,广泛应用于食品工业。在医学领域,姜黄素的功效主要为抗癌、抗炎、预防老年痴呆。本研究旨在探讨姜黄素是否可以通过延缓过度训练所致氧化应激,有效抑制大鼠肾脏细胞凋亡的发生。实验结果表明,与OM组相比,COM组大鼠血清T/Cor比值升高,T-AOC和SOD活性增强,MDA浓度下降,Cr和BUN浓度降低,肾脏组织形态明显改善,说明补充姜黄素可有效缓解过度训练引发的运动性肾损伤。研究表明,进行5/6肾切除术后大鼠肾脏Nrf2和HO-1表达下降,Keap1表达增加,而姜黄素可以通过调节Nrf2-Keap1途径,诱导抗氧化酶相关基因转录,有效缓解上述氧化应激过程[25-26]。此外,通过上调Nrf2 / HO-1表达发挥抗氧化作用,姜黄素也可改善庆大霉素诱导的肾损伤[27]。同时,与OM组相比,COM组大鼠肾脏Nrf2和HO-1表达水平、Bcl-2/Bax比值均显著升高。Niture等[5]的研究证明,Nrf2可以通过与Bcl-2基因抗氧化反应元件结合,调控Bcl-2表达和细胞凋亡过程。Zhang等[28]的研究中,通过使用Nrf2抑制剂,发现急性髓细胞白血病细胞系中Bcl-2表达减少,Bcl-2/Bax比值降低。上述研究表明,Nrf2表达水平的变化,可以直接影响细胞凋亡过程。姜黄素具有酚羟基和β-二酮2个活性部位,均可以提供质子,直接参与阻断自由基的反应[29]。同时,作为一种双功能抗氧化剂,姜黄素也可以通过诱导抗氧化反应,以间接方式发挥其抗氧化活性。姜黄素中的酚羰基可以与Keap1中半胱氨酸残基上的巯基发生加成反应,使Nrf2与Keap1解偶联,从而促进Nrf2 的核转位[30],通过增强Nrf2与ARE的结合,诱导HO-1表达增加[31],发挥抗氧化作用,进而影响细胞凋亡过程。
综上所述,结合病理特征、损伤指标、氧化应激指标和凋亡指标的变化,说明补充姜黄素可以通过上调Nrf2、HO-1蛋白表达,增强肾脏抗氧化能力,有效缓解过度训练引发的氧化应激状态,从而增加Bcl-2表达,减少Bax表达,抑制大鼠肾脏细胞凋亡,维持肾脏组织结构完整和功能正常,这对防治过度训练导致肾脏组织损伤具有重要的理论和实际意义。

