产后可逆性脑血管收缩综合征合并可逆性后部白质脑病1例报告
史 颖, 金 鑫, 袁 蓓, 李同凯, 任思敏
可逆性脑血管收缩综合征(Reversible cerebral vasoconstriction syndrome,RCVS)又称Call-Fleming综合征,于1988年由Call GK及Fleming CM首次报道[1],因产后女性为易感人群,曾被称为产后血管炎,属少见病,目前国内报道较少,临床常被误诊为脑动脉硬化,需引起重视。本文报道1例产后可逆性脑血管收缩综合征合并可逆性后部白质脑病患者,现报道如下。
1 临床资料
患者,女性,28岁,主因“孕32+3w第一胎、浮肿2 m、视物不清7 d,发现血压高1 d”于2016年4月12日入院。末次月经:2015年8月27日,预产期:2016年6月3日。患者停经后1 m余出现阴道间断少量出血,给予黄体酮口服及肌注后逐渐停止。孕24 w出现双下肢浮肿,后逐渐加重并延及全身。孕28 w出现过敏性鼻炎反复发作,自行应用“滴鼻净”治疗。入院7 d前出现视物不清,4 d前出现头痛、头晕,伴恶心、呕吐,自觉症状轻微,未予重视。1 d前门诊发现血压增高,150/88 mmHg,尿常规示尿蛋白3+。门诊以“重度子痫前期”收入院。辅助检查:心脏、腹部超声:二尖瓣少量返流,左室舒张功能减低,心包积液,EF 52%,肝多发囊肿,双肾积水。血常规 WBC 12.6×109/L,N 84.5%,Hb 89.3 g/L。电解质 钠131.43 mmol/L,钙1.93 mmol/L。BNP 330 pg/ml。D-二聚体 4.74 mg/L FEU。血脂 总胆固醇11.67 mmol/L,甘油三酯5.03 mmol/L,高密度脂蛋白胆固醇1.98 mmol/L,低密度脂蛋白胆固醇7.20 mmol/L,极低密度脂蛋白2.49 mmol/L,脂蛋白(a)842 mg/L。肝功能 白蛋白30.66 g/L。24 h尿蛋白10.83 g。患者入院第3 d出现发憋、气短,复查BNP 1340 pg/ml,后出现轻度头痛,伴恶心、呕吐,为避免病情进一步加重,给予地塞米松促进胎儿肺成熟,2016年4月16日行剖宫产术。患者术后第2 d出现抽搐发作,给予地西泮镇静及硫酸镁解痉,体温高,给予柴胡肌注。后患者出现头痛程度逐渐加重,双眼视物模糊,不完全性混合型失语,小便失禁。2016年4月18日行头部CT示双侧基底节区、右侧颞枕叶、左侧顶叶多发低密度。2016年4月20日由产科转入神经内科。复查血常规 RBC 2.35×109/L,Hb 60.6 g/L。给予输血、羟乙基淀粉扩容。同时给予低分子肝素钠抗凝、小剂量甘露醇脱水降颅压、活血、脑保护、补充白蛋白、补充铁剂、抗感染、尼膜同、硫酸镁防止脑血管痉挛、控制血压等对症治疗。2016年4月21日头部MRI+MRA提示多发早期缺血性脑梗死,双侧颈内动脉、大脑中动脉、大脑后动脉管腔明显狭窄,走形断续,双侧后交通动脉开放。头部MRV未见异常。颈动脉、双侧肾上腺、肾动脉超声未见异常。化验安卡、抗核抗体谱、ANA两项、抗心磷脂抗体、血沉、CRP、类风湿因子、补体、免疫球蛋白均未见异常。结合临床表现及影像学检查,考虑可逆性脑血管收缩综合症合并可逆性后部白质脑病可能性大,2016年4月23日复查头部CT考虑左侧额颞叶脑梗死伴出血。2016年4月30日复查头部CT出血基本吸收。患者头痛、视物模糊、失语、高血压、周身水肿等临床症状逐渐恢复。2016年5月10日复查头部MRA提示双侧颈内动脉虹吸部管腔狭窄,右侧大脑中动脉M1段管腔呈串珠样狭窄,双侧大脑中动脉分支明显减少。患者于2016年5月13日出院,出院后继续口服尼莫地平。2016年6月13日门诊复查头部MRA未见异常,支持可逆性脑血管收缩综合症合并可逆性后部白质脑病诊断。血常规、电解质、BNP、D-二聚体、血脂、白蛋白均未见异常。24 h尿蛋白1 g。
2 讨 论
本病发病机制尚不明确,RCVS超过50%为继发性,主要继发于血管活性药物应用(包括大麻、抗抑郁药、抗鼻粘膜充血药、血管收缩剂)及产后,少数继发于贫血、输血等情况[2],目前多数观点认为,RCVS与交感神经活动增强有关,中青年妇女多见。报道表明,劳累、性活动、情绪、Valsalva动作,洗澡,均可触发交感神经激活导致头痛发生[3]。出血性或缺血性卒中是其最严重的并发症,一般出现在发病1~2 w内[4],极少数患者可出现严重脑水肿,甚至脑疝死亡。本病例中,患者妊娠后期出现头痛,入院时存在贫血、心衰、高血压、蛋白尿、水肿、脂质代谢紊乱,入院后剖宫产手术应激、产后失血、高凝状态等诱因,且患者近期曾因过敏性鼻炎自行应用“滴鼻净”治疗,考虑可能与滴鼻净中缩血管成分麻黄素有关,上述因素可能同时存在导致本病发生,临床需引起重视。RCVS临床特点常表现为“雷击样头痛”(thunderclap headache,TCH)、卒中、局灶性神经功能缺损、癫痫发作,除少数合并严重卒中患者外,极少危及生命。反复发作“雷击样头痛”是本病的特征性表现,临床上在症状发作2~3 w,脑血管收缩率最高,部分患者也可出现单次的严重头痛事件或类似本例患者出现温和的渐进性头痛加重,甚至少数癫痫、昏迷、失语患者可以无头痛主诉,这与Wolff等报道病例结果一致[5]。本病症状初次发作后数d,可能会出现大脑凸面出血或蛛网膜下腔出血,其中女性、妊娠是RCVS合并脑出血的高风险因素[6]。Mathon等[7]报道30例不明原因大脑凸面出血的青年患者中,19例最终诊断为RCVS。因此,对于不明原因卒中或大脑凸面出血的患者,无论是否合并头痛,也应考虑本病可能。
RCVS的诊断主要依据颅内血管影像学的动态变化[8]。典型病例表现为脑动脉非动脉硬化性、非炎症性脑动脉可逆性多灶性节段性狭窄,多数仅累及颅内段,典型者呈“串珠样”改变,多在3 m内恢复正常[9]。但早期诊断仍需排除动脉硬化及血管炎可能。有尸检资料显示,RCVS患者颅内动脉多灶性、节段性管径变小,但无动脉硬化或血管炎性改变,但临床影像学难以鉴别。另外,对于合并典型“雷击样头痛”患者,需与SAH鉴别,RCVS合并SAH多位于大脑表面,出血量少,但血管痉挛样狭窄却非常广泛及多发,颅内动脉串珠样狭窄也具有一定特征性。DSA为RCVS诊断的金标准,但限于患者费用、鉴别诊断、有创操作的限制,临床上通常采用CTA/MRA诊断方法,发病3 m内病变血管恢复正常方能确诊RCVS。产后女性是RCVS的高发人群,有报道表明,约28% RCVS患者为产后女性[10]。对于产后女性,RCVS可同时合并可逆性后部白质脑病(Posterior Reversible Encephalopathy Syndrome,PRES),其共同的发病机制是交感神经参与血管张力调节[11]。有报道表明,RCVS并发症主要发生在发病后第1 w,约22%患者合并蛛网膜下腔或皮质出血,6%合并脑内出血,3%合并癫痫,9%合并PRES[12]。本病例患者同时存在高血压、双眼视物模糊等症状,头部CT示指状脑组织水肿,随病程发展逐渐消退,不同时期MRA可见戏剧样改变,支持RCVS合并PRES诊断。患者存在头痛、癫痫、失语等临床表现,同时合并缺血性与出血性卒中,因此,对于妊娠期发生头痛,贫血等症状时,若能引起足够重视及时纠正,同时避免应用类似滴鼻净血管收缩剂,可能有助于进一步降低产后RCVS所致卒中的发生,改善患者预后。
RCVS总体预后良好,远期预后取决于合并卒中的严重程度,致死率小于1%。有报道表明,钙通道阻滞剂如尼莫地平能减轻雷击样疼痛的程度,缓解脑血管痉挛,缩短病程,但能否能降低出血性或缺血性卒中的发生率,还缺乏循证医学依据,有待进一步探讨。糖皮质激素对于RCVS治疗作用仍有争议。单胺氧化酶抑制剂可能对RCVS治疗有效[13]。对于产后合并子痫或子痫先兆的患者,预防性应用硫酸镁可能有助于改善患者症状。此外,还需脱水降颅压、抗癫痫、扩容、纠正电解质紊乱、控制血压、止痛、预防缺血再灌注损伤等对症支持治疗。总而言之,对于RCVS的早期诊断有助于进一步针对性治疗,避免发生不可逆性神经功能障碍,临床上需引起重视。RCVS一般为单相自限性病程,但对于有RCVS病史患者,应慎用拟交感神经类血管活性药物。
[1]Call GK,Fleming MC,Sealfon S,et al. Reversible cerebral segmental vasoconstriction[J]. Stroke,1988,19(9):1159-1170.
[2]王子高,祖衡兵. 可逆性脑血管收缩综合征[J]. 中国神经精神疾病杂志,2013,39(5):314-317.
[3]Ducros A,Wolff V. The typical thunderclap headache of reversible cerebral vasoconstriction syndrome and its various triggers[J]. Headache,2016,56(4):657-673.
[4]Ducros A. Reversible cerebral vasoconstriction syndrome[J]. Handb Clin Neurol,2014,121:1725-1741.
[5]Wolff V,Ducros A. Reversible cerebral vasoconstriction syndrome without typical thunderclap headache[J]. Headache,2016,56(4):674-687.
[6]Ducros A,Fiedler U,Porcher R,et al. Hemorrhagic manifestations of reversible cerebral vasoconstriction syndromefrequency,features,and risk factors[J]. Stroke,2010,41(11):2505-2511.
[7]Mathon B,Ducros A,Bresson D,et al. Subarachnoid and intra-cerebral hemorrhage in young adultsrare and underdiagnosed[J]. Rev Neurol (Paris),2014,170(2):110-118.
[8]Ducros A. Reversible cerebral vasoconstriction syndrome[J]. Lancet Neurol,2012,11(10):906-917.
[9]Belliston S,Sundararajan J,Hammond N,et al. Reversible cerebral vasoconstriction syndrome in association with fingolimod use[J]. Int J Neurosci,2016,23:1-4.
[10]Mawet J,Boukobza M,Franc J,et al. Reversible cerebral vasoconstriction syndrome and cervical artery dissection in 20 patients[J]. Neurology,2013,81(9):821-824.
[11]Bourvis N,Franc J,Szatmary Z,et al. Reversible cerebral vasoconstriction syndrome in the context of recent cerebral venous thrombosisReport of a case[J]. Cephalalgia,2016,36(1):92-97.
[12]Ducros A. Reversible cerebral vasoconstriction syndrome[J]. Presse Med,2010,39(3):312-322.
[13]Mauras T,Masson M,Ducros A,et al. Reversible cerebral vasoconstriction syndrome and treatment with monoamine oxidase inhibitor[J]. Aust NZJ Psychiatry,2014,48(7):684-685.
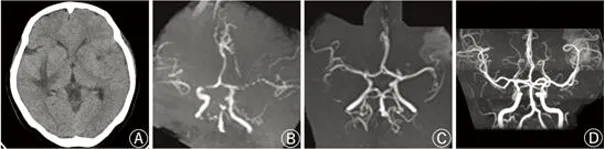
图1 2016年4月23日头部CT 右侧颞枕叶低密度,表现为“指状水肿”,提示血管源性脑水肿,左侧额颞叶脑梗死伴出血(A);2016年4月21日头部MRA可见双侧颈内动脉、大脑中动脉、大脑后动脉管腔明显狭窄,走形断续,部分如“串珠样”改变(B);2016年5月10日头部MRA可见颅内动脉形态较前改善,仍可见右侧大脑中动脉M1段管腔呈“串珠样”狭窄(C);2016年6月13日头部MRA完全恢复正常,较前片对比有“戏剧性改变”(D)

图2 2016年4月21日头部MRI DWI示多发早期缺血性脑梗死(A、B);2016年6月13日复查头部MRI示左侧额颞叶缺血性脑梗死伴皮质板状坏死(C、D)

