微生物合成纳米灵菌红素及其对羊毛织物抗菌染色
任燕飞, 巩继贤, 付冉冉, 张健飞, 王富邦, 陶宇庆(.天津工业大学 纺织学院, 天津 300387; 2.天津工业大学 先进纺织复合材料教育部重点实验室, 天津 300387)
随着国家对可再生资源重视程度的提高,天然染料以其良好的生物降解性、可持续性以及对人体皮肤的的无毒低刺激性而日益成为纺织品染色领域研究的热点[1-2]。其中微生物染料/色素的生产不受季节、气候和地域的限制,同时种类丰富,产量高,生产周期短,将逐渐成为天然染料的主要来源[3-4]。
作为一种极具潜力的微生物染料,灵菌红素由于具有鲜艳的颜色、良好的热稳定性以及某些功能性而逐渐成为研究热点。灵菌红素是一类微生物红色素的统称,主体结构为三聚吡咯,其中 2-甲基-3-戊基-6甲氧基三聚吡咯是此类色素的典型代表。可产生灵菌红素的微生物有黏质沙雷氏菌、产气弧菌以及一些放线菌[4-5]。使用灵菌红素对蛋白质纤维织物染色,国内外已有一些报道,但是由于灵菌红素为胞内色素,需要使用有机溶剂将色素提取出来。同时,灵菌红素几乎不溶于水,制备染液时同样需要使用有机溶剂溶解色素。有机溶剂的使用既提高了成本,又与天然染料绿色环保的宗旨不符[6-7]。
本文使用黏质沙雷氏菌发酵直接制备了灵菌红素纳米分散液,表征分析了此分散体系的粒径分布和色素浓度,以此作为染液对羊毛织物染色,系统地研究了染色条件对织物颜色和抗菌性能的影响。染液的制备及染色过程完全避免了有机溶剂的使用,绿色环保,且此方法具有普遍适用性,可推广至其他非水溶性的微生物胞内色素。
1 实验部分
1.1 材料与仪器
织物:平纹羊毛织物,面密度为125 g/m2,经密为210 根/(10 cm),纬密为180 根/(10 cm),购自上海市纺织工业技术监督所。
菌种:黏质沙雷氏菌 (ATCC 8100)、金黄色葡萄球菌 (ATCC 6538)和大肠杆菌 (ATCC 8739),均购自美国典型培养物保藏中心。
试剂:灵菌红素标准品(纯度>95%),购自英国Abcam贸易有限公司;丙三醇、吐温-80、氯化钠、氯化钾、硫酸镁、盐酸、氢氧化钠、无水乙醇等,购自天津市科密欧化学试剂有限公司;蛋白胨、牛肉粉、酵母浸粉、琼脂粉,均由北京奥博星生物技术有限公司生产。
仪器:DelsaNano C型激光粒度分析仪,美国Beckman Coulter公司;UV-6100型紫外-可见分光光度计,上海美普达仪器有限公司;ECO红外染色机、Datacolor SF-600型测色配色仪,美国Datacolor公司;LRH-150 型生化恒温培养箱,上海一恒科技有限公司;ZWY-240恒温培养振荡器(上海智城分析仪器制造有限公司;Scan-500型全自动菌落计数仪,法国Interscience公司等。
1.2 实验方法
1.2.1纳米灵菌红素染液的制备
将活化后的黏质沙雷氏菌接种至种子培养液中,在30 ℃、160 r/min摇床中培养20 h。然后将黏质沙雷氏菌种子液接种至发酵培养液中,在28 ℃、200 r/min摇床中发酵培养72 h。发酵结束后,使用离心机在10 000 r/min、10 ℃条件下对发酵液进行离心,时间为10 min,去除菌体后得到纳米灵菌红素染液。
种子培养液:5 g/L酵母粉、10 g/L蛋白胨、3 g/L氯化钠、2 g/L氯化钾。
发酵培养液:蛋白胨 15 g/L、0.3%丙三醇、1.8%吐温-80、2 g/L硫酸镁、3 g/L氯化钠、2 g/L氯化钾。
1.2.2灵菌红素标准曲线的绘制
取1 mg灵菌红素标准品溶解于10 mL 90%酸性乙醇水溶液中,pH值为3,以此作为母液进行梯度稀释,分别测定稀释后溶液在535 nm波长条件下的吸光度,绘制灵菌红素标准品浓度对应吸光度的拟合直线。
1.2.3纳米灵菌红素染液对羊毛织物染色
在红外染色机中使用制备得到的纳米灵菌红素染液对羊毛织物染色,工艺如图1所示。室温入染,升温速率为3 ℃/min,浴比为1∶40。分别探究染色温度、时间及染浴pH值对染色效果的影响。

图1 染色工艺曲线Fig.1 Dyeing process curve
1.3 测试方法
1.3.1粒径测试
使用DelsaNano C型激光粒度分析仪测定纳米灵菌红素的粒径分布及多分散指数,测试模式选择CONTIN,测试温度为25 ℃,每次测试重复3次。
1.3.2K/S值及颜色特征值测试
使用Datacolor SF-600型测色配色仪测定染色羊毛织物的K/S值及L*、a*、b*值。
1.3.3染色牢度测试
耐摩擦色牢度根据GB/T 3920—2008《纺织品 色牢度试验 耐摩擦色牢度》测定;耐皂洗色牢度根据GB/T 3921—2008《纺织品 色牢度试验 耐皂洗色牢度》测定;耐汗渍色牢度根据GB/T 3922—2013《纺织品 色牢度试验 耐汗渍色牢度》测定;耐晒色牢度根据GB/T 8427—2008《纺织品 色牢度试验 耐人造光色牢度:氙弧》测定。
1.3.4抗菌性能测试
根据GB/T 20944.3—2008《纺织品 抗菌性能的评价 第3部分:振荡法》对染色羊毛织物进行抗菌性能测试,对照样采用未经染色的羊毛织物。实验菌种为金黄色葡萄球菌和大肠杆菌。原织物和染色织物分别接触振荡菌液,温度为24 ℃,时间为18 h,菌液浓度为2×104~3×104CFU/mL。接触振荡后用10倍稀释法稀释菌液并涂平板,其中大肠杆菌稀释5次,金黄色葡萄球菌稀释4次,通过所涂平板上的菌落数计算振荡接触织物后的菌液浓度。抑菌率计算公式为
式中:R为染色羊毛织物的抑菌率,%;A为未经染色的羊毛织物振荡接触菌液后烧瓶内的菌液浓度,CFU/mL;B为染色羊毛织物振荡接触菌液后烧瓶内的菌液浓度,CFU/mL。
2 结果与讨论
2.1 纳米灵菌红素染液的制备
图2示出纳米灵菌红素染液的制备过程。
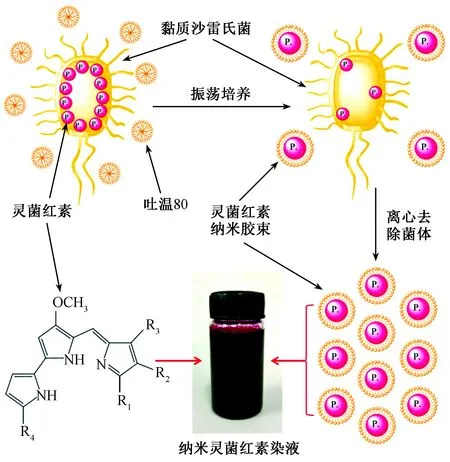
图2 纳米灵菌红素染液制备过程Fig.2 Preparation of nano prodigiosins
灵菌红素几乎不溶于水,为胞内色素,在常规的发酵液中大部分色素存在于菌体内部。通过在发酵液中添加非离子表面活性剂吐温-80,可提高细菌细胞壁和细胞膜的通透性,使在菌体内部合成的色素向外转移。同时,发酵液中非水溶性的灵菌红素会被非离子表面活性剂包覆,形成色素的胶束体系,极大程度上降低了发酵液中游离灵菌红素的浓度,这进一步促进了胞内色素向外转移,形成更多的灵菌红素-吐温-80胶束[8-9]。发酵结束后去除菌体,即得到纳米灵菌红素分散液,以此作为染液进行后续的染色实验。
2.2 纳米灵菌红素的粒径分布
图3示出纳米灵菌红素分散液的粒径分布。粒径分布在152.4~648.4 nm之间;色素的平均粒径为285.8 nm;多分散指数为0.193,表明纳米灵菌红素的粒径分布集中。纳米级的色素分散系以及集中的粒径分布既可保证分散液的均一稳定,又可保证染色织物的匀染性。

图3 纳米灵菌红素分散液粒径分布Fig.3 Particle size distribution of prodigiosins nano-dispersion
2.3 纳米灵菌红素染液色素质量浓度
图4示出灵菌红素标准品浓度对应吸光度的标准曲线。拟合得到的线性回归方程为
y=0.278 84x+0.009 97,R2=0.999 94

图4 灵菌红素标准品质量浓度与吸光度拟合直线Fig.4 Fitting straight line of concentration and absorbance of prodigiosin standard
式中:x为色素质量浓度,mg/L;y为吸光度。
使用pH值为3的90%乙醇溶液稀释纳米灵菌红素染液,经离心去除不溶物后,测定535 nm波长条件下的吸光度,经过计算得到纳米灵菌红素染液中色素的质量浓度为18.3 mg/L。
2.4 染色温度对染色效果的影响
温度是羊毛织物染色过程中非常重要的因素,图5和表1示出温度对羊毛织物染色效果的影响,染色时间设为30 min。随着染色温度的升高,织物色深度逐渐加深,当温度达到90 ℃时,羊毛织物的K/S值最大。染色温度为100 ℃时,色深度略有下降。同时羊毛织物的颜色变得晦暗,这可能是由于在长时间的高温条件下,且染罐中有一定压力,灵菌红素分子上的亚氨基与羊毛蛋白分子中的某些氨基酸发生微弱的反应,破坏了色素的发色团,因此,最适染色温度为90 ℃。

图5 不同温度染色羊毛织物Fig.5 Dyed wool fabrics under different temperatures

表1 不同温度下羊毛织物的染色效果Tab.1 Dyeing effect of wool fabrics dyed under different temperatures
2.5 染色时间对色深度的影响
图6示出染色时间对羊毛织物色深度的影响。随着染色时间的延长,织物K/S值逐渐增加,直到纤维表面与内部的染料浓度达到平衡。当染色时间超过20 min后,色深度逐渐下降,这是由于灵菌红素分散系在长时间的高温下逐渐破坏,染浴中染料聚集的机会增多,聚集程度增大,灵菌红素发生沉降,染色平衡被打破, 染料的解析大于吸附, 所以染色羊毛织物的K/S值开始下降。因此,最优染色时间为20 min。
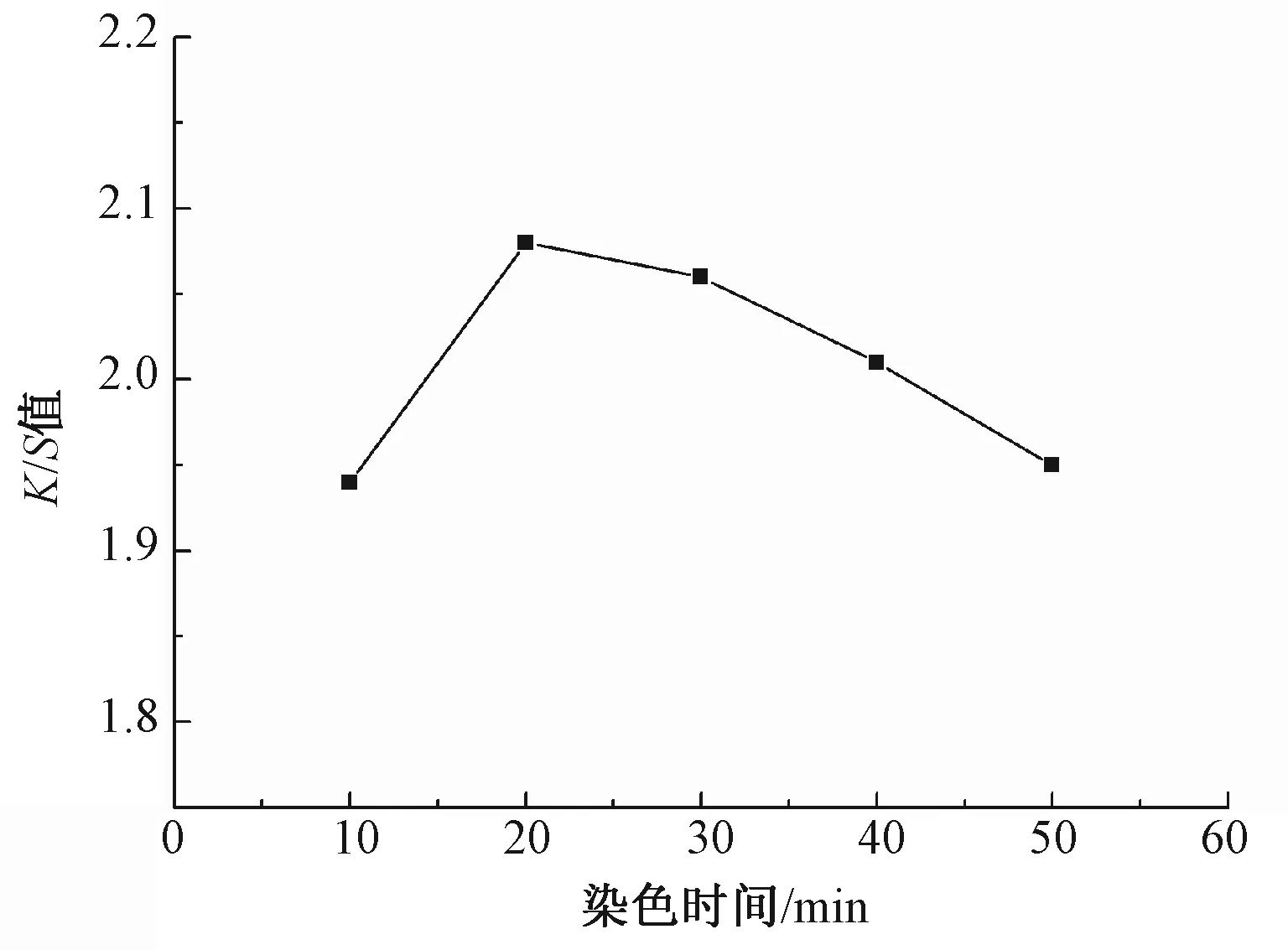
图6 染色时间对羊毛织物色深度的影响Fig.6 Effect of dyeing time on color depth of dyed wool
2.6 染液pH值对染色效果的影响
经测定,纳米灵菌红素分散液的pH值为8.1。由于羊毛耐酸不耐碱,对羊毛织物的染色需要在酸性或中性条件下进行,分别调节纳米灵菌红素染液的pH值为2.1、4.1、6.1和8.1,在最适染色温度和时间下对羊毛织物染色,结果如图7及表2所示。可以看出,染液pH值对染色效果影响明显,其中当pH值为2.1时,羊毛织物的颜色最深。这是由于随着pH值的降低,灵菌红素在水中的溶解度会增加,染料只有在溶解状态下才能上染羊毛纤维,溶解度的提高会增加染料的上染。灵菌红素的等电点在9.7左右[10],羊毛织物的等电点在4.2~4.8之间,当染液pH值为6.1和8.1时,羊毛织物带负电,灵菌红素带正电,电荷引力促进色素向纤维转移,羊毛织物的色深度比染液pH值为4.1时要高。

图7 不同pH值染色羊毛织物Fig.7 Dyed wool fabrics under different pH values

表2 不同pH值的染液中羊毛织物的染色效果Tab.2 Dyeing effect of wool fabrics dyed under different pH values
当染液pH值为2.1时,羊毛织物的b*值为负,织物表现出略带蓝光,这是灵菌红素的颜色对pH值敏感所导致的。图8示出灵菌红素乙醇溶液在不同pH值下的颜色情况。灵菌红素在酸性条件下呈紫红色,随着pH值的增大,色素逐渐由紫红色变为红色,而后变为橙色,并最终呈现黄色[8]。结合表2中羊毛织物的染色效果可推测,染色后羊毛纤维内部环境的pH值在8左右。当染液pH值为2.1时,灵菌红素以结合了大量氢离子的形式上染,颜色由浅红色向紫红色转变,染色织物表现出略带蓝光。

图8 pH值对灵菌红素溶液颜色的影响Fig.8 Effect of pH value on color of prodigiosins solution
2.7 抗菌性
抗菌测试所涂平板如图9、10所示。可明显看出,不同pH条件下纳米灵菌红素染色羊毛织物对金黄色葡萄球菌(革兰氏阳性菌)均有明显的抑制作用,而对大肠杆菌(革兰氏阴性菌)的抑制作用并不显著,这与灵菌红素对革兰氏阳性菌和阴性菌的抑菌机制不同有关。据文献报道,灵菌红素会阻碍大肠杆菌的核糖体(RNA)和蛋白质的合成,阻止细胞分裂,破坏外膜完整性并抑制细胞呼吸,但是灵菌红素并不能杀死或溶解大肠杆菌,只是抑制它们的分裂和代谢。相比之下,灵菌红素可以诱导革兰氏阳性菌产生自溶酶,从而导致细胞溶解与死亡[11-12],因此,灵菌红素染色羊毛织物对金黄色葡萄球菌的抑菌率明显高于大肠杆菌。
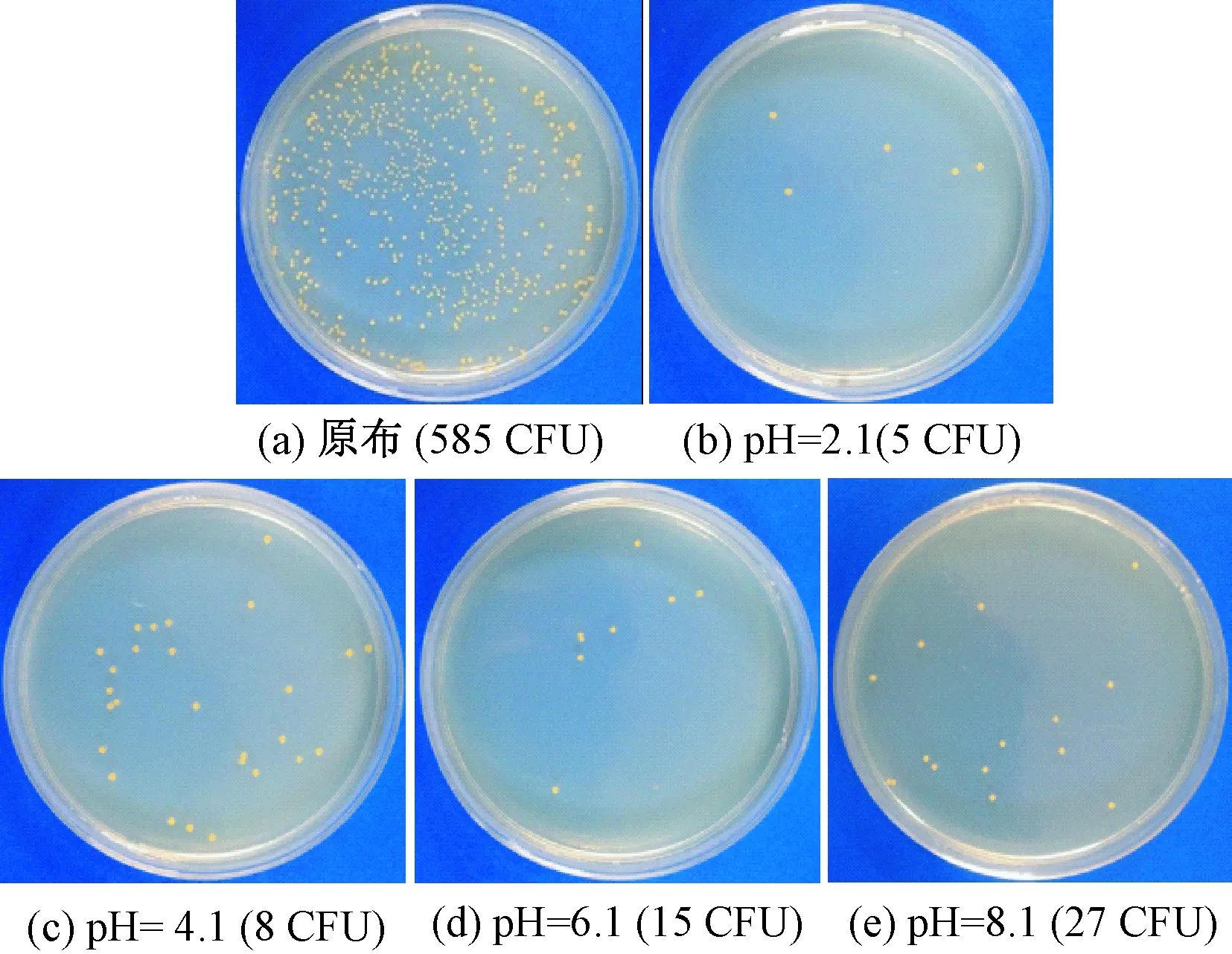
图9 不同pH值染色织物金黄色葡萄球菌抗菌实验菌落数Fig.9 Colony counts from fabrics dyed under different pH values against S. aureus. (a) Original fabric (585 CFU); (b) pH=2.1 (5 CFU); (c) pH=4.1 (8 CFU); (d) pH=6.1 (15 CFU); (e) pH=8.1 (27 CFU)
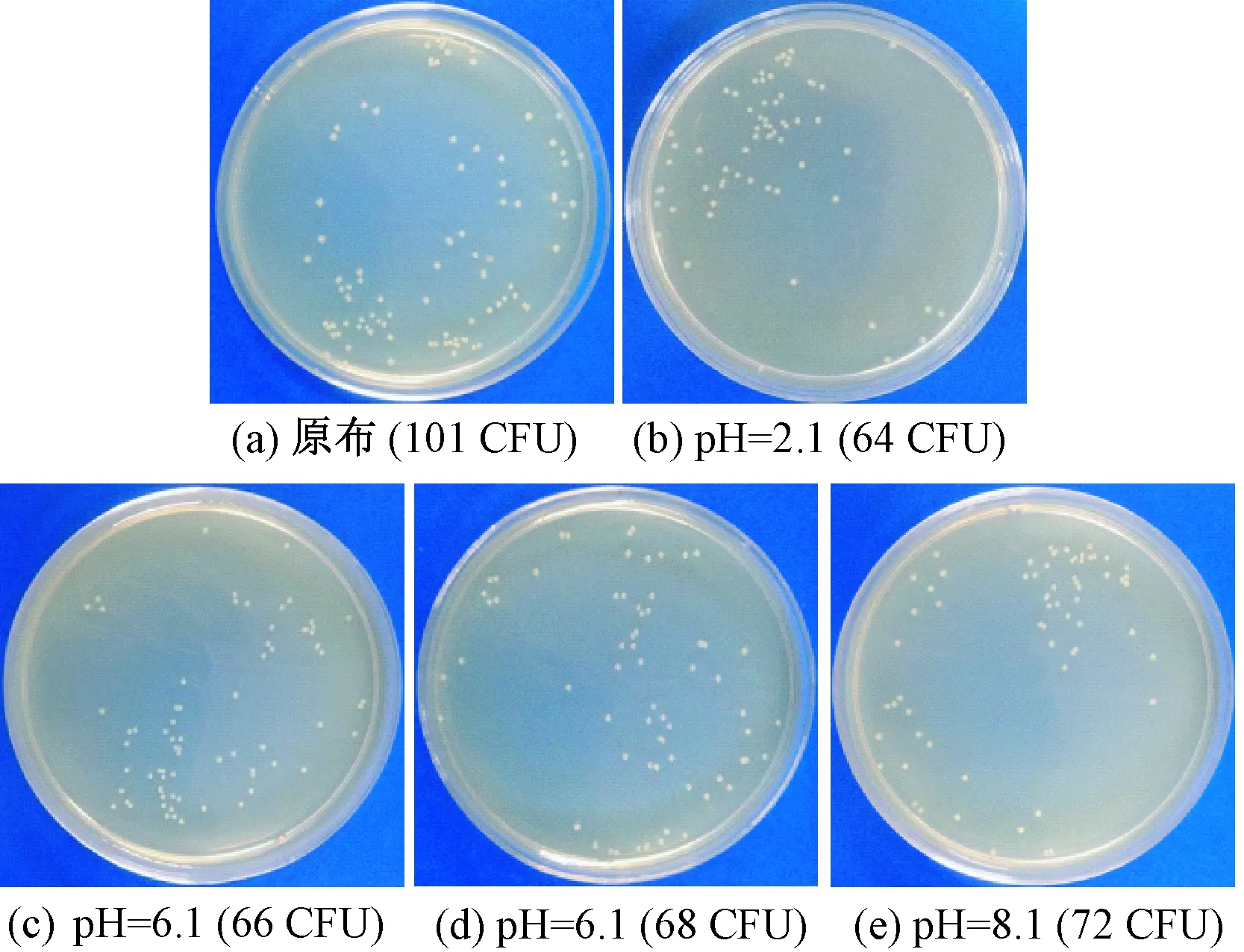
图10 不同pH值染色织物大肠杆菌抗菌实验菌落数Fig.10 Colony counts from fabrics dyed under different pH values against E. coli. (a) Original fabric (101 CFU); (b) pH=2.1 (64 CFU); (c) pH=4.1 (66 CFU); (d) pH=6.1 (68 CFU); (e) pH=8.1 (72 CFU)
对图9、10抗菌实验平板菌落计数, 计算染色羊毛织物对金黄色葡萄球菌和大肠杆菌的抑菌率,如图11所示。当染液pH值为2.1时,染色羊毛织物对金黄色葡萄球菌和大肠杆菌的抑菌率最高,分别为99.1%和36.6%。抑菌率的不同一方面与织物色深度即灵菌红素的上染量有关,另一方面与染色过程染液的pH值有关。细菌带负电荷,由于灵菌红素的等电点在9.7左右,染液pH越小,灵菌红素所带正电荷越大,这促进了灵菌红素与细菌的吸附接触,从而表现为抑菌率的提高。结合图7、表2中织物的染色效果以及图11中织物的抗菌性,选定最适染液pH值为2.1。

图11 染色羊毛织物的抑菌率Fig.11 Antibacterial ratio of dyed wool fabrics
2.8 染色羊毛织物的染色牢度
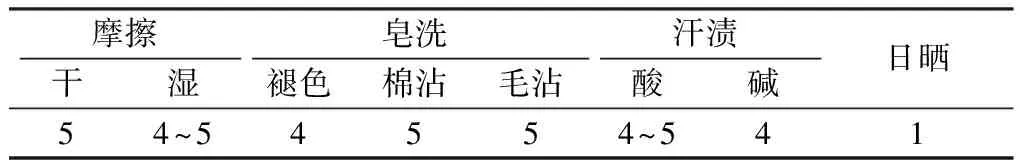
在最优工艺(温度为90 ℃,时间为20 min,染液pH值为2.1)条件下,染色羊毛织物色牢度如表3所示。染色后羊毛织物经过皂煮去除浮色,耐摩擦和皂洗色牢度均较高,耐汗渍色牢度同样在4级以上,可以满足服用要求。然而日晒牢度仅为1级,这与其他文献报道一致,包括灵菌红素在内的绝大多数微生物色素的光稳定性差,导致其染色后的织物日晒牢度低。如何提高微生物染料的光稳定性,提升染色织物的日晒牢度将成为微生物染料在纺织染色领域的研究重点。
表3染色羊毛织物的色牢度
Tab.3Fastnesspropertiesofdyedwoolfabrics级
3 结 论
1) 通过微生物发酵制备得到的纳米灵菌红素分散液的平均粒径为285.8 nm,多分散指数为0.193,粒径分布集中,色素分散液均一稳定。纳米灵菌红素染液中灵菌红素的质量浓度为18.3 mg/L。
2) 纳米灵菌红素对羊毛织物染色的最优工艺为:染色温度90 ℃,时间20 min,染液pH值2.1。此时染色羊毛织物对金黄色葡萄球菌和大肠杆菌的抑菌率均最高,分别为99.1%和36.6%。纳米灵菌红素染色羊毛织物对金黄色葡萄球菌的抑制作用明显优于大肠杆菌。
FZXB
[1] 郜世博, 吴赞敏, 张著桂. 涤纶织物的黄芩染色[J]. 纺织学报, 2015, 36(1): 98-102.
GAO Shibo, WU Zanmin, ZHANG Zhugui. Dyeing of scutellaria baicalensis georgi on polyester fabric[J]. Journal of Textile Research, 2015, 36(1): 98-102.
[2] 杨慕莹, 翟红霞, 邢铁玲, 等. 微生物染料及其在纺织品染色中的应用[J]. 纺织学报, 2016, 37(8): 165-170.
YANG Muying, ZHAI Hongxia, XING Tieling, et al. Microorganisms pigments and application thereof in textile dyeing[J]. Journal of Textile Research, 2016, 37(8): 165-170.
[3] TULI H S, CHAUDHARY P, BENIWAL V, et al. Microbial pigments as natural color sources: current trends and future perspectives[J]. Journal of Food Science and Technology, 2015, 52(8): 4669-4678.
[4] REN Y, GONG J, FU R, et al. Dyeing and antibacterial properties of cotton dyed with prodigiosins nanomicelles produced by microbial fermentation[J].Dyes and Pigments, 2017, 138: 147-153.
[5] VENIL C K, LAKSHMANAPERUMALSAMY P. An insightful overview on microbial pigment, prodigio-sin[J]. Electronic Journal of Biology, 2013, 5(3): 49-61.
[6] ALIHOSSEINI F, JU K S, LANGO J, et al. Antibacterial colorants: characterization of prodiginines and their applications on textile materials[J]. Biotechnology Progress, 2008, 24(3): 742-747.
[7] KIM Y, CHOI J. Dyeing properties of microbial prodiginine from Zooshikella rubidus for silk fabrics[J]. Fibers and Polymers, 2015, 16(9): 1981-1987.
[8] REN Y, GONG J, FU R, et al. Dyeing and functional properties of polyester fabric dyed with prodigiosins nanomicelles produced by microbial fermentation[J]. Journal of Cleaner Production, 2017, 148: 375-385.
[9] KANG B, ZHANG X, WU Z, et al. Effect of pH and nonionic surfactant on profile of intracellular and extracellular monascus pigments[J]. Process Biochemistry, 2013, 48(5): 759-767.
[10] ZELENEV A, SONNENBERG W, MATIJEVI E. Preparation, characterization, and adhesion of monodispersed polypyrrole particles[J]. Colloid and Polymer Science, 1998, 276(9): 838-841.
[11] DANEVCIC T, VEZJAK M B, ZOREC M, et al. Prodigiosin:a multifaceted escherichia coli antimicrobial agent[J]. Plos One, 2016, 11(9): 162412-162424.
[12] DANEVCIC T, VEZJAK M B, TABOR M, et al. Prodigiosin induces autolysins in actively grown bacillus subtilis cells[J]. Frontiers in Microbiology, 2016(7): 796-805.

