骨化性气管支气管病一例
杨智超 周勇 刘影 古拉霞尔 张振兴 哈斯铁尔
骨化性气管支气管病(tracheobroncheopathia osteochondroplastica, TO)是指气管、支气管黏膜下有多发性骨质或软骨组织结节样增生并突向管腔的良性气道病变[1-2],是一种极少见的主要累及呼吸系统大气道的良性疾病。目前国内对该疾病的报道较少,能够确诊的TO患者共79例(1991年至2016年)。在临床上此病易与肿瘤或结核等疾病混淆,近期本院诊断1例,现报道如下。
临床资料
患者,女,44岁,因“右侧胸部疼痛4个月余,伴咳嗽2周”就诊。患者自诉4个月余前无明显诱因出现右侧胸部疼痛(乳腺上方胸前及后背部),呈针刺样,持续性疼痛,夜间为著,吸气、翻身、劳累时加重,休息后可缓解,伴有气憋、全身乏力及肌肉酸痛,偶有咳嗽,痰不易咳出,咽痒,无咽痛,无发热、盗汗,无咯血,2周前无明显诱因出现上述症状加重,就诊于当地社区卫生诊所,诊断为“气管-支气管炎”,给以左氧氟沙星注射液静点抗炎治疗1周,上述症状缓解不明显,后为求进一步诊疗收住我科。病程中患者神志清,精神可,饮食可,睡眠欠佳,无夜间阵发性呼吸困难,无闻及刺激性气味胸闷不适病史,无发热、畏寒,无心慌,常有便秘,排尿正常,偶有双下肢轻度水肿。体重近期未有明显改变。既往有胃窦糜烂病史4年。入院后查体:体温36.60 ℃,脉搏79次/min,呼吸19次/min,血压107/74 mmHg,体质量65.00 kg,发育正常,双肺听诊呼吸音略粗,左右肺未闻及干湿性啰音。心率为79次/min,节律整齐,心脏各瓣膜听诊区未闻及额外心音和病理性杂音。(头颈耳鼻喉、心血管系统、呼吸系统、泌尿系统、消化系统、神经系统、骨骼肌系统查体未见明显阳性体征)。 辅助回报:呼吸系统功能检查回报提示轻度阻塞性肺通气功能障碍。血常规检查提示白细胞6.9×109/L,红细胞平均血红蛋白浓度:317.0 g/L,血小板:378×109/L,淋巴细胞百分比:41.3%。肺炎支原体血清学试验检测结果提示阳性。治疗上初步给“布地奈德雾化混悬液2 mg”联合“特布他林雾化液5 mg”雾化吸入2次/d,止咳化痰;“多索茶碱0.2 g”静脉输注2次/d,解除支气管痉挛;“氨溴索注射液30 mg”静脉输注2次/d,化痰对症等治疗。后完善胸部平扫薄层CT回报提示两肺纹理增多,气管内壁不光整、凹凸不平,主要位于前壁及侧壁,并能观察到不规则的斑点状高密度影,见图1,稍突入管腔,后壁(膜部)未见增厚及高密度影,见图2。

图1 CT气管壁不光整,表面凹凸不平,并可见点状高密度影(箭头)
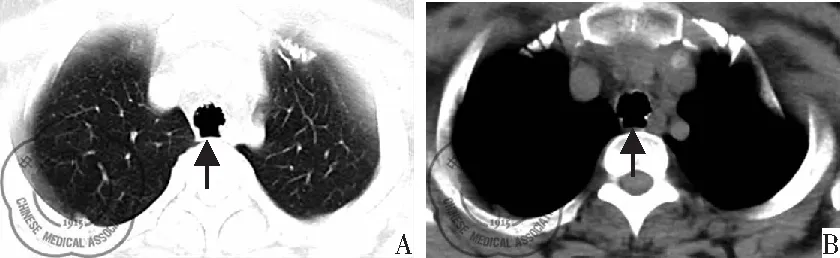
图2 气管膜部未见钙化病灶(箭头)
完善相关检查后给予患者行支气管镜诊疗,镜下所示:自声门下气管及左、右主支气管的前壁及侧壁内可见散在不均匀分布的大小程度不等的乳白色结节,无蒂,突向管腔,有局部融合成片,病灶外观呈“钟乳石”形态改变,气道黏膜苍白,尚光滑,毛细血管透见,管腔稍窄,右肺上、中、下叶及左肺上、下叶远端支气管开口正常通畅,管腔均未受累,对右主支气管病变部位实行活检,发现病灶结节质地较硬(不易钳取),活检韧,出血不多,见图3。
病理切片示:(右侧主支气管入口处)送检为支气管黏膜炎性细胞浸润及可见软骨组织,病变符合骨化性气管支气管病。 临床确定诊断为:①骨化性气管支气管病;②支原体感染。给予“阿奇霉素”抗炎5 d并同时祛痰、平喘等对症治疗10 d后患者咳嗽、胸痛症状明显好转出院。嘱其出院后继续使用“布地奈德福莫特罗粉吸入剂”1吸/次,2次/d。3月后呼吸科随诊。
讨 论
1855 年 RoRitanky 首次在尸体病理解剖检查中发现TO,1857 年 Wilks 通过显微镜的观察初次对该疾病作出了组织学描述,1896 年VonSchroetter 通过喉镜装置首次在临床诊断本病。此后该病报告逐渐增多。1964年Secrest等正式将本病定义为“骨化性气管支气管病”并获得普遍认同[3]。关于此种疾病的报道,国外相对较多,自1991年该病在国内首例报道后,随着呼吸支气管镜技术和医学影像学的发展,本病陆续在国内得到报道。本病的病程比较漫长,发病年龄多在50岁左右,青少年和儿童病例的报道,较为罕见[4]。国外文献报道该病男女患病率无明显差异[4]。

图3 支气管前壁、侧壁弥漫性大小不等结节状突起,部分融合,突向管腔,管腔轻度狭窄,后壁和远端支气管正常;注:A:气管;B:气管下段;C:隆突;D:右肺基底段
目前TO的病因和发病机制尚不明确。 考虑 TO是支气管肺淀粉样变的后期阶段表现,主要根据是发现在局限型淀粉样变中,有时可以观察到骨化中心[5-6]。 但是,上述表现并不常见,且很多文献和研究不赞成该观念。此外,有报道机体内部的内分泌细胞所分泌的激素程度紊乱或钙磷在体内调节代谢的异常等与该病有相应的关联性[7]。 Jepsen 等[8]认为长期油烟和/或化学物质接触等慢性刺激或许是导致本病的一个重要因素。因为有一些骨化性气管支气管病患者有长时间的刺激性化学物质接触史,当脱离相应化学源一段时期后,症状都能得到好转。 所以慢性气道刺激在该病的产生、进展中可能起到特定的效应。目前认为 TO 的发生机制可能是在上述几种原因的协同联合作用下,由气管黏膜层中含有较多弹性纤维的固有层结缔组织和黏膜下层的原始未分化结缔组织以及多潜能胚胎细胞在化学物质刺激或内分泌激素异常或其他条件的作用下,经过化生并逐渐转变为软骨细胞和骨细胞乃至骨髓细胞,钙质聚积,继而形成骨化。同时在骨性结节的形成发展过程中,骨形成蛋白 2(bone morphogenetic protein-2, BMP-2)的异常也可能起着重要的作用,并与转化生长因子β1协同促进黏膜下结节的生长。此外,原发性黏膜鳞状上皮出现软骨和骨的化生也可能是发病的一种机制[9]。总之,其疾病发生可能的因素与长期持续感染、气道黏膜组织化生、化学物质或物理(辐射等)刺激、先天因素、激素调节异常等有关。
TO的临床症状没有显著特异性表现,其症状轻重主要与病变范围和气道狭窄程度有关。其中慢性咳嗽、咳痰为最常见临床表现,部分患者表现为活动后气促、痰中带血、反复呼吸道感染及发热、声嘶、咯血、胸痛等,少数患者无自觉症状,只是在行胸部 CT扫描、气管插管或尸检时才发现。该病无家族倾向性,而这种非特异性症状也导致了本病不能得到及时明确的诊断[10-11]。本例患者主要临床表现为持续性胸痛伴咳嗽,考虑主要为黏膜下结节样增生病灶使气道生理结构发生变化,同时黏膜上皮鳞状化生使气管黏膜纤毛清除能力消失,管壁逐渐变形僵硬,气道出现狭窄,使气道内分泌物无法正常排出而产生相应的临床症状。倘若病变累及支气管开口,使其管腔出现狭窄、引流不畅,临床表现将反复发生阻塞性肺炎或肺不张。绝大多数患者在查体时无明显体征,只有出现气道明显狭窄时双肺听诊才可闻及哮鸣音或干湿性啰音。鉴于这些临床表现缺乏特异性,故容易在诊断上产生遗漏或错误的诊断为哮喘或支气管炎。所以,临床上对原因不明的长期咳嗽咳痰、反复呼吸道感染、活动后喘息的患者应考虑到该病的可能。
常规胸片对TO的诊断不敏锐,难以显示病灶,仅在出现管腔狭窄或阻塞合并有肺部感染、肺不张等一些合并症时才有参考价值。胸部CT 尤其是高分辨率 CT 对该病的初步诊视而判断具有重要意义。通常使用2 mm以下的薄层扫描显现病灶比较清晰,典型表现为气管及主支气管前、侧壁在纵膈窗视野下可观察到突向气道内的散发或多发分布的斑点钙化状小结节影,绝大多数小结节直径在1~3 mm,但也有些结节较大,达到 10 mm[12-13]。当病灶出现在叶或段支气管开口处时,十分容易导致管腔狭窄,出现阻塞性肺炎、肺不张[14]。个别患者可累及喉部, 重症融合型患者气管膜部亦可受累,出现管壁塌陷,管腔缩窄。螺旋CT三维仿真重建技术是非侵入性辅助诊断T0比较良好的影像学模式。有报道使用仿真支气管镜技术能够观察到管腔内不规则分布的病灶,可以清楚明显地表示出病变的范围和有无并发症存在[15]。
支气管镜下表现具有特征性,是临床上诊断并判定TO的“金标准”, 其图像可以看见气管、支气管的前壁和侧壁有散发或融合成片的白色或灰黄色结节朝向管腔内突起,常无蒂,质地较硬,不容易钳取,典型的呈鹅卵石样外观,严重时管腔内病灶可呈“钟乳石”样改变,管腔可变窄或不规则[16]。一般在气管镜下根据结节形态能够划分为三类:① 散在型(管腔黏膜上的多个病灶结节散在分布);② 弥漫型(可见结节均匀分布在黏膜上);③ 融合型(毗邻的结节相互融合)。病变主要累及气管中、下段和主支气管的前、侧壁,后壁(膜部)及声门和声门以上部位一般不受累。气道黏膜可正常、充血水肿、菲薄毛细血管透见或呈灰白色。所以支气管镜下特征性的表现具有诊断意义。
TO患者肺功能表现多数在正常范围,有些可呈现出阻塞性通气障碍或存在气道阻力增高,但弥散功能一般都正常。考虑到本病的病变性质会不同程度的影响气道阻力,故肺功能表现还尚需积累更多相应病例后进行分析总结。
病理分析可进一步确定诊断TO。病理切片的典型镜下表现可见病变组织内有软骨灶和/或骨化灶,有些骨化灶内可见具有造血功能的骨髓组织[17-18]。黏膜组织可见淋巴细胞、吞噬细胞、内皮细胞等参与炎症细胞浸润,亦可观察到柱状上皮组织的鳞状化生及异型增生。因为病灶质地较硬,不易钳取,故适当增加活检组织可以提高诊断率,有报道使用鳄齿钳取材可以显著提高病理诊断率[19]。
TO主要鉴别诊断有:①气管-支气管淀粉样变,临床中以多个黏膜下结节状病灶突向管腔内最多见,其次是局灶性瘤块样结节,而弥漫浸润型最少见,可累及膜部,可继发钙化、骨化,一般不扩展至支气管壁外。病变常围绕血管沉积,致使血管脆性增加并且收缩性减弱,故咯血颇为常见,特征性是病变组织行活检经刚果红染色呈阳性;②支气管结石病:指在气道内存在类似砂石样钙化物质,常来源于钙化的淋巴结侵蚀支气管并进入支气管腔内,CT 有助于结石的显示,气管镜下可显示支气管结石本身;③复发性多软骨炎,是累及软骨和其他全身结缔组织的一种少见疾病,常伴有耳、鼻、眼、关节等器官受累症状,支气管镜下可见气管及支气管软骨坍塌沉陷,气道内黏膜平滑无结节;④支气管乳头状瘤,往往生长在支气管近端,气管镜下呈息肉样肿物突向于管腔内,有短蒂附着在支气管壁上,肺外周者极罕见,镜检肿瘤由鳞状化生的细胞乳头状增生所构成;⑤支气管内膜结核,气管镜下可观察到病变黏膜增生,纤维瘢痕性狭窄,管壁可有结节样突起导致管腔粗糙、扭曲变形甚至出现僵直,膜部常受累及,影像学可有肺结核和肺门淋巴结肿大征象,病理为肉芽肿性炎;⑥气管、支气管软骨钙化,属老年性生理钙化,患者临床表现不明显,气管软骨环钙化导致气管壁弹性降低,支气管镜下无结节样突起表现[20]。
目前对TO尚无特别有效的治疗方案,且缺乏标准化的治疗指南,主要是对有症状患者进行对症支持治疗。通常以抗感染、解痉、止咳、化痰等原则作为主要处理形式。长期使用吸入性糖皮质激素可降低气道炎性反应继而逆转气管黏膜上皮细胞的化生,对早期 TO 患者的症状有一定的改善作用并可能具有良好的治疗效果。但其使用剂量没有制定统一标准,并且远期治疗效果尚不能确定[21]。倘若病变导致管腔严重狭窄或屡屡出现阻塞性肺炎可选择支气管镜下介入治疗,如冷冻、氩气刀、激光气化、放射、气道支架植入、镜下摘除结节等治疗[22]。Jabbardarjani等[2]对 10 例TO 患者采用激光气化治疗并对其随访6~72个月,观察到患者的临床症状和肺功能均有显著改善,但样本量较小。因此有必要作多中心的大规模研究来进一步完善和评估每种诊疗手段对TO的作用。此外,防止吸入化学性烟雾、粉尘、油烟等刺激性气体,对该病的预防以及延缓疾病进展可能会有疗效。
TO 是一种良性病变,病程较长,但预后较好,目前尚无报告本病直接导致死亡的事件。该病无典型的临床症状和体征,其诊断主要依据影像学表现、支气管镜下观察到的特征性的图像和组织病理学诊断。尤其是在判读胸部 CT 时要注意气管内有无斑点钙化状突起影像,这对进一步行支气管镜检查具有重要提示作用。由于本病症状不典型,易被漏诊、误诊,故临床医师需提高对本病的认识。
1 Cronfton J, Douglas A. Respiratory disease[M]. Philade-phia: Black Well Scientific Publications Ltd, 1969: 639-641.
2 Jabbardarjani HR, Radpey B, Kharabian S, et al. Tracheobroncheopathia osteochondroplastica: presentation of ten cases and review of the literature[J]. Lung, 2008, 186(5): 293-297.
3 Nienhuis DM, Prakash UB, Edell ES, et al. Tracheobronchopathia osteochondroplastica[J]. Ann Otol Rhinol Laryngol, 1990, 99(9Pt1): 689-694.
4 Simsek PO, Ozcelik U, Demirkazik F, et al. Tracheobronchopathia osteochondroplastica in a 9-year-old girl[J]. Pediatr Pulmonol, 2006, 41(1): 95-97.
5 Sakula A. Tracheobronchopathia osteoplastica: its relationship to primary tracheobronchial amyloidosis[J]. Thorax, 1968, 23(1): 105-110.
6 Jones AW, Chatterji AN. Primary tracheobronchial amyloidosis with tracheobroncheopathia osteoplastica[J]. Br J Dis Chest, 1977, 71(4): 268-272.
7 朱筱慧, 蒋雄斌, 王继旺, 等. 骨化性气管支气管病二例并文献复习[J]. 江苏医药, 2014, 10(21): 2614-2616.
8 Jepsen O, Sorensen H. Tracheopathia osteoplastica and ozaena[J]. Acta Otolaryngol, 1960, 51: 79-83.
9 Tajima K, Yamakawa M, Katagiri T, et al. Immunohistochemical detection of bone morphogenetic protein-2 and transforming growthβ-1 in tracheopathia osteochondroplastica[J]. Virchows Arch, 1997, 431(5): 359-363.
10 Leske V, Lazor R, Coetmeur D, et al. Tracheobroncheopathia osteochondroplastica:a study of 41 patients[J]. Medicine(Baltimore), 2001, 80(6): 378-390.
11 Harma RA, Suurkari S. Tracheopathia chondro-osteoplastica. A clinical study of thirty cases[J]. Acta Otolaryngol, 1977, 84(1-2): 118-123.
12 Williams SM, Jones ET. General case of the day: tracheo-broncheopathia osteochondroplastica[J]. Radiographics, 1997, 17(3): 797-799.
13 Manning JE, Goldin JG, Shpiner RB, et al. Case report: tracheobroncheopathia osteochondroplastica[J]. Clin Radiol, 1998, 53(4): 302-309.
14 Garg R, Kushwaha RA, Goel MM, et al. An Unusual Cause of Respiratory Distress: Solitary Tracheopathia Osteochondoplastica-AR are Entity[J]. J Bronchology Interv Pulmonol, 2015, 22(3): 274-277.
15 Tadjeddein A, Khorgami Z, Akhlaghi H. Tracheobronchopathia osteoplastica: cause of difbcu1t tracheal intubation[J]. Ann Thorac Surg, 2006, 81(4): 1480-1482.
16 Abu-Hijleh M, Lee D, Braman SS. Tracheobronchopathia osteoehondroplastica:a rare large airway disorder[J]. Lung, 2008, 186(6): 353-359.
17 Matsuba T, Komori M, Matsunaga R, et al. A case of tracheobronchopathia osteochondroplastica: diagnosed by fiberoptic bronchoscopy upon removal of an aspirated crow[J]. Diagn Ther Endosc, 2001, 7(2): 63-67.
18 Huang CC, Kuo CC. Chronic cough:tracheobronchopathia osteochondroplastica [J]. CMAJ, 2010, 182(18): E859.
19 王彩英, 张映铭, 张海涛, 等. 骨化性气管支气管病一例[J]. 中华结核和呼吸杂志, 2013, 36(5): 381-382.
20 White BD, Kong A, Khoo E, et al. Computed tomography diagnosis of tracheobronchopathia osteochondroplastica[J]. Australas Radiol, 2005, 49(4): 319-321.
21 谢宝松, 陈愉生, 岳文香, 等. 吸入糖皮质激素治疗骨化性气管支气管病三例 [J]. 中华结核和呼吸杂志, 2008, 31(10): 786-788.
22 邢西迁, 魏星, 刘艳红, 等. 骨化性气管支气管病 2 例报告并文献复习 [J]. 中国内镜杂志, 2012, 2(18): 214-216.

