晚发型重度难治性哮喘气道炎症表型与激素疗效的临床研究
刘振千 王凡 陈韦 韩志海
重度难治性哮喘(简称重度哮喘)是哮喘的一种特殊亚型,尽管给予高剂量激素吸入甚至全身激素及长效β受体激动剂治疗,仍难以控制,它虽只占不到全部哮喘的10%,但却有较高的门急诊就医及住院率,消耗了大量的医疗资源[1-2]。在成人中可发现较多的重度哮喘,且为非过敏性的,以女性居多[3]。有研究发现,重度哮喘气道表现为低Th2(Th2low)型的中性粒细胞性炎症[4-5]。与嗜酸细胞性的高Th2(Th2high)型炎症不同,吸入性糖皮质激素对Th2low性哮喘的疗效尚存争议,有些研究认为其对激素治疗无反应,而有些则认为与Th2high反应相同[6-9]。 而Th2high型哮喘往往具有特异质和IgE介导的嗜酸细胞性炎症,总体上激素治疗有效,是最常见的病理亚型,多见于儿童早发型哮喘。为揭示成人重度哮喘的发病机制,本研究对成年发病的重度哮喘患者进行了前瞻性研究,以明确该类患者的气道炎症类型、炎性介质的水平及对激素的治疗反应。
对象与方法
一、研究对象
选择2013 年1月至2016年1月在我院门诊、急诊及住院治疗成人急性加重哮喘患者,共146例,其中晚发型哮喘患者轻中度哮喘患者104例为轻中度组,重度患者42例为重度组(28.7%),全部均完成吸入或吸入加全身激素治疗实验。选择同期30例健康体检者入为正常对照组。诊断和病情严重度分级按中华医学会呼吸病学分会制定的支气管哮喘防治指南及重度难治性哮喘的定义[10-11]。入 选 病 例 标准 为:大于18岁后首次发病的哮喘患者,无吸烟史或戒烟已1年以上,近6周内无呼吸道感染 ,无其他严重疾患。入选者均签署知情同意书。
二、研究方法
评估并记录入选哮喘患者的基线情况,包括一般情况、病史、体征、胸部影像学检查、肺功能、哮喘严重程度及哮喘症状控制评分(asthma control test, ACT)等。测定治疗前诱导痰炎性细胞数量、分类及上清液白细胞介素-17(interleukin-17,IL-17)、IL-8、IL-6、IL-5浓度,及中性粒细胞弹性蛋白酶活性,其后根据病情给予不同剂量糖皮质激素吸入或全身激素治疗,并辅以其他治疗。治疗4周后,再次对诱导痰进行细胞分类计数并复测IL-17等炎性介质的浓度,复查患者肺功能、哮喘控制评分等。以痰液中嗜酸性粒细胞≥/<2%及中性粒细胞≥/<61%为界点定义嗜酸性或中性粒细胞性哮喘即[12-13]:嗜酸性粒细胞≥2%,中性粒细胞<61%为嗜酸粒细胞性哮喘;嗜酸性粒细胞<2%,中性粒细胞≥61%则为中性粒细胞性哮喘;而嗜酸性粒细胞及中性粒细胞比例均超过界点的,为混合性哮喘;两种细胞比例均小于界点的则为寡细胞性哮喘。
依据文献[14]方式进行诱导痰处理。应试者首先吸入沙丁胺醇200 μg,10 min后雾化吸入4%高渗盐水40 ml,收集30 min内全部痰液。去除唾液成分,痰液计量后加入相当于痰液重量1.2倍体积的0.1%二硫苏糖醇,震荡15 min混匀。以离心半径8 cm,2 000 r/min离心10 min,-70 ℃保存上清液用以检测。细胞沉淀层涂片,瑞氏-吉姆萨染色后高倍镜下计数300~500有核细胞(上皮除外),计算有核细胞比例。
IL-6及IL-8(eBioscience公司,美国)、IL-17和IL-5(R&D公司,美国)的测定采用酶联免疫吸附试验(ELISA),参照试剂盒说明书操作。应用免疫捕获活性试剂盒(Calbiochem公司,美国)测定中性粒细胞弹性蛋白酶活性。
三、统计学方法
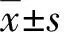
结 果
一、临床基线情况评估
哮喘患者的肺功能如FEV1及FVC等明显低于正常对照者,轻中度哮喘组的特应质比例高于重度哮喘组及正常对照者。重度哮喘组的年龄和BMI较轻中度组及正常对照者为高(P<0.01)。正常对照组与哮喘组间合并疾患的数量无差异,但在重度哮喘组心血管及糖尿病的比例明显高于轻中度组,见表1。
二、激素治疗前后诱导痰炎性细胞及炎性介质的改变
依据前述标准,激素治疗前,轻中度组中有60例患者符合嗜酸细胞性哮喘诊断,寡细胞性20例,混合性为16例,而中性粒细胞性哮喘仅有8例。激素治疗4周后,轻中度哮喘组中有12例嗜酸细胞性哮喘转变为寡细胞性,另8例混合性则成为嗜酸细胞性,余分型保持不变。
重度哮喘组中,中性粒细胞性哮喘有17例,嗜酸粒细胞性16例,混合性6例,寡细胞性3例。有7例嗜酸性粒细胞哮喘治疗后转为混合性,2例转为寡细胞性,仅有2例中性粒细胞性哮喘。3例混合性哮喘患者治疗后转为嗜酸细胞性哮喘。而3例寡细胞性哮喘治疗后则均转为中性粒细胞性哮喘,见表2。

表2 哮喘患者治疗前后气道炎症分型
与正常对照组相比,无论轻中度还是重度哮喘,其气道内嗜酸细胞比例均明显升高,同时轻中度哮喘气道的嗜酸细胞比例高于重度哮喘,见表3。而轻中度组气道的中性粒细胞比例则低于正常对照,但重度组的比例则明显高于轻中度组及对照组(P<0.01)。经皮质激素治疗后,轻中度组气道的嗜酸细胞及中性粒细胞比例均较前明显降低,而重度组治疗后气道嗜酸细胞比例显著降低,但中性粒细胞比例却轻度升高(P<0.05)。
无论轻中度还是重度哮喘,其气道IL-5、6、8、17及弹性蛋白酶的浓度均明显高于正常对照者。与轻度哮喘相比,治疗前的重度哮喘患者痰液上清中IL-6、IL-8、IL-17浓度及中性粒细胞弹性蛋白酶含量明显高于轻度组。相反,IL-5的浓度则明显低于轻度组,见表4。激素治疗后,轻度组IL-5、IL-6、IL-8、IL-17及中性粒细胞弹性蛋白酶的浓度都明显降低,而重度组仅IL-5浓度有显著下降, IL-17等其余炎性介质浓度均无改变。相关分析显示,痰液中性粒细胞的比例与IL-17、IL-8的浓度呈正相关(r分别为0.545及0.360,P<0.01),但与IL-17浓度相关性更大。而痰液中中性粒细胞弹性蛋白酶的浓度与中性粒细胞所占比例及IL-17、IL-8浓度呈正相关(r分别为0.637、0.978、0.698,P<0.01)。
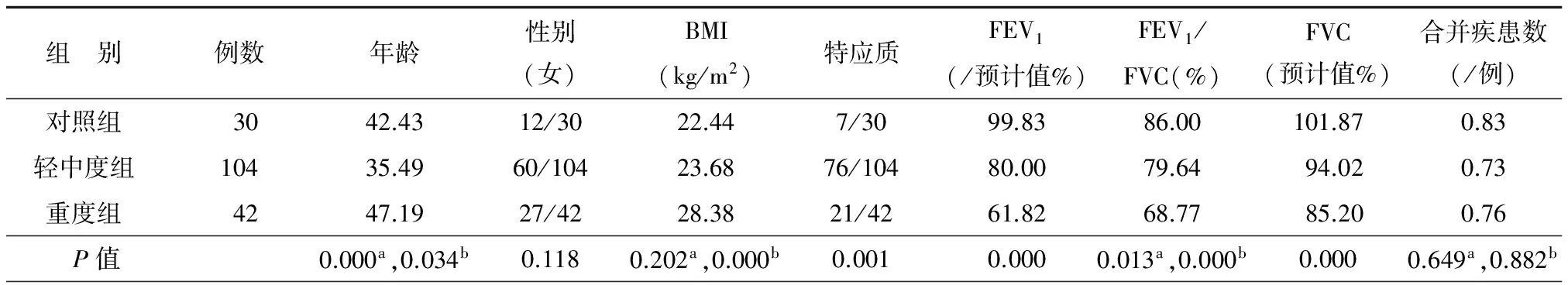
表1 哮喘患者一般资料和临床基线评估的比较
注:a为轻中度组与正常组比较;b为重度组与轻中度组及正常组比较;无标记者为三组间比较

表3 治疗前后痰液中细胞成分的改变
注:a为与正常对照组比较,P<0.01;b为与轻中度组比较,P<0.01;c为治疗后与治疗前相比,P<0.05

表4 激素治疗前后痰液中炎性介质的变化
注:a为与正常对照组比较,P<0.01;b为与轻中度组比较,P<0.01;c为治疗后与治疗前相比,P<0.05
三、影响哮喘控制水平的相关因素
激素治疗后,轻中度组的ACT评分及FEV1均较治疗前获得明显提高,见表5,而重度组仅FEV1获得轻度改善,ACT评分无好转。直线回归分析显示,ACT评分与痰液中IL-17浓度、BMI呈负性关系(回归方程ACT=28.323~0.267IL17-0.423BMI,P<0.01),即随着痰中IL-17浓度升高以及BMI增加,ACT评分逐渐降低。而肺功能FEV1占预计值的水平则与痰液中中性粒细胞比例呈负相关(r=-0.546,P<0.01),即随着中性粒细胞比例的增加,哮喘患者FEV1占预计值的比例逐渐降低。

表5 治疗前后ACT评分及FEV1的比较
讨 论
重度哮喘是指需高剂量吸入激素并加用第二种控制性用药,和/或全身性应用皮质激素方可控制或仍未能控制的哮喘[15]。近些年随着对重度哮喘气道炎症分型及其代表的分子生物标记物的深入研究发现,重度哮喘可以分成不同的亚型,如早发型过敏性哮喘、晚发型嗜酸性粒细胞型哮喘和晚发型中性粒细胞型等。各种亚型所表现出的气道炎症特点迥然不同,但又有重叠之处[16]。正是不同分子生物机制导致的不同亚型,才使得哮喘对激素治疗出现了不同的反应,而且也使得临床表现轻重不一。本研究收集的146余例患者中,重度哮喘占近1/3。这些重度哮喘患者不仅肺功能FEV1、ACT评分明显低于轻中度患者,且激素治疗后的病情改善程度亦不及后者。
本研究主要考察了临床中最常见的成人晚发型哮喘,观察其轻中度及重度哮喘的分布情况,并重点研究了其气道炎症类型以及对激素治疗的反应,以揭示该型重度哮喘的可能发病机制。本研究发现:①未治疗的轻中度哮喘气道炎症以嗜酸性粒细胞为主,而重度哮喘则中性粒细胞及嗜酸性粒细胞两者皆有,且中性粒细胞居多;②激素吸入治疗虽可控制重度哮喘患者以嗜酸细胞为主的Th2型气道炎症,但对中性粒细胞性炎症无效,故哮喘的整体控制不佳。
研究表明,中性粒细胞是重度哮喘气道炎症的重要组成成分,是重度难治性哮喘的发病机制之一[17-18]。但也有学者认为,哮喘气道内中性粒细胞数量的增多,是由于治疗中糖皮质激素的应用,使中性粒细胞凋亡延迟的结果,此外,吸烟的哮喘患者其气道内中性粒细胞数量亦可明显增加,故中性粒细胞在哮喘气道炎症中的作用尚存争议[19-21]。本研究结果显示,吸入激素仅降低了轻中度哮喘的气道炎症介质水平,进而提高哮喘控制水平及FEV1,但对重度哮喘,除嗜酸细胞及IL-5降低外,其余炎症介质的浓度及哮喘控制水平均无改善。这提示无论是嗜酸粒细胞性哮喘还是非嗜酸粒细胞性哮喘(中性粒细胞为主型),吸入激素都可以对以嗜酸细胞为主的Th2型炎症获得良好的控制,但重度哮喘由于存在复杂的炎症成分,特别是中性粒细胞性炎症,故激素难以发挥作用,导致其临床症状控制不佳,这在其它研究中也有证实[7-9]。需注意的是,重度组哮喘经4周高剂量激素吸入及部分患者的全身皮质激素治疗后,气道内中性粒细胞比例有轻度升高,且炎症表型集中向中性粒细胞性转化,提示大剂量吸入或全身激素的应用,可能会引起气道内中性粒细胞的凋亡延迟,导致气道炎症无改善,是重度哮喘控制不佳的一个可能原因。
基于对传统Th1/Th2理论的突破,新的研究认为,Th17细胞和调节性T细胞及其代表性细胞因子IL-17、IL-10等在哮喘的发病中起到重要作用,特别是Th17分泌的IL-17,作为前炎症介质可以促进IL-6、IL-8的高表达,趋化中性粒细胞向气道内聚集形成Th2low型炎症,并参与气道的重宿,是重度难治性哮喘的重要发病机制[22-24]。本研究中,治疗前重度哮喘患者痰液内IL-17浓度明显增高,且气道内中性粒细胞比例亦与IL-17浓度呈正相关,激素治疗后IL-17仍未能降低,导致哮喘的临床控制如ACT评分、FEV1水平未能提高,因此气道内IL-17是影响重度哮喘预后的重要指标[24-25]。
重度难治性哮喘的标志就是激素治疗效果不佳[11]。研究发现,IL-17水平升高是重度哮喘激素治疗不敏感的重要发病机制[22-23]。体外实验证实,地塞米松可显著抑制淋巴细胞的Th2相关细胞因子的释放,但对IL-17的产生无作用[26]。且地塞米松在体外甚至可促进和维持Th17 的分化,增加IL-17的表达[27]。IL-17除可趋化中性粒细胞外,还可上调糖皮质激素受体β的表达,导致外周血单个核细胞的激素抵抗。而维生素D能以非激素依赖的方式降低重度哮喘患者IL-17的产生[28-29]。在本研究中,轻中度组哮喘气道内IL-17经激素治疗后浓度较前降低,ACT评分及FEV1亦获得改善,而重度哮喘则无变化,系由于轻中度哮喘气道炎症以嗜酸性粒细胞为主,故激素可取得良好的临床疗效如FEV1和ACT的改善。至于为何激素能降低轻中度哮喘气道内IL-17浓度,而重度哮喘则未然,尚不清楚其机制,值得深入探讨。
针对哮喘不同气道炎症亚型对激素治疗的不同反应及相应的分子机制,目前已开发出了多种分子生物治疗方式,虽尚不能完全解决临床问题,但已显现出广阔的前景。如抗IL-5特异性抗体(Mepolizumab),可明显降低重度难治性嗜酸粒细胞型哮喘的急性加重发生率,改善患者生活质量[30-32]。此外,该抗体还可降低激素依赖型哮喘患者的全身激素用量,且减少因降低激素用量而导致的急诊就医、住院率等[33]。而针对中性粒细胞性炎症的抗IL-17单克隆抗体Brodalumab, 能阻止IL-17相关的下游中性粒细胞的募集,并可使部分患者FEV1有20%以上的改善,使无症状天数和哮喘控制得到提升[34]。白细胞表面的CXCR受体通过与Th1途径的细胞因子结合,可活化和募集中性粒细胞至炎症部位,其拮抗剂SCH527123可选择性结合CXCR2,能使重度哮喘患者痰液的中性粒细胞数平均减少36%,并减少哮喘症状的恶化、PEF的降低及缓解性用药的使用[35-36]。
总之,探讨哮喘气道炎症分型的最终目的是指导治疗方式的选择,对任何新出现的治疗方式都不应千篇一律不加区分地使用,而应遵循哮喘分型和生物标记物的检测,这样才能提高重度哮喘的控制水平。
1 Canonica GW, Senna G, Mitchell PD, et al. Therapeutic interventions in severe asthma[J]. World Allergy Organ J, 2016, 9(1): 40.
2 Ivanova JI, Bergman R, Birnbaum HG, et al. Effect of asthma exacerbations on health care costs among asthmatic patients with moderate and severe persistent asthma[J]. J Allergy Clin Immunol, 2012, 129(5): 1229-1235.
3 Global Strategy for Asthma Management and Preventation 2014(Revision).
4 Trevor JL, Deshane JS. Refractory asthma: mechanisms, targets, and therapy[J]. Allergy, 2014, 69(7): 817-827.
5 Gauthier M, Ray A, Wenzel SE. Evolving concepts of asthma[J]. Am J Respir Crit Care Med ,2015,192(6): 660-668.
6 Carr TF, Bleecker E. Asthma heterogeneity and severity[J]. World Allergy Organ J, 2016, 9(1): 41.
7 Berry M, Morgan A, Shaw DE, et al. Pathological features and inhaled corticosteroid response of eosinophilic and non-eosinophilic asthma[J]. Thorax, 2007, 62(12): 1043-1049.
8 Denlinger LC, Phillips BR, Ramratnam S, et al. Inflammatory and comorbid features of patients with severe asthma and frequent exacerbations[J]. Am J Respir Crit Care Med, 2017, 195(3): 302-313.
9 Fajt ML, Wenzel SE. Development of new therapies for severe asthma [J]. Allergy Asthma Immunol Res, 2017, 9(1): 3-14.
10 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗及教育和管理方案) [J]. 中华结核和呼吸杂志, 2003, 26(3): 132-138.
11 中华医学会呼吸病学分会哮喘学组. 难治性哮喘诊断与处理专家共识[J]. 中华结核和呼吸杂志, 2010, 33(8): 572-577.
12 Simpson JL, Scott R, Boyle MJ, et al. Inflammatory subtypes in asthma: assessment and identification using induced sputum[J]. Respirology, 2006, 11(1): 54-61.
13 Reddel HK, Taylor DR, Bateman ED, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice[J]. Am J Respir Crit Care Med, 2009, 180(1): 59-99.
14 Pavord ID, Pizzichini MM, Pizzichini E, et al. The use of induced sputum to investigate airway inflammation[J]. Thorax,1997, 52(6): 498-501.
15 Chung KF, Wenzel S. European Respiratory Society/American Thoracic Society Severe Asthma International Guidelines Task Force. From the authors: International European Respiratory Society/American Thoracic Society guidelines on severe asthma[J]. Eur Respir J, 2014, 44(5): 1378-1379.
16 Opina MTD, Moore WC. Phenotype-driven therapeutics in severe asthma[J]. Curr Allergy Asthma Rep, 2017, 17(2): 10.
17 Moore WC, Hastie AT, Li X, et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis[J]. J Allergy Clin Immunol, 2014, 133(6): 1557-1563.
18 Shaw DE, Sousa AR, Fowler SJ, et al. Clinical and inflammatory characteristics of the European UBIOPRED adult severe asthma cohort[J]. Eur Respir J, 2015, 46(5): 1308-1321.
19 Simpson JL, Grissell TV, Douwes J, et al. Innate immune activation in neutrophilic asthma and bronchiectasis[J]. Thorax, 2007, 62(3): 211-218.
20 Cowan DC, Cowan JO, Palmay R, et al. Effects of steroid therapy on inflammatory cell subtypes in asthma[J]. Thorax, 2010, 65(5): 384-390.
21 Chalmers GW, MacLeod KJ, Thomson L, et al. Smoking and airway inflammation in patients with mild asthma[J]. Chest, 2001, 120(6): 1917-1922.
22 Al-Ramli W, Pre′fontaine D, Chouiali F, et al. T(H)17-associated cytokines (IL-17A and IL-17F) in severe asthma[J]. J Allergy Clin Immunol, 2009, 123(5): 1185-1187.
23 Fajt ML, Wenzel SE. Asthma phenotypes and the use of biologic medications in asthma and allergic disease: the next steps toward personalized care[J]. J Allergy Clin Immunol, 2015, 135(2): 299-310.
24 Chesne G, Braza F, Mahay G, et al. IL-17 in severe asthma. Where do we stand? [J]. Am J Respir Crit Care Med, 2014, 190(10): 1094-1101.
25 Woodruff PG, Modrek B, Choy DF, et al. T-helper type 2-driven inflammation defines major subphenotypes of asthma[J]. Am J Respir Crit Care Med, 2009, 180(5): 388-395.
26 McKinley L, Alcorn JF, Peterson A, et al. Th17 cells mediate steroid-resistant airway inflammation and airway hyperresponsiveness in mice[J]. J Immunol, 2008, 181(6): 4089-4097.
27 Zhao J, Lloyd CM, Noble A. Th17 responses in chronic allergic airway inflammation abrogate regulatory T-cell-mediated tolerance and contribute to airway remodeling[J]. Mucosal Immunol, 2013, 6(2): 335-346.
28 Vazquez-Tello A, Halwani R, Hamid Q, et al. Glucocorticoid receptor-beta up-regulation and steroid resistance induction by IL-17 and IL-23 cytokine stimulation in peripheral mononuclear cells[J]. J Clin Immunol, 2013, 33(2): 466-478.
29 Nanzer AM, Chambers ES, Ryanna K, et al. Enhanced production of IL-17A in patients with severe asthma is inhibited by 1a, 25-dihydroxyvitamin D3 in a glucocorticoid independent fashion[J]. J Allergy Clin Immunol, 2013, 132(2): 297-304.
30 Haldar P, Brightling CE, Hargadon B, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma[J]. N Engl J Med, 2009, 360(10): 973-984.
31 Menzella F, Lusuardi M, Galeone C, et al. Mepolizumab for severe refractory eosinophilic asthma: evidence to date and clinical potential[J]. Ther Adv Chronic Dis, 2016, 7(6): 260-277.
32 Castro M, Zangrilli J, Wechsler ME, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials[J]. Lancet Respir Med, 2015, 3(5): 355-366.
33 Bel EH, Wenzel SE, Thompson PJ, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma[J]. N Engl J Med, 2014, 371(13): 1189-1197.
34 Busse WW, Holgate S, Kerwin E, et al. Randomized, double-blind, placebo-controlled study of brodalumab, a human anti-IL-17 receptor monoclonal antibody, in moderate to severe asthma[J]. Am J Respir Crit Care Med, 2013, 188(11): 1294-1302.
35 Nair P, Gaga M, Zervas E, et al. Safety and efficacy of a CXCR2 antagonist in patients with severe asthma and sputum neutrophils: a randomized, placebocontrolled clinical trial[J]. Clin Exp Allergy, 2012, 42(7): 1097-1103.
36 Petsky HL, Li A, Chang AB. Tailored interventions based on sputum eosinophils versus clinical symptoms for asthma in children and adults[J]. Cochrane Database Syst Rev, 2017, 8: CD005603.

