以品种为核心的仿制药一致性评价工作模式探讨
龚前飞+张小红+刘朋+吴斌+陈一飞+张景辰+陈桂良
摘 要 在深化药品审评审批制度改革新形势下,本文探讨以品种为核心的仿制药质量和疗效一致性评价工作模式。以总局2017年第100号公告要求为依据,结合其他相关的政策要求,分析讨论上海药品审评核查中心如何在一致性评价工作中实现监管和服务两方面的职能,形成以品种为核心的监管职能和服务工作的清单,为今后的工作积累经验。
关键词 仿制药一致性评价 监管 服务
中图分类号:R951 文献标识码:C 文章编号:1006-1533(2018)03-0016-03
Discussion of the product based supervision mode for the quality and efficacy consistency evaluation of generics
GONG Qianfei*, ZHANG Xiaohong, LIU Peng, WU Bin, CHEN Yifei, ZHANG Jingchen**, CHEN Guiliang
(Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China)
ABSTRACT In order to improve the supervision efficiency, we are trying to develop a product based supervision mode for the quality and efficacy consistency evaluation of generic drug. Based on the requirements of Announcement No. 100 of 2017 from CFDA and other relevant policy requirements, Shanghai Center for Drug Evaluation and Inspection is continuously improving its work strategy in order to better take the responsibilities on both supervision and service, listing the working responsibilities of Shanghai Center for Drug Evaluation and Inspection, and providing experience for future work.
KEY WORDS consistency evaluation of generics; supervision; service
仿制药质量和疗效一致性评价(以下简称“一致性评价”)工作作为药品审评审批制度改革任务的重要组成部分,一直是上海药品审评核查中心(以下简称“中心”)的核心工作之一。中心积极探索以品种为核心的一致性评价工作模式,力争更高效地推进一致性评价工作。以品种为核心的工作模式强调对品种全生命周期的理解和管理,结合药品上市许可持有人制度(marketing authorization holder, MAH)實现品种持有人和药监部门对特定品种的全方位管理和监督。对品种历史沿革、再评价开发研究历程、注册申报进程、关键原辅包质量、关键生产工艺与参数、产品关键质量属性、经营销售情况、产品监管历史等资料的整合和分析,形成品种档案,以支持监管和服务的实施,同时用监管和服务信息进一步完善品种档案。
2015年8月,国务院发布《关于改革药品医疗器械审评审批制度的意见》[1],正式拉开药品医疗器械审评审批改革的大幕。2017年10月8日,中共中央办公厅、国务院办公厅发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[2],再次强调了一致性评价的重要性。其间在2017年8月25日,《总局关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017年第100号,以下简称“公告”)公布[3]。该公告对一致性评价工作各环节进行优化调整,旨在保障受理、检查、检验和审评等环节顺畅衔接,保障评价标准统一[4]。为切实落实好公告要求,积极推进公告中对一致性评价工作的部署,本文探索在深化药品审评审批制度改革新形势下,中心以品种为核心的服务和监管工作新模式。
1 公告简介
公告内容主要对一致性评价受理、审评、核查、检验等工作程序进行了调整,并对前期文件部分未明确事宜进行了补充,针对部分文件[5-7]中有关内容根据前期一致性评价开展情况进行了调整。
对公告内容进行梳理,不难发现其主要涵盖如下四个方面的内容。第一是关于参比制剂的选择和获得。公告进一步优化参比制剂选择顺序,同时提出在参比制剂的获得上企业可自行购买,但需证明其真实性。第二是关于临床试验的机构选择和生物等效性试验(bioequivalency, BE)豁免。明确BE备案制管理、BE豁免申请的原则和流程。企业可在未经认定但具备条件的机构进行BE试验,由企业聘请具评估能力的第三方对机构进行评估。第三是明确一些特殊品种的申报要求,包括原研企业在中国境内生产上市的品种、已上市和已申报符合一致性评价技术要求的品种和欧美日上市品种。第四是明确一致性评价品种申报流程。由省局受理调整为总局集中受理,总局药品审评中心(Center for Drug Evaluation, CDE)在立卷审查的基础上,提出有因核查和抽检需求,并转由总局审核查验中心(Center for Food and Drug Inspection, CFDI)实施。除上述四方面内容外,公告还明确复核检验工作要求、重申通过评价后相关鼓励政策、强调监管人员的保密责任、公布“通过一致性评价标识”、工作时限要求等。endprint
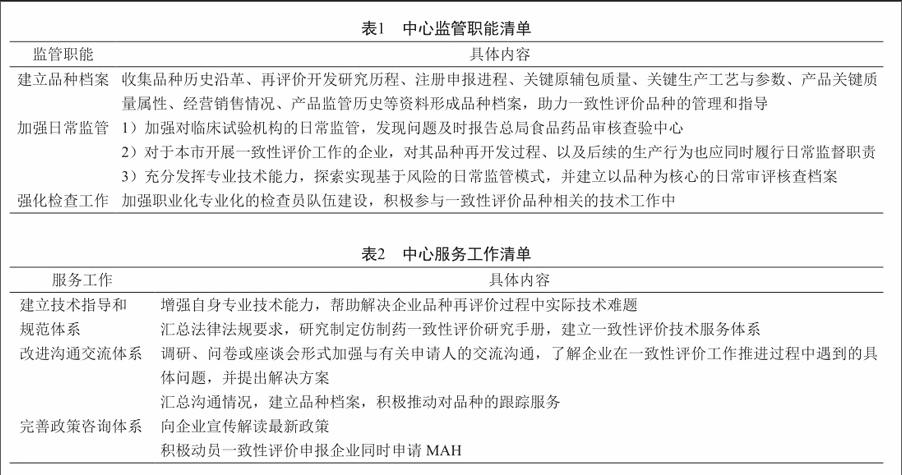
本文在总局100号公告以及前期和最新发布的一系列文件的基础上,以品种为核心,充分发挥中心专业技术优势,积极探索中心在一致性评价工作中可以发挥的监管职能以及为申请人提供的相关服务工作,形成了中心监管职能清单和服务工作清单(表1、表2)。
2 中心监管职能探讨
根据总局发布的数据以及在本市实际调研统计结果显示,上海需进行一致性评价工作涉及63家企业,685个品种文号,本市一致性评价监管工作任务艰巨。在此背景下中心积极履行对辖区内一致性评价工作的监管职责。
2.1 建立品种档案
以品种为核心的工作模式,基础是建立详细的品种档案。针对辖区内一致性评价品种,为实现以品种为核心的监管,探索在中心建立品种档案,收集品种历史沿革、再评价开发研究历程、注册申报进程、关键原辅包质量、关键生产工艺与参数、产品关键质量属性、经营销售情况、产品监管历史等资料,对重点品种评价进程进行跟踪,对企业拟放弃的品种进行问题分析,并为品种今后的日常监管提供参考信息。结合现代化电子设备和互联网资源,探索实现品种档案的电子化建立及管理,实现数据化处理和查询,助力辖区内一致性评价工作大数据的收集和建立。
2.2 加强日常监管
公告明确提出省级食品药品监管部门加强对临床试验机构的日常监管,发现问题及时报告国家局核查中心。同时对于本市开展一致性评价工作的企业,对其品种再开发过程、以及后续的生产过程也应同时履行日常监督职责。在日常监管中,中心可充分发挥专业技术能力,探索实现基于风险的日常监管模式,并建立以品种为核心的日常审评核查档案。
2.3 强化检查工作
强化检查工作,提升检查水平,离不开职业化专业化检查员队伍。围绕一致性评价品种研究的特点,加强有针对性的培训,建设职业化专业化检查员队伍。目前中心已具有一批专业技术过硬、现场核查经验丰富的国家级检查员,参加了CFDI组织的首批一致性评价有因现场检查工作[8]。通过加强技术培训、资深检查员“传帮带”、加强实习锻炼等方式,加快中心职业化专业化检查员队伍的壮大,更快地在一致性评价工作中发挥中心技术监管的优势。
3 中心服务工作探讨
作为省级药品监管部门的技术中心,对辖区内相关企业实现基于品种的技术支撑和政策服务同样是中心的职责所在。通过各项服务体系,汇集品种个性化问题,纳入品种档案,更好地服务于以品种为核心的一致性评价服务和监管工作。
3.1 建立技术指导和规范体系
针对企业在具体品种一致性评价过程中遇到的实际问题,中心在不断更新自身专业技术能力基础上,帮助解决企业品种再评价过程中实际技术难题。国家发改委提出将支持药品专业化咨询、研发、生产、应用示范服务平台建设[9]。中心借助自身技术优势,汇总法律法规要求,结合品种实际问题,分析提出解决方案,正在研究制定仿制药一致性评价研究手册,积极推进辖区内一致性评价技术服务体系建设。
该研究手册由一系列的文件组成,包括如《仿制药质量和疗效一致性评价申报指南》、《品种专论研究要点》、《溶出度试验开发与验证指导原则》、《基于BCS的普通口服固体常释制剂生物等效性试验豁免的量化风险评估》等。其中,《仿制药质量和疗效一致性评价申报指南》对企业开展参比制剂遴选、药学研究、临床试验、注册申报、现场核查等一系列工作进行全方位的指导,规范品种一致性评价工作;《品种专论研究要点》则按照品种技术要求的不同对品种进行分类,选取个别具有代表性的品种制订技术要点,关注品种关键技术问题;《溶出度试验开发与验证指导原则》针对需进行溶出度检测的品种,对体外研究重点内容溶出度试验的开发和验证提出指导意见;《基于BCS的普通口服固体常释制剂生物等效性试验豁免的量化风险评估》聚焦品种BE豁免技术要求,建立口服固体常释制剂的生物等效性试验豁免的量化风险评估方法。
3.2 改进沟通交流体系
改进与企业的沟通交流体系,提高基于品种的监管服务工作效率。在一致性评价工作过程中,通过多种形式加强沟通,了解品种具体问题。汇总企业提出的问题并分类分析,可以解决的提出具体解决方案,不能解决的向有关部门反馈或召开相关专家会议予以解决,并将有关情况记录在品种档案里。后续在建立品种档案的基础上,积极推动对品种的跟踪服务,并及时进行汇总分析,总结经验。
3.3 完善政策咨询体系
随着改革工作的不断深入,总局根据实际形势对部分政策进行了调整。因此有必要加强向企业进行最新政策的宣传解读。同时结合药品审评审批制度改革的要求,充分发挥上海作为MAH试点省市的优势,积极动员企业一致性评价与MAH同时申报,及早实现对品种的全生命周期管理。
4 结语
中心积极参与一致性评价工作,积极探索以品种为核心的监管和服务新模式。以日趋丰富的品种档案为基石、以充分的沟通交流为基础,实现对辖区内品种的日常监管,建设专职药品检查员队伍;加强技术指导规范体系和政策咨询体系建设服务工作。以品种为核心,借助电子智能化的发展,逐步建立完善的电子化品种档案,实现品种全生命周期的管理模式,助力企业提升在一致性评价工作中的创新,达到仿制药和原研药的质量疗效一致的要求。通过在目前口服固体制剂一致性评价工作过程中积累以品種为核心的监管和服务模式经验,可在后续将要开展的注射剂再评价工作中发挥推广作用。
参考文献
[1] 国务院. 关于改革药品医疗器械审评审批制度的意见(国发〔2015〕44号)[EB/OL]. (2015-08-18)[2017-12-19]. http://www. sda.gov.cn/WS01/CL0056/126821.html.endprint
[2] 中共中央办公厅, 国务院办公厅. 《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[EB/OL]. (2017-10-08)[2017-12-19]. http://www.gov.cn/xinwen/2017-10/08/ content_5230105.htm.
[3] 国家食品药品监督管理总局. 总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)[EB/OL]. (2017-08-25)[2017-12-19]. http://www.sfda.gov.cn/ WS01/CL1757/176734. html.
[4] 国家食品药品监督管理总局. 《关于仿制药质量和疗效一致性评价工作有关事项的公告》政策解读[EB/OL].(2017-09-20)[2017-12-19]. http://www.sda.gov.cn/WS01/ CL1790/177663.html.
[5] 国家食品药品监督管理总局. 关于发布普通口服固体制剂参比制剂选择和确定等3个技术指导原则的通告(食品药品监管总局通告2016年第61号)[EB/OL]. (2016-03-18)[2017-12-19]. http://www.sda.gov.cn/WS01/CL0087/147583. html.
[6] 国家食品药品监督管理总局. 关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告(食品药品监管总局公告2016年第106号)[EB/OL]. (2016-05-26)[2017-12-19]. http://www.sda.gov.cn/ WS01/CL0087/154042.html.
[7] 国家食品药品监督管理总局. 《关于发布仿制药质量和疗效一致性评价工作程序的公告》(食品药品监管总局公告2016年第105号)[EB/OL]. (2016-05-26)[2017-12-19]. http://www.sda.gov.cn/WS01/CL0087/154041.html.
[8] 國家食品药品监督管理总局审核查验中心. 核查中心启动首批仿制药一致性评价品种现场检查工作[EB/OL].(2017-11-29)[2017-12-19]. http://www.cfdi.org.cn/resource/ news/9566.html.
[9] 国家发展改革委. 国家发展改革委关于印发《增强制造业核心竞争力三年行动计划(2018—2020年)》的通知[EB/OL]. (2017-11-20)[2017-12-19]. http://gys.ndrc.gov.cn/ gyfz/201711/ t20171127_867955.html.endprint

