机器人与腹腔镜手术治疗早期卵巢癌的临床比较
郭芳芳,冯文娟,李冬青,齐 力,袁 勇
1. 吉林省肿瘤医院妇瘤二科,吉林 长春 130012;
2. 长春市朝阳区医院妇科,吉林 长春 130000
早期卵巢癌的治疗是以手术治疗为首选[1]。随着腹腔镜微创技术的发展和日臻成熟,腹腔镜手术在早期卵巢癌的治疗中应用也较为普及[2]。但由于卵巢癌的手术范围大、腹腔镜视觉平面化和器械灵活度欠缺,导致腹腔镜治疗早期卵巢癌的手术难度较大。2014年9月,达芬奇机器人手术系统落户吉林省肿瘤医院,吉林省肿瘤医院妇瘤科陆续开展了机器人辅助腹腔镜下的广泛全子宫切除、盆腔淋巴结清扫术及早期卵巢癌根治术等手术。为了严格把握机器人手术系统在卵巢癌手术治疗中的应用和判断治疗效果,吉林省肿瘤医院妇瘤科将该系统仅应用于临床Ⅰ期卵巢癌患者,同时选择同期腹腔镜手术治疗的Ⅰ期卵巢癌患者作为对照,对两种术式的效果进行比较分析。
1 资料和方法
1.1 临床资料
回顾性分析了2015年1月—2016年12月在吉林省肿瘤医院治疗的Ⅰ期卵巢癌患者共计22例,其中,机器人手术8例(机器人组),腹腔镜手术14例(腹腔镜组)。机器人组患者年龄35 ~ 65岁,平均(46.2±7.6)岁;腹腔镜组患者年龄30 ~ 66岁,平均(45.4±8.2)岁。22例患者根据手术-病理分期均证实为早期卵巢癌。对两组患者的一般资料(年龄、体质量指数及肿瘤大小)进行比较,同时分析两组的手术时间、术中出血量、清除淋巴结数、术后24 h腹腔引流量、术后首次肛门排气时间、术后住院时间及术后发热等并发症。
1.2 方法
1.2.1 机器人组的术前准备
术前3 d,完善血常规、尿常规、肝肾功能、心电图、全身CT等化验及影像学检查;予半流食、口服肠道消炎药、阴道消毒;术前1 d,抗生素试敏、备皮、备血、禁食水、口服复方聚乙二醇电解质散、清洁灌肠,签署手术知情同意书。术前30 min,给予留置胃管、抗生素预防感染。
1.2.2 机器人组的术前处理
患者取截石位,头低足高倾斜体位、肩托固定;双臂束于身体两侧。留置尿管;阴道内放置举宫杯。常规消毒,铺无菌洞巾。
1.2.3 机器人组的手术步骤及操作技巧
机器人组的手术步骤及操作技巧:
① 于脐上2 cm置入12 mm Trocar,建立气腹(压力12 ~15 mmHg)。结合术前检查及术中情况,满足以下条件的继续手术:无腹水或少量腹水;横膈表面、肝脏表面及全部腹膜(包括大网膜、子宫直肠陷窝及肠系膜表面)无明确肿瘤结节;肿瘤仅限于一侧或双侧卵巢。② 在镜下依据患者实际情况,确定其他穿刺孔及辅助孔,2个连接机械臂的穿刺孔(8 mm Trocar),2个辅助孔(10 mm Trocar、5 mm Trocar)。机械臂与Trocar对接后开始手术。机器人手术器械包括单极剪刀(电铲)、双极钳及持针器等。③ 抽取15 ~ 20 mL腹盆腔积液或腹腔冲洗液送检细胞学检查。自穿刺孔置入标本袋,将患侧附件置入标本袋;如双侧附件均有病变,则均置入标本袋。打开侧腹膜,明确输尿管,切断患侧骨盆漏斗韧带,切断患侧卵巢固有韧带,收紧标本袋,自腹壁取出标本,送快速病理,若回报为恶性肿瘤则继续行卵巢癌全面分期术(双附件切除+全子宫切除+盆腔淋巴结清扫+腹主动脉旁淋巴结清扫+大网膜切除+阑尾切除+多点活检术)。对于年轻欲保留生育功能的患者,需要满足以下条件:对侧卵巢外观正常,活检(-);腹腔细胞学(-);高危区(横膈表面、结肠侧窝、子宫直肠陷窝、肠系膜表面及腹膜后淋巴结)探查活检快速病理为阴性。④ 切除子宫或对侧附件。切断左、右两侧圆韧带,高位切断对侧骨盆漏斗韧带,切断卵巢血管,分离膀胱,切断左、右侧子宫血管,在宫颈外口处切开阴道穹窿,切除子宫或对侧附件,置于阴道口。⑤ 清除盆腔淋巴结。沿腰大肌外侧3 cm处打开侧盆壁腹膜,显露右侧髂血管区;沿髂外动静脉血管走行,自下而上切除腹股沟淋巴结、髂外淋巴结、髂总淋巴结;显露闭孔神经,切除闭孔淋巴结及髂内淋巴结;同法处理左侧。将清除盆腔淋巴结置入标本袋。同法处理左侧。⑥ 改变体位,头高足低、倾斜15°,镜头朝向患者头侧,切除大网膜,腹膜多点活检标本置入标本袋。⑦ 清除腹主动脉旁淋巴结达肠系膜下动脉水平,置入标本袋。⑧ 切除阑尾,Hem-o-lock夹阑尾根部,单极切断,置入标本袋。⑨ 取标本、检查,自阴道取出切除的子宫、附件、盆腔淋巴结组织、腹主动脉旁淋巴结组织、大网膜、阑尾及腹膜多点组织活检标本。止血、冲洗盆腔及留置引流等。
1.3 腹腔镜组的手术步骤
腹腔镜手术使用器械包括双极、单极及超声刀;手术步骤与机器人组的手术步骤相似。
1.4 术后处理
两组患者均给予常规抗炎、营养支持治疗;术后1~2 d拔胃管及尿管;术后2~3 d拔出腹腔引流管。
1.5 统计学处理
应用SPSS 17.0 软件进行数据的统计分析。患者的年龄、体质量指数、病灶大小、清扫淋巴结数、术中出血量及腹腔引流量等临床病理数据为计量资料且成正态分布,统计数据以±s表示;两组间比较采用成组设计资料t检验、Fisher精确概率检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基本情况
机器人组与腹腔镜组患者的年龄、体质量指数、病灶大小及保留生育功能例数比较,差异无统计学意义(P>0.05,表1)。
表 1 两组Ⅰ期卵巢癌患者一般情况的比较Tab.1 Comparison of the clinical data between the two groups with stage Ⅰ ovarian cancer(±s)
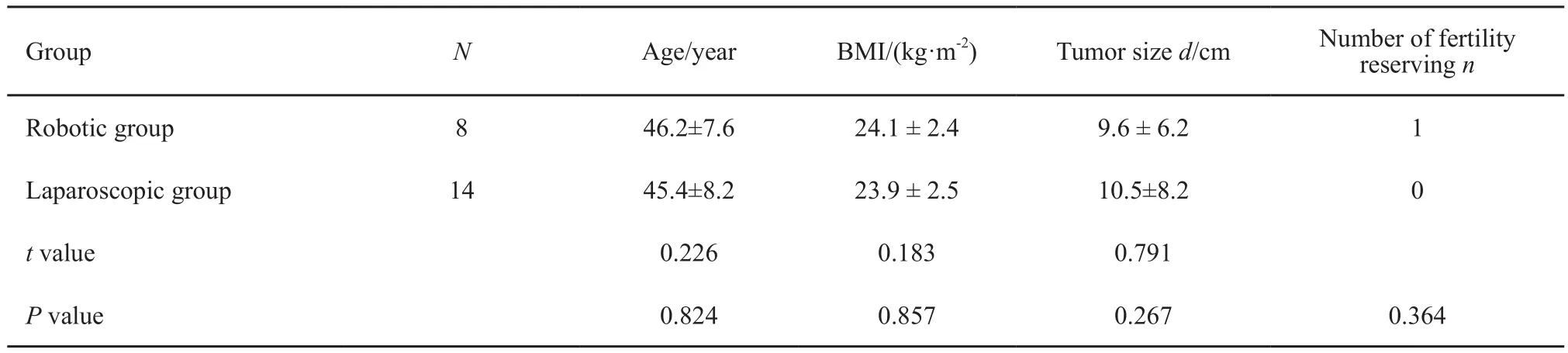
表 1 两组Ⅰ期卵巢癌患者一般情况的比较Tab.1 Comparison of the clinical data between the two groups with stage Ⅰ ovarian cancer(±s)
Group N Age/year BMI/(kg·m-2) Tumor size d/cm Number of fertility reserving n Robotic group 8 46.2±7.6 24.1 ± 2.4 9.6 ± 6.2 1 Laparoscopic group 14 45.4±8.2 23.9 ± 2.5 10.5±8.2 0 t value 0.226 0.183 0.791 P value 0.824 0.857 0.267 0.364
2.2 术中情况
机器人组与腹腔镜组患者均无中转开腹并顺利完成手术,无大出血、脏器损伤等并发症。机器人组的平均手术时间长于腹腔镜组,平均手术出血量少于腹腔镜组,差异均有统计学意义(P<0.05);两组的清扫淋巴结计数比较,差异无统计学意义(P>0.05,表2)。
表 2 两组Ⅰ期卵巢癌患者术中情况的比较Tab.2 Comparison of the operative data between the two groups with stage Ⅰ ovarian cancer(±s)

表 2 两组Ⅰ期卵巢癌患者术中情况的比较Tab.2 Comparison of the operative data between the two groups with stage Ⅰ ovarian cancer(±s)
Group N Operation time t/min Amount of bleeding V/mL Number of lymph node n Robotic group 8 194.50±10.90 60.10±8.88 22.50±3.21 Laparoscopic group 14 178.71±10.58 73.71±12.99 22.71±2.19 t value 3.331 2.620 0.186 P value 0.003 0.016 0.854
2.3 术后情况分析
两组术后24 h腹腔引流量比较,机器人组少于腹腔镜组,差异有统计学意义(P<0.05);两组的术后首次肛门排气时间、术后住院时间比较,差异无统计学意义(P>0.05)。机器人组中2例患者出现术后发热,并发症发生率为25.0%(2/8),经抗炎等对症治疗后缓解;腹腔镜组中3例患者发热,1例患者术后不完全肠梗阻,并发症发生率为28.6%(4/14),经对症治疗后均好转;机器人组与腹腔镜组术后并发症比较,差异无统计学意义(P=0.631)。
两组患者术后病理类型以上皮性卵巢癌为主,仅少数为性索间质肿瘤及生殖细胞肿瘤,机器人组中的1例保留生育功能的患者术后病理为无性细胞瘤。术前经CT或PET/CT等检查,严格手术指征,仅腹腔镜组术后1例患者由术中Ⅰ期术后分期上升为Ⅱa期。术后淋巴囊肿发生率及术后化疗差异无统计学意义。部分患者术后随访时间短,尚无法比较两组患者的生存数据(表3)。
表 3 两组Ⅰ期卵巢癌患者术后情况的比较Tab.3 Comparison of the postoperative data between the two groups with stage Ⅰ ovarian cancer(±s)

表 3 两组Ⅰ期卵巢癌患者术后情况的比较Tab.3 Comparison of the postoperative data between the two groups with stage Ⅰ ovarian cancer(±s)
Group N Amount of 24 h postoperative drainageV/mL Postoperative exhaust time t/d Hospitalized time after operation t/d Postoperative complications n Epithelium ovarian cancer/other tumors n/n Pathological stage Ⅰ/Ⅱn/n Postoperative chemotherapy n Lymphocyst n Robotic 8 96.88±10.21 1.91±0.14 10.11±1.21 2 7/1 8/0 6 6 Laparoscopic 14 108.00±11.43 1.98±0.17 10.31±0.93 4 11/3 13/1 10 11 t value 2.276 1.053 0.439 - - - - -P value 0.034 0.305 0.665 0.631 1.013 1.000 1.012 1.016
3 讨 论
临床上,早期卵巢癌是指手术病理分期在Ⅰ~Ⅱ期的患者,基本治疗是手术联合化疗[2]。鉴于卵巢癌的生物学特性和临床解剖学特点,微创手术是否适合卵巢恶性肿瘤一直存在争议[3]。但对于早期卵巢癌,近年来的国内外临床研究印证了腹腔镜手术的可行性和安全性[5]。2005年,美国食品药品管理局(Food and Drug Administration,FDA)批准达芬奇机器人可以在妇科手术中应用,使得妇科微创手术达到了一个更高的层次和水平。达芬奇手术系统在国内也陆续应用于子宫内膜癌、宫颈癌等恶性肿瘤的治疗,取得了良好的临床效果。
本研究以达芬奇机器人手术治疗的Ⅰ期卵巢癌患者为研究对象,手术均顺利完成,选择同时期腹腔镜手术治疗的Ⅰ期卵巢癌患者为对照组;机器人组的患者数较少,主要原因是如果手术开始探查时发现为分期较术前升高或有盆腔播散,则更改为开腹手术;同时得出的结果可能与严格把握手术适应证有关。
本研究显示,机器人组和腹腔镜组的患者年龄、体质量指数及病灶大小差异无统计学意义。机器人组的手术时间长于腹腔镜组,两组差异有统计学意义,可能与机器人手术时要摆放患者体位、对接机械臂、术中转换镜头方向及变更患者体位有关,而腹腔内手术时间并不长[6]。随着术者和助手的操作愈加熟练,总体手术时间可能缩短。与大多数临床研究的结果一致,机器人组的术中出血量和术后24 h腹腔引流量均少于腹腔镜组,差异有统计学意义。笔者认为,这应得益于机器人所具备的超出腹腔镜的优势,即灵活性、稳定性和精细度,机器人可滤除手部颤动、三维立体放大术野清晰,使得手术中血管显露清晰从而减少了手术中出血;术中解剖清晰、彻底,确切保留神经,充分电凝淋巴管也是术后淋巴渗出少、引流量少的关键因素[7-8]。本研究中,机器人手术和腹腔镜手术的术中清扫淋巴结数差异不显著,术后首次肛门排气时间、术后住院时间及术后并发症发生的差异不大。本研究结果表明,对于早期卵巢癌,机器人手术是安全、可行的;与传统腹腔镜比较,临床疗效差异不大。本结论与国内外相关研究结论基本一致[9-10]。由于入组的部分患者术后随访时间不足1年,尚无法比较2种术式患者术后的生存数据,将在今后继续随访及进行相关研究。
结合本研究及相关临床研究,机器人手术治疗早期卵巢癌在临床上普及和应用是可行的,但较腹腔镜手术的临床效果差异不大,仅在术中出血量和术后腹腔引流方面有优势,其他方面优势不明显;这仍然需要大样本的随机对照研究以进一步观察疗效,如术后临床分期、12个月复发率及穿刺孔种植转移率等[11-12]。结合国内外研究,机器人手术除了在早期卵巢癌中应用,在诊断性手术中也应用较多;但在Ⅲ期卵巢癌及复发的卵巢癌中鲜有应用[13],主要原因是Ⅲ期卵巢癌及复发卵巢癌的病变广泛,手术范围波及整个腹腔和盆腔,术中可能行小肠、大肠、脾及膀胱等多脏器联合切除,可能涉及肠吻合、造瘘或膀胱部分切除等,为不定型手术,涉及多科室,具有较大难度,对术者也有巨大挑战性;复发患者多有手术史,腹腔内粘连重,肠管、网膜等可能致密粘连,机器人下手术无足够的空间、手术不便,所以应用不多[14]。
较高的手术成本限制了机器人的广泛使用。同时,现有的临床研究中,尚缺乏生存率、复发率及生存期等较开腹、腹腔镜手术有无差异的有力证据,有待进一步研究和论证。
[1] 李录华. 腹腔镜与开腹手术治疗早期卵巢癌的临床效果比较[J]. 腹腔镜外科杂志,2016, 21(7): 536-539.
[2] 马 敏,陈秀英,李 斌. 国内腹腔镜和开腹手术治疗早期卵巢癌的临床效果的Meta分析[J]. 中国临床医学,2015, 22(3): 384-389
[3] 叶明侠,俞 凌,范文生,等. 机器人系统在早期卵巢癌治疗的临床应用分析[J]. 中华医学杂志,2017, 97(13):982-985.
[4] NGO C, CORNOU C, ROSSI L, et al. Evidence for the use of robotically assisted surgery in gynaecologic cancers[J]. Curr Opin Oncol, 2016, 28(5): 398-403.
[5] MINIG L, ZANAGNOLO V, CÁRDENAS-REBOLLO J M, et al. Feasibility of robotic radical hysterectomy after neoadjuvant chemotherapy in women with locally advanced cervical cancer[J]. Eur J Surg Oncol, 2016, 42(9): 1372-1377.
[6] 马佳佳,陈必良. 达芬奇机器人手术系统下保留盆腔自主神经宫颈癌广泛性子宫切除术肿瘤学安全性及临床疗效观察[J]. 实用医院临床杂志,2015, 12(1): 12-16.
[7] NEZHAT C, LAVIE O, HSU S, et al. Robotic-assisted laparoscopic myomectomy compared with standard laparoscopic myomectomy-a retrospective matched control study [J].Fertil Steril, 2009, 91(2): 556-559.
[8] KIM H K, KANG S Y, CHUNG Y J. Robot-assisted laparoscopic myomectomy, an alternative to laparotomy for numerous myomas(over 10) [J]. J Minim Invasive Gynecol, 2015, 22 (6): 71.
[9] 叶明侠,李立安,李 利,等. 机器人辅助腹腔镜行卵巢癌手术13例分析[J/CD]. 中华腔镜外科杂志(电子版),2015, 8(5): 312-316.
[10] SIESTO G, IEDA N, ROSATI R, et al. Robotic surgery for deep endometriosis: a paradigm shift[J]. Int J Med Robot, 2014,10(2): 140-146.
[11] JOHANSEN G, LONNERFORS C, FALCONER H, et al.Reproductive and oncologic outcome following robot-assisted laparoscopic radical trachelectomy for early stage cervical cancer[J]. Gynecol Oncol, 2016, 141(1): 160-165.
[12] FREEMAN R M, PANTAZIS K, THOMSON A, et al. A randomized ontrolled trial of abdominal versus laparoscopic sacrocolpopexy or the treatment of post-hysterectomy vaginal vault prolapse: LAS study[J]. Int Urogynecol J, 2013, 24(3):377-384.
[13] CORRADO G, CUTILLO G, POMATI G, et al. Surgical and oncological outcome of robotic surgery compared to laparoscopic and abdominal surgery in the management of endometrial cancer[J]. Eur J Surg Oncol, 2015, 41(8): 1074-1081.
[14] QUERLEU D, LEBLANC E. Laparoscopic infrarenal paraaortic lymph node dissection for restaging of carcinoma of the ovary or fallopian tube[J]. Cancer, 1994, 73(5): 1467-1471.

