胰腺实性假乳头状瘤的CT表现及良、恶性鉴别
邓 霖,周良平,吴 斌,刘晓航,尤 超
1.上海市质子重离子医院放射诊断科,上海 201321;
2.复旦大学附属肿瘤医院放射诊断科,上海 200032
胰腺实性假乳头状瘤(solid pseudopapillary tumor of pancreas,SPTP)是一种较为少见且多为良性和低度恶性的肿瘤,仅占全部胰腺外分泌肿瘤的0.2%~2.7%[1-2]。恶性病例临床较为少见,病灶可直接侵犯邻近组织或发生远处转移,其中肝脏为最常见部位,同时罕见淋巴结转移[1,3]。
目前,SPTP的治疗方法首选手术切除,包括原发灶及转移灶。恶性SPTP在术式选择上较良性肿瘤有一定差异,若无法完整切除病灶将增加术后复发可能[4]。因此,SPTP的术前良、恶性诊断对于临床治疗非常重要。本研究回顾性分析69例病理确诊为SPTP患者的CT多期扫描资料,结合其临床表现及病理征象,对比良、恶性SPTP的CT表现,旨在探讨良、恶性SPTP的鉴别特点。
1 资料和方法
1.1 一般资料
收集2013年1月—2015年12月于复旦大学附属肿瘤医院经手术和病理学证实的69例SPTP患者,其中男性15例,女性54例,范围为15~54岁,平均年龄为32.35岁。其中,39例(56.52%)患者出现临床症状,包括上腹部胀痛16例(23.19%),自觉腹部包块12例(17.39%),腰背部疼痛6例(8.70%),体重减轻4例(5.80%),黄疸1例(1.45%),其余30例患者为体检发现(43.48%)。所有患者均接受术前CT检查,术后病理证实良性SPTP组56例,恶性组13例。
1.2 CT检查方法及图像分析
69例患者均经Germany Berlin SIEMENS SOMATOM SENSATION-40或Netherlands Philips Brilliance CT64 Slice CT扫描仪进行上腹部CT扫描,扫描前禁食8 h,口服清水500~800 mL。扫描条件:管电压120 kV,常规扫描层厚3 mm,重建层厚0.60~1.25 mm,分别于注射造影剂前及后35、70 s进行平扫及动脉期、门脉期增强扫描。经肘静脉由高压注射剂注入非离子型对比剂(优维显或欧乃派克,含碘300 mgI/mL),速率3 mL/s,总量95~100 mL。
由两位放射诊断学医师对所得图像进行分析,包括病灶的位置、最大径、形态、包膜、钙化、密度、囊实性比例、强化方式、邻近组织器官的侵犯及有无淋巴结转移、有无胰胆管扩张等情况进行分析。若出现疑问或争论,则请第3位高年资医师进行评判及诊断。参照参考文献[5]中囊实性比例的测量方法:选取病灶最大层面,分别测量实性区域面积及总面积,计算实性区域百分比,将病灶分为囊性为主病灶(实性区域面积小于30%),囊实性病灶(实性区域面积为30%~70%),实性为主病灶(实性区域面积大于70%)。分别测定囊性和实性区域平扫、动脉期及门脉期CT值,定义病灶强化方式:动脉期轻度强化(动脉期与平扫CT值差小于30 HU);动脉期中度以上强化(差值大于等于30 HU);门脉期渐进性强化(门脉期CT值大于动脉期CT值);门脉期强化不明显(CT值与动脉期相似或轻度减低)。
1.3 病理学检查及分析
所有病例均行组织病理学及免疫组织化学检查,由两位病理学医师进行初诊及复诊。依据WHO对恶性SPTP的分类标准[2],包括周围神经侵犯、血管侵犯、邻近组织浸润及远处转移,对SPTP进行分类。
1.4 统计学处理
采用SPSS 16.0统计软件,良、恶性组间进行独立样本t检验,Pearson χ2检验及Fisher精确检验,P<0.05为差异有统计学意义。
2 结 果
2.1 临床表现
全组病例中男女性比例为5∶18,女性患者明显多于男性患者。良性组中男性11例(19.64%),女性45例(80.36%);恶性组中男性4例(30.77%),女性9例(69.23%),两组患者性别差异无统计学意义(P=0.458)。
良性组患者平均年龄为31(14~56)岁。其中,30~39岁和20~29岁组别患者人数最多,分别为23例和20例。恶性组平均年龄为39(16~56)岁,40~49岁组患者4例居首位,20~29岁组及50~59岁组患者均为3例。两组年龄差异有统计学意义(P=0.01,图1)。
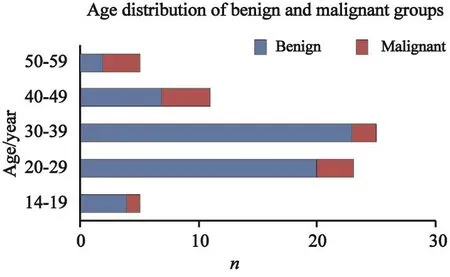
图 1 两组患者年龄分布比较情况Fig. 1 The comparison of age distribution of the 2 groups
2.2 CT表现
2.2.1 肿瘤部位
胰头部病例在两组中均多见,分别为良性组16例(28.57%),恶性组4例(30.76%),此外,恶性组肿瘤较多位于胰体(3例,23.08%)及胰体尾(3例,23.08%)。两组肿瘤位置比较差异无统计学意义(P=0.565,表1)。
2.2.2 最大径
恶性组肿瘤最大径均值为6.16(2.2~12.0) cm,良性组肿瘤最大径均值为5.48(1.2~13.0) cm(P=0.435)。以最大径5 cm为界将两组病例分段[7],良性组肿瘤最大径小于5 cm者35例(62.50%),最大径大于等于5 cm者21例(37.50%);而恶性组中最大径小于5 cm者3例(23.08%),大于等于5 cm者10例(76.92%),两组差异有统计学意义(P=0.014)。
2.2.3 形态、边界及包膜
24例病灶表现为边界清楚的类圆形肿块(34.78%),其中良性组22例,恶性组2例;12例表现为边界不清的类圆形肿块(17.39%);12例为边界清楚的分叶形肿块(17.39%);边界清楚或不清的不规则形肿块21例(30.43%),其中良性组13例,恶性组8例。两组肿瘤的形态及边界差异无统计学意义(P=0.624)。41例病灶具有完整包膜(62.32%),其中良性组37例,恶性组4例;包膜不完整共28例(40.58%),良性组19例,恶性组9例。两组肿瘤包膜情况差异有统计学意义(P=0.028,图2)。
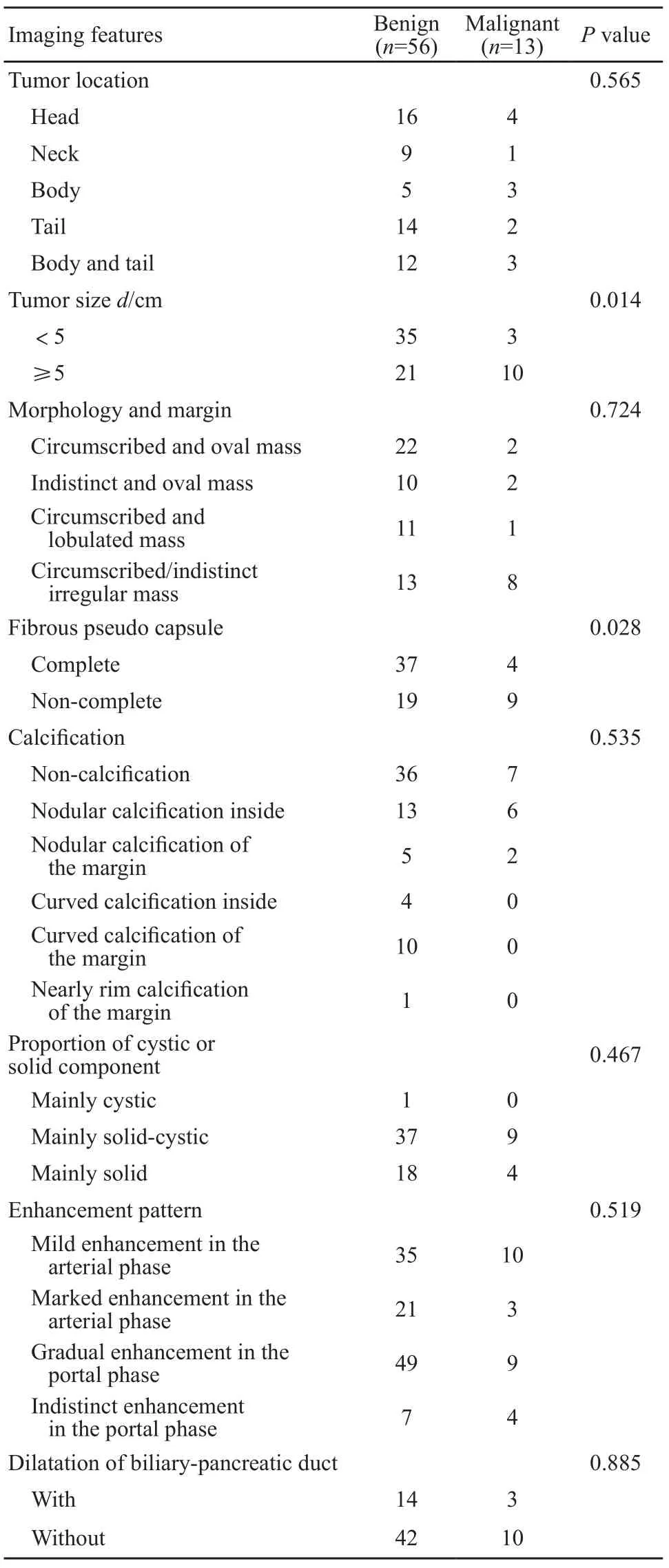
表 1 良恶性组肿瘤的CT表现特征Tab. 1 The characteristics of benign and malignant groups shown by CT scan
2.2.4 钙化
根据钙化位置和形态不同,恶性组均表现为结节样钙化,其中钙化位置为肿块内部4例,边缘及内部2例;另见内部弧形钙化3例,边缘弧形钙化8例,边缘几乎环形钙化1例,均为良性,其余43例病灶不伴钙化。两组病例钙化情况差异无统计学意义(P=0.535)。
2.2.5 囊实性比例
囊性为主病灶(实性区域面积小于30%)仅1例(1.45%),为良性。囊实性病灶(实性区域面积为30%~70%)共46例(66.67%),其中良性组37例,恶性组9例。实性为主病灶(实性区域面积大于70%)共22例(31.88%),良性组18例,恶性组4例。两组病灶囊实性比例差异无统计学意义(P=0.467,图3)。
2.2.6 强化方式
囊性区域未见明显强化。45例肿瘤实性区域动脉期可见轻度强化,其中良性35例,恶性10例;24例见中度以上强化,其中良性21例,恶性3例。58例表现为门脉期渐进性强化,其中良性49例,恶性9例;其余11例门脉期强化不明显。动脉期与门脉期病灶实性区域强化水平均弱于同层面胰腺及脾脏实质。两组病例强化方式差异均无统计学意义(P=0.519和P=0.360,图4)。
2.2.7 胰胆管扩张
17例病灶伴有胰胆管扩张,良性组14例,恶性组3例,其中1例表现为胰胆管同时扩张,其余52例病灶不伴有胰胆管扩张,差异无统计学意义(P=0.885)。
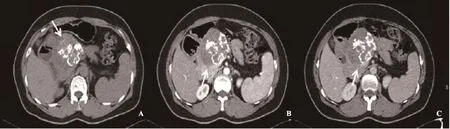
图 2 恶性胰腺实性假乳头状瘤伴十二指肠受侵的CT表现Fig. 2 The malignant pseudopapillary tumor shown by CT scan

图 3 3例良性组病例CT门脉期增强表现Fig. 3 The enhancement features of 3 benign solid pseudopapillary tumor in portal phase CT scan
2.3 胰腺邻近组织侵犯、淋巴结转移及远处转移
13例恶性SPTP中,仅侵犯周围胰腺组织6例,神经侵犯2例,脉管瘤栓1例;十二指肠受累1例,另1例病灶同时侵犯周围胰腺及十二指肠,2例伴有肝脏转移,其中1例同时侵犯脾脏(图5)。所有病灶均未见淋巴结转移。

图 4 良性胰腺实性假乳头状瘤的CT表现Fig. 4 Benign solid pseudopapillary tumor shown by CT scan
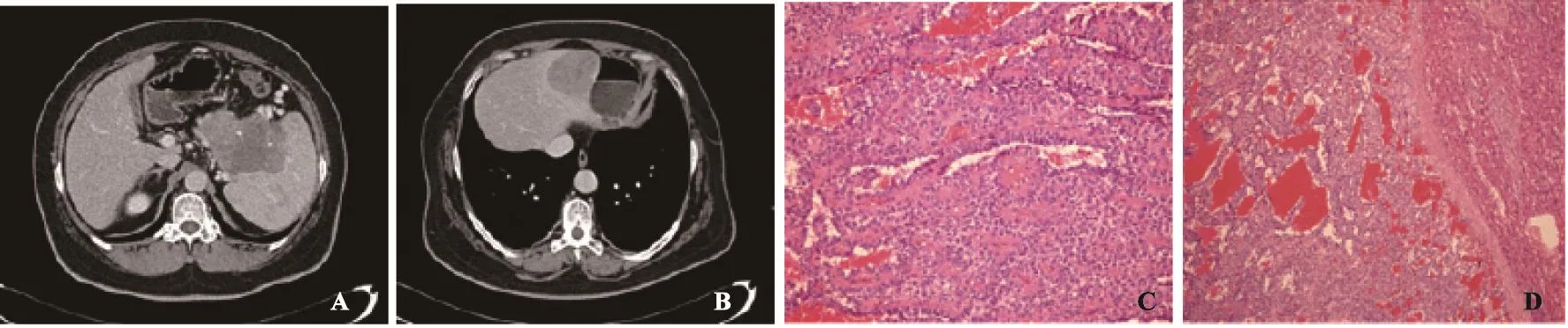
图 5 胰腺实性假乳头状瘤侵犯神经的CT表现及病理诊断结果Fig. 5 The CT scan and pathological diagnosis of pancreas malignant solid pseudopapillary tumor
3 讨 论
手术切除目前是SPTP最有效的治疗方式,而手术方式的选择与肿瘤的位置、大小、是否伴有局部浸润及远处转移有关[3]。有研究显示,较其他胰腺恶性肿瘤而言,恶性SPTP的预后相对较好[6-7]。但是,SPTP包括恶性病例,临床症状常不明显,亦缺乏特异性实验室检查指标。
SPTP女性患者多见,有研究显示,发病年龄较大及男性患者可能提示恶性[8-9]。在本研究中,恶性组平均发病年龄为39岁,明显高于良性组患者,同时以40岁分段,两组患者年龄差异有计学意义(P=0.008),年龄大于等于40岁提示恶性可能大,这与文献报道吻合。而在性别方面,恶性组中男性占30.77%,大于良性组男性比例(19.64%),但两组差异无统计学意义(P=0.458),推测可能与样本量大小有关。
CT是目前最常用的影像学检查手段之一。近年来,越来越多的研究着重于探索良、恶性SPTP发病部位、最大径、包膜等方面CT表现的差异[10-11]。在本研究中,良、恶性SPTP在肿瘤最大径及包膜情况存在差异。良性肿瘤最大径多小于5 cm,且具有完整包膜;而肿瘤最大径大于等于5 cm以及包膜不完整,则提示恶性可能,这与以往的研究结果相符。而在肿瘤部位、形态、钙化、囊实性比例和强化方式等方面,未发现两组病例存在差异。
在所有病例中,我们仅发现囊性为主病灶1例,几乎环形钙化病灶1例,均为良性,且患者均为年轻女性(26和31岁),肿瘤表现为边界清楚的类圆形肿块,包膜完整,前者不伴有钙化,后者同时伴有内部结节样钙化。由于病例数极少,未得出统计学差异,但在日常临床诊断工作中,此两项征象仍可作为良性征象。与常见的胰腺恶性肿瘤相比,恶性SPTP常侵犯的胰腺外器官包括十二指肠及脾脏,远处转移常见部位为肝脏,而胰胆管扩张及淋巴结转移较为罕见[5,7,11]。本研究发现,2例病灶侵犯十二指肠。另发现2例肝脏转移,患者年龄均大于40岁,其中1例同时侵犯脾脏,患者同时行病灶及肝脏转移灶切除术,其中1例因术后多器官衰竭死亡,另1例术后3年随访期存活。3例病灶伴胰胆管扩张,均位于胰头部,考虑可能与肿瘤部位有关。
本研究存在一定局限性,由于SPTP在临床少见,因此样本量较小;同时良、恶性组数量有一定差异。其次,缺乏MRI的表现对照,需在今后的研究中改进,从而进一步探讨良、恶性SPTP影像学表现的差异。
[1] HUANG H L, SHIH S C, CHANG W H, et al. Solid pseudopapillary tumor of the pancreas: clinical experience and literature review[J]. World J Gastroenterol, 2005, 11(9):1403-1409.
[2] BUETOW P C, BUCK J L, PANTONGRAG-BROWN L, et al. Solid and papillary epithelial neoplasm of the pancreas:imaging-pathologic correlation on 56 cases[J]. Radiology,1996, 199(3): 707-711.
[3] REDDY S, CAMERON J L, SCUDIERE J, et al. Surgical management of solid pseudopapillary neoplasms of the pancreas(Franz or Hamoudi tumors): a large single-institutional series[J]. J Am Coll Surg, 2009, 208(5): 950-957.
[4] MARTIN R C, KLIMSUA D S, BRERMAN M F, et al. Solid pseudopapillary tumor of the pancreas: a surgical enigma[J].Ann Surg Oncol, 2002, 9(1): 35-40.
[5] YIN Q H, WANG M L, WANG C, et al. Differentiation between benign and malignant solid pseudopapillary tumor of the pancreas by MDCT[J]. Eur J Radiol, 2012, 81(11): 3010-3018.
[6] CARLOTTO J R, TORREZ F R, GOUZALE A M, et al. Solid pseudopapillary neoplasm of the pancreas[J]. Arg Bras Cir Dig, 2016, 29(2): 93-96.
[7] ZHANG H, WANG W, YU S, et al. The prognosis and clinical characteristics of advanced (malignant) solid pseudopapillary neoplasm of the pancreas[J]. Tumour Biol, 2016, 37(4):5347-5353.
[8] FARRELL J J. Prevalence, diagnosis and management of pancreatic cystic neoplasms: current status and future directions[J]. Gut Liver, 2015, 9(5): 571-589.
[9] YU M H, LEE J Y, KIM M A, et al. MR imaging features of small solid pseudopapillary tumors: retrospective differentiation from other small solid pancreatic tumors[J]. AJR Am J Roentgenol, 2010, 195(6): 1324-1332.
[10] YU P F, HU Z H, WANG X B, et al. Solid pseudopapillary tumor of the pancreas: a review of 553 cases in Chinese literature[J].World J Gastroenterol, 2010, 16(10): 1209-1214.
[11] HUANG Y S, CHEN J L, CHANG C C, et al. Solid pseudopapillary neoplasms of the pancreas: imaging differentiation between benignity and malignancy[J].Hepatogastroenterology, 2014, 61(131): 809-813.

