32例颌面部骨肉瘤临床特点比较及预后影响因素分析
袁 媛,沈 赞
上海交通大学附属第六人民医院肿瘤内科,上海 200233
骨肉瘤是间叶组织来源的恶性肿瘤[1]。多发生于儿童及青年[2],尤其好发于四肢[3]。原发于颌面的骨肉瘤发病率较低,仅占骨肉瘤的5%[4],但侵袭性更强。颌面部的骨肉瘤不同于发生在其他骨骼的骨肉瘤,高致死率主要是因为局部疾病的进展,远处转移较少[5]。对于骨肉瘤的治疗一般为根治性手术的切除,辅助化疗和放疗以减少原位的复发和远处的转移。颌面部骨肉瘤和骨肉瘤的一般治疗相似。目前国内对于颌面部骨肉瘤患者的临床特点及预后研究较少。本研究通过回顾性分析颌面部骨肉瘤患者的临床资料进而对该亚型骨肉瘤患者的生存预后因素进行探讨。
1 资料和方法
1.1 患者资料
收集2010—2017年在上海交通大学附属第六人民医院肿瘤内科治疗的颌面部骨肉瘤患者32例,均有完整的临床资料及随访记录。其中男性22例,女性10例;中位年龄32岁(13~66岁)。21例患者以面部肿胀为首发症状,8例以牙痛为首发症状,3例以口腔唇部麻木为首发症状。32例患者中1例既往有鼻咽癌放疗史。临床分期采用Enneking分期系统,Ⅰ期3例,Ⅱ期17例,Ⅲ期11例,Ⅳ期1例。发生在上颌骨的有16例,下颌骨有16例。所有患者的病理均经上海交通大学附属第六人民医院病理科证实。
1.2 治疗
32例患者中,30例行手术治疗及化疗,2例因为肿瘤负荷过大无法行手术切除。初次治疗若可以手术行根治性切除,缺损较大者予以皮瓣修复术。手术方式为上、下颌骨切除术。复发后予以扩大切除术或者姑息切除术,术后予以辅助化疗,如切缘不满意则予以术后放疗,术后化疗药物包括大剂量甲氨蝶呤、多柔比星、顺铂及异环磷酰胺。甲氨蝶呤(8~12 g/m2)、多柔比星(60~90 mg/m2)、顺铂(80~100 mg/m2)及异环磷酰胺(6~10 g/m2)交替进行。出现复发后再次行手术切除和辅助化疗。辅助化疗用二线化疗方案。二线化疗具体为:① 吡柔比星50 mg/m2,第1天,紫杉醇150 mg/m2,第2天,培美曲赛500 mg/m2,第1天,重组人血管内皮抑素7.5 mg/m2,第1~14天。② 吉西他滨1.2 g/ m2,第1~8天,多西他赛75 mg/m2,第1天。对于出现复发转移的肺部病灶予以胸腔镜手术切除或者立体定向放疗。
1.3 随访
由专人采用电话回访的形式进行,从首次诊断为骨肉瘤至死亡或末次随访日的时间间隔为总生存期(overall survival,OS)。从首次诊断为骨肉瘤至疾病复发的时间或末次随访日的时间间隔为无进展生存期(progression-free survival,PFS)。
1.4 统计学处理
使用SPSS 22.0软件进行处理,Kaplan-Meier法分析不同治疗方式的生存率和无复发生存率差异,P<0.05为差异有统计学意义;对影响患者预后的因素先行单因素分析(Kaplan-Meier法),对差异有统计学意义的因素再进行Cox多因素回归法分析,采用enter法检验,模型中变量均满足等比例风险假设。
2 结 果
末次随访为2017年1月,32例患者中14例患者未出现复发转移,18例(56.2%)出现复发和转移(12例局部复发,6例远处转移),平均随访时间为75(7~90)个月,18例发生复发转移的患者均死亡。以Kaplan-Meier法计算5年总生存率为44%(图1)。18例发生复发及转移的患者中,13例在1年内出现复发或转移(72.2%),均为手术区域的复发或肺部转移。我们比较了性别、年龄、肿瘤生长部位、肿瘤直径、手术切缘情况、Enneking分期、手术方式及辅助化疗次数对无复发生存率的影响,结果显示,手术切缘和术后化疗次数(小于等于6次或大于6次化疗)与复发与否明显相关,应用Kaplan-Meier计算法比较两个组别(手术切缘阳性或阴性,术后化疗次数大于或小于6次)的2年无复发生存率(图2、图3), 手术切缘阴性为0.601,阳性为0.152,差异有统计学意义(P<0.05);化疗次数大于6次者为0.121,小于等于6次者为0.682,差异有统计学意义(P<0.01)。
分析性别、肿瘤原发部位、年龄、肿瘤直径、手术切缘、Enneking分期、手术方式、化疗次数、远处转移及有无复发等因素对于患者OS的影响,单因素分析结果显示,手术切缘、肿瘤直径和术后辅助化疗次数对患者OS有明显影响(P<0.05,表1);进一步采用Cox模型将上述3个变量进行回归分析,证实手术切缘和术后化疗次数与患者预后相关(P<0.05)。

图 1 32例颌面部骨肉瘤患者的生存曲线Fig. 1 Survival curve of 32 patients with maxillofacial osteosarcoma
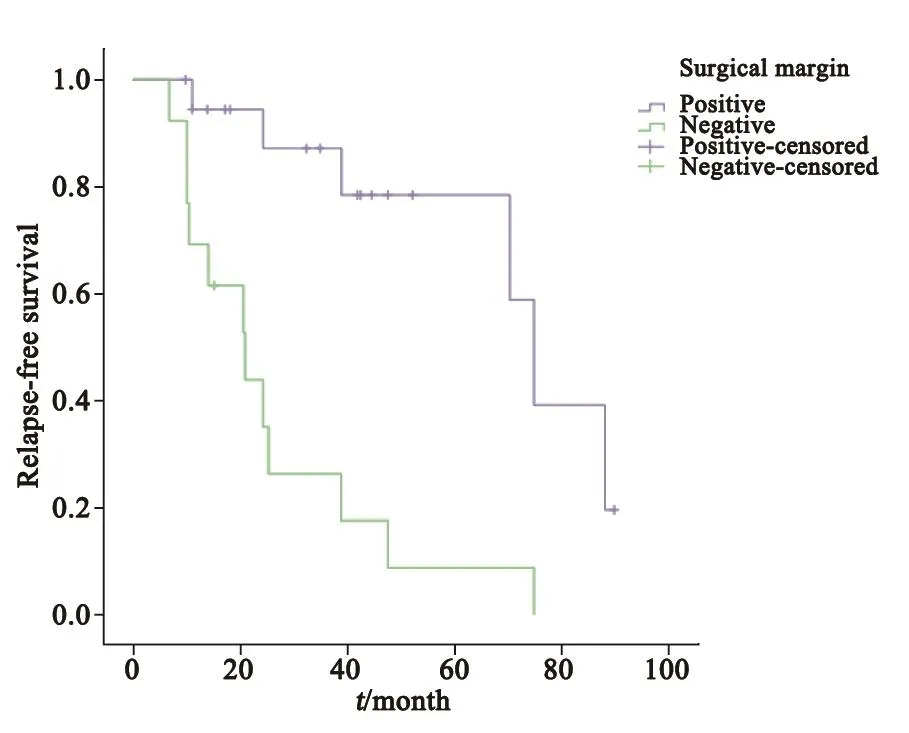
图 2 切缘阴性和阳性颌面部骨肉瘤患者无复发生存曲线的比较Fig. 2 Comparison of the relapse-free survival curves of the maxillofacial osteosarcoma patients with positive or negative margin

图 3 接受不同化疗次数的颌面部骨肉瘤患者的无复发生存曲线的比较Fig. 3 Comparison of the relapse-free survival curves of the maxillofacial osteosarcoma patients with different frequencies of adjuvant chemotherapy
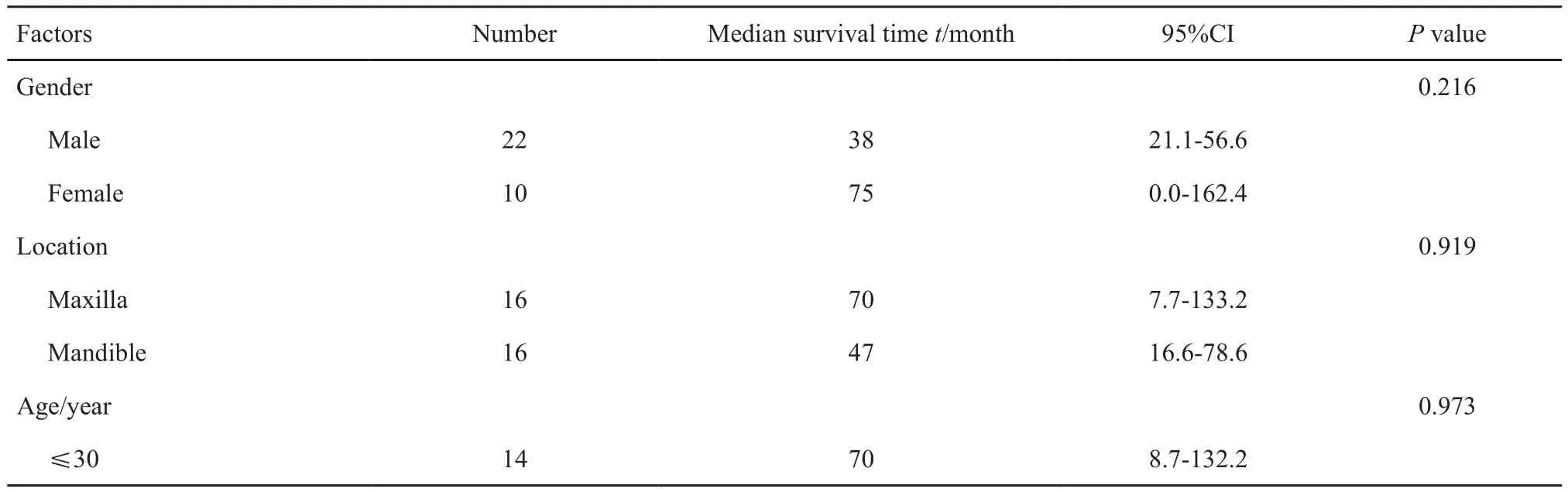
表 1 颌面部骨肉瘤患者预后因素的单因素分析Tab. 1 Univariate analysis of prognostic factors of maxillofacial osteosarcoma patients

续表1
3 讨 论
颌面部骨肉瘤因其发病率低,约占骨肉瘤的10%,占所有头颈部肿瘤不到1%,报道较少,中位发病年龄是34岁,男性多于女性,下颌骨的发生率较高[6-9]。Tanzawa等[10]在日本的回顾性研究发现114例颌面部骨肉瘤患者中,下颌骨的发生率较上颌骨多(58.8% vs 41.2%)。一项在加拿大的回顾性研究得到相同的结论[11]。本研究亦证实颌面部骨肉瘤中男性多于女性(2.2∶1),中位发病年龄32岁,而上、下颌骨的发病率差异无统计学意义。颌面部骨肉瘤的病因学目前尚不明确,本次研究对象中有1例为放疗后引发的骨肉瘤。国外报道放疗导致的骨肉瘤占总骨肉瘤发病率的5.5%[12]。放疗诱导的骨肉瘤是一种长期的放疗后并发症。一般在接受放疗后的区域出现团块、疼痛或者张口受限[13]。故对放疗后的患者需要密切观察其局部病变情况,做到早发现、早诊断、早治疗。
颌面部骨肉瘤较多在年长者中发生,而在长骨中发生的均为小于20岁的年轻人,van den Berg等[14]的一项回顾性研究分析了下颌骨和非下颌骨部位骨肉瘤的不同特点。中位的发病时间:上颌骨是45.5岁,下颌骨为49岁,其他部位发生骨肉瘤为23岁。
肢体骨肉瘤较易发生远处转移,转移率为44%~49%;头面部骨肉瘤患者肺转移较为少见,为4%~43%。头面部复发率(17%~70%)较肢体(5%~7%)高,主要是因为头面部做到完全切除的手术难度较高[15]。
颌面部骨肉瘤的临床表现较多样,多以无痛性肿块为首发症状,随着肿块的生长可发生局部压迫的表现,如进食困难、张口受限、呼吸困难等,并出现局部疼痛。肿瘤可以随着骨髓腔侵袭性生长并侵犯骨外软组织引起相应的症状,当侵犯牙神经时便出现麻木,破坏牙槽骨,出现牙齿松动或者牙髓炎,易被误诊为牙痛、牙周炎或者牙龈炎[16]。本研究出现面部肿胀最多,其次为牙痛和唇部麻木。
颌面部骨肉瘤的治疗原则仍强调根治性切除联合新辅助化疗及辅助化疗,该治疗模式沿袭了肢体骨肉瘤的治疗方法,目的在于减少肺部远处转移概率及增加局部控制率,降低头面部手术治疗的难度。对于切缘阳性或者手术后复发而不适合再次手术治疗的患者可考虑行放疗[17]。De Angelis等[18]回顾性分析了颌面部骨肉瘤使用辅助化疗、新辅助化疗或者两者结合的治疗的疗效。2、5和15年的无病生存率为92%、74%和74%。Mücke等[19]回顾性研究了颌面部骨肉瘤行新辅助化疗对OS是否有影响,结果显示,中位OS为(64.49±23.52)个月,2年和5年的总生存率是100%和66.7%,而单纯手术组是66.7%和41.7%。以上研究都提示行术前新辅助化疗可以显著提高总生存率。Fernandes等[20]的回顾性分析显示,病理高级别的颌面部骨肉瘤患者在接受新辅助化疗之后有着较好的生存趋势。而本次研究中患者未行新辅助化疗。
根治性切除对于颌面部骨肉瘤预后至关重要,根治性切除指的是上半颌切除和下半颌切除或是肿瘤包括其软组织边界广泛切除[21],距离肿块约3 cm切缘[22]。但是颌面部的解剖结构较为复杂,且相比肢体骨肉瘤,其可切除的范围较少,较难做到根治性切除。故手术切缘阴性对患者的预后很重要[23-24]。本研究单因素分析得出患者手术切缘的性质与无复发生存率密切相关,手术切缘阴性患者的无复发生存率更高。
本研究结果显示,患者的术后辅助化疗次数是疾病复发和患者生存的独立影响因素。
大量研究证明,化疗能明显改善患者的预后。在1970年,Jaffe发现MTX能减少肺部转移并且可以作为术前的辅助治疗。同时大量的实验表明增加其他药物比如多柔比星、顺铂或者环磷酰胺都可以降低患者的无病生存率(disease-free survival,DFS)(20%~65%)。Meyers等[25]回顾性分析了1975—1984年279例未出现转移的骨肉瘤初治的患者接受手术和高强度化疗的治疗结果,结果显示,DFS升高,同时总生存率也升高。多种大剂量化疗药物结合手术对于肢体骨肉瘤的化疗达到5年的无事件生存(event-free survival,EFS)率为60%~70%。对于复发或转移的骨肉瘤患者,3~5年的EFS一直保持在10%~30%[26]。Vassiliou等[27]对颌面部骨肉瘤综合治疗(手术辅助以化疗放疗)进行回顾性分析,结果显示,2和5年的总生存率为91%和73%。2和5年的EFS率为66%和49%。单因素研究结果显示肿瘤直径、手术切缘和术后辅助化疗次数是影响患者预后的因素。本研究的5年总生存率为44%。
多元回归分析显示手术切缘和手术后的辅助化疗次数是影响患者预后的独立因素。手术切缘的性质也决定了手术能达到是行根治性切除。
颌面部骨肉瘤因其发病部位特殊和解剖复杂较易发生复发,本次研究复发率为56.2%,且多在1年内复发。大部分为手术部位的原位复发。一般的手术治疗为扩大性根治性切除,如果不能争取手术切除则予以姑息性放疗。单因素分析手术切缘和化疗次数是复发的相关独立因素。根治性切除保持手术切缘阴性和术后化疗都是为了减少疾病的复发和转移。骨肉瘤转移的位置一般为肺部,或是胸膜或骨骼。转移机制为肿瘤细胞进入血液循环迁移,继而发生定植[28]。出现肺转移一般都行手术切除。肺部转移灶切除术后5年生存率为20%~45%。当肺部发生远处转移后,下列情况提示较好的预后:① 复发间隔时间较长;② 孤立性的肺部结节;③ 完全的二次切除。术后放疗对于颌面部骨肉瘤的治疗有限,然而,对于尤文肉瘤有效。对于手术切缘阳性或者手术难以切除的复发患者行放疗对患者的生存率有重要作用。
颌面部骨肉瘤和长骨的骨肉瘤不同。因为其特殊的发病部位,发病时间较长骨骨肉瘤患者晚,男性多见,下颌骨居多。主要的治疗手段是根治性切除。根据不同的病理类型,新辅助化疗和手术后辅助化疗均可改善患者的生存率和降低复发转移率。对于复发和转移灶予以再次手术,或者辅助放疗进行治疗。手术切缘和术后辅助化疗的次数是影响患者生存时间的独立预后因素。
[1] MOORE D D, LUU H H. Osteosarcoma[J]. Cancer Treat Res, 2014, 162: 65-92.
[2] LI C Z, HE Y, MA H J, et al. NOVA1 acts as an oncogene in osteosarcoma[J]. Am J Transl Res, 2017, 9(10): 4450-4457.
[3] IANNACI G, LUISE R, SAPERE P, et al. Extraskeletal osteosarcoma: a very rare case report of primary tumor of the colon-rectum and review of the literature[J]. Pathol Res Pract, 2013, 209(6): 393-396.
[4] SUE M, ODA T, SASAKI Y. Osteosarcoma of the mandible: a case report with CT, MRI and scintigraphy[J]. Chin J Dent Res, 2017, 20(3): 169-172.
[5] KÄMMERER P W, SHABAZFAR N, VORKHSHORI M N, et al. Clinical, therapeutic and prognostic features of osteosarcoma of the jaws-experience of 36 cases[J]. J Craniomaxillofac Surg, 2012, 40(6): 541-548.
[6] FLETCHER C D M, UNNI K K, MERTENS F, et al. Pathology and genetics of tumours of soft tissue and bone. In: World Health Organization Classification of Tumours[M]. IARC Press 5;2002. IARC WHO Classification of Tumours No 5.
[7] CHEN Y M, SHEN Q C, GOKAVARAPU S, et al. Osteosarcoma of the mandible: a site-specific study on survival and prognostic factors[J]. J Craniofac Surg, 2016, 27(8): 1929-1933.
[8] ALISHAHI B, KARGAHI N, HOMAYOUNI S, et al.Epidemiological evaluation of head and neck sarcomas in Iran(the study of 105 cases over 13 years)[J]. Iran J Cancer Prev,2015, 8(4): e3432.
[9] CHIDZONGA M M, MAHOMVA L. Sarcomas of the oral and maxillofacial region: A review of 88 cases in Zimbabwe[J].Br J Oral Maxillofac Surg, 2007, 45(4): 317-318.
[10] TANZAWA H, UCHIYAMA S, SATO K, et al. Statistical observation of osteosarcoma of the maxillofacial region in Japan[J]. Oral Surg Oral Med Oral Pathol, 1991, 72(4): 444-448.
[11] Canadian Society of Otolaryngology-Head and Neck Surgery Oncology Study Group. Osteogenic sarcoma of the mandible and maxilla: a Canadian review (1980-2000) [J]. J Otolaryngol,2004, 33(3): 139-144.
[12] LIU W W, WU Q L, WU G H, et al. Clinicopathologic features,treatment, and prognosis of postirradiation osteosarcoma in patients with nasopharyngeal cancer[J]. Laryngoscope, 2005,115(9): 1574-1579.
[13] ZHU W, HU F, ZHAO T, et al. Clinical characteristics of radiation-induced sarcoma of the head and neck: review of 15 cases and 323 cases in the literature.[J]. J Oral Maxillofac Surg, 2016, 74(2): 283-291.
[14] VAN BERG H, SCHREUDER W H, DE LANGE J. et al.Osteosarcoma: a comparison of jaw versus nonjaw localizations and review of the literature[J]. Sarcoma, 2013, 2013(3):316123.
[15] BOON E, VAN DER GRAAF W T, GELDERBLOM H, et al.Impact of chemotherapy on the outcome of osteosarcoma of the head and neck in adults[J]. Head Neck, 2017, 39(1): 140-146.
[16] VASSILIOU L V, LALABEKYAN B, JAY A, et al. Head and neck sarcomas: A single institute series[J]. Oral Oncol, 2017,65: 16.
[17] GRIMER R, ATHANASOU N, GERRAND C, et al. UK guidelines for the management of bone sarcomas[J]. Sarcoma,2010: 317462.
[18] DE ANGELIS A F, SPINOU C, TSUI A, et al. Outcomes of patients with maxillofacial osteosarcoma: a review of 15 cases[J]. J Oral Maxillofac Surg, 2012, 70(3): 734-739.
[19] MÜCKE T, MITCHELL D A, TANNAPFEL A, et al. Effect of neoadjuvant treatment in the management of osteosarcomas of the head and neck[J]. J Cancer Res Clin Oncol, 2014,140(1): 127-131.
[20] FERNANDES R, NIKITAKIS N G, PAZOKI A, et al.Osteogenic sarcoma of the jaw: a 10-year experience[J]. J Oral Maxillofac Surg, 2007, 65(7): 1286-1291.
[21] CLARK J L, UNNI K K, DAHLIN D C, et al. Osteosarcoma of the jaw[J]. Cancer, 1983, 51(12): 2311-2316.
[22] FERNANDES R, KOLOKYTHAS A. Sarcomas of the head and neck: a 10-year experience with 37 patients at the University of Maryland[J]. Oral Oncol, 2005, 1(1): 131-132.
[23] CHEN Y, SHEN Q, GOKAVARAPU S, et al. Osteosarcoma of head and neck: a retrospective study on prognostic factors from a single institute database[J]. Oral Oncol, 2016, 58: 1-7.
[24] LIM S, LEE S, RHA S Y, et al. Cranofacial osteosarcoma: Single institutional experience in Korea[J]. Asia Pac J Clin Oncol,2016, 12(1): e149-153.
[25] MEYERS P A, HELLER G, HEALEY J, et al. Chemotherapy for nonmetastatic osteogenic sarcoma: the Memorial Sloan Kettering experience[J]. J Clin Oncol, 1992, 10(1): 5-15.
[26] LUETKE A, MEYERS P A, LEWIS I, et al. Osteosarcoma treatment-where do we stand? A state of the art review[J].Cancer Treat Rev, 2014, 40(4): 523-532.
[27] VASSILIOU L V, LALABEKYAN B, JAY A, et al. Head and neck sarcomas: A single institute series[J]. Oral Oncol, 2017,65: 16-22.
[28] JIA S, BINBIN L I. Osteosarcoma of the jaws: case report on synchronous multicentric osteosarcomas[J]. J Clin Diagn Res, 2014, 8(6): 1-3.

