精氨酸酶2表达与肝细胞癌增殖凋亡及预后的关系研究
肖 锋,顾春燕,钱 铮,陈丽燕,孙 艳,肖静文
南通大学附属南通第三医院病理科,江苏 南通 226006
精氨酸酶-2(arginase-2,ARG-2)是一种双核含锰的金属酶,它催化L-精氨酸水解成L-鸟氨酸和尿素,在生物体的新陈代谢中起着十分重要的作用。在人类多种恶性肿瘤中均可以检测到ARG-2异常表达。我们前期的研究发现,ARG-2在肝细胞癌(hepatocellular carcinoma,HCC)组织中表达明显升高,并且ARG-2与HCC组织学分级相关[1]。本研究拟进一步探讨HCC中ARG-2的异常表达与HCC细胞增殖、凋亡的相关问题。
1 材料和方法
1.1 临床资料
筛选南通大学附属南通市第三医院2005年1月—2012年10月经手术切除的158例HCC患者标本。患者年龄19~81岁,平均年龄52.9岁;其中男性133例,女性25例;有详细的临床资料,包括血清AFP水平、HBsAg检测结果和病理检查相关结果。取上述158例HCC患者中14例的癌组织及相应癌旁肝组织新鲜标本,和12例肝血管瘤及2例肝外伤患者手术切除的正常肝组织,液氮冻存备用。本研究组所有患者术前均未接受相关治疗,经患者知情同意并签署知情同意书,上报医院伦理委员会批准。术后电话随访本组患者,158例患者中共132例成功随访,26例失访,随访时间为3~60个月,随访频率为每3个月1次。
1.2 主要试剂
TRIzol试剂盒购自美国Invitrogen公司,反转录-聚合酶链式反应(reverse transcriptionpolymerase chain reaction,RT-PCR)试剂盒购自宝生物工程(大连)有限公司,兔抗人单克隆ARG-2抗体购自Santa Cruz公司,兔抗人Ki-67单克隆抗体购自福州迈新生物技术有限公司,兔抗人cyclin D1单克隆抗体购自基因科技(上海)有限公司,小鼠抗人单克隆caspase-3抗体、兔抗人多克隆caspase-8抗体、兔抗人单克隆caspase-9抗体均购自艾博抗(上海)贸易有限公司,辣根过氧化物酶(HRP)偶联的山羊抗兔/小鼠通用型二抗工作液及免疫组织化学试剂盒购自基因科技(上海)有限公司,山羊抗兔IgG H&L(Alexa Fluor®488)荧光二抗、山羊抗小鼠IgG H&L(Alexa Fluor®568)荧光二抗均购自艾博抗(上海)贸易有限公司,细胞凋亡-Hoechst染色试剂盒购自上海碧云天生物技术有限公司。
1.3 RT-PCR实验
按TRIzol说明书提取总RNA,采用紫外分光光度计测定吸光度(D)值260 nm及280 nm值,计算RNA总含量,反转录反应根据产品使用说明进行,将所获cDNA于-20 ℃保存备用。ARG-2基因上、下游引物分别为:5’-AAGCTGGCTTGATGAAAAGGC-3’,5’-GCGTGGATTCACTATCAGGTTGT-3’,产物长度119bp;GAPDH基因上、下游引物分别为5’-CCATTTGCAGTGGCAAAG-3’,5’-CACCCCATTTGATGTTAGTG-3’,产物长度202 bp。反应体系:20 μL。反应条件:94 ℃5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 45 s,共25个循环;72 ℃ 8 min。取5 μL PCR扩增产物加入含2.5%核酸染料琼脂糖凝胶中,以80 V/cm电压电泳40 min,在紫外线下可见相应长度的目的基因和内参的扩增条带,将电泳结果直接置于凝胶分析系统中对条带进行分析。
1.4 免疫组织化学检测及结果判定
免疫组织化学染色采用EnVision二步法,参照试剂盒说明书进行。所有标本经4%的中性甲醛溶液固定,常规组织学方法处理,4 μm厚连续切片,分别行H-E和免疫组织化学染色,实验均设阳性和阴性对照。免疫组织化学染色结果由两位高年资病理医师在“双盲”条件下进行评定。采用半定量积分法对癌细胞染色强度和阳性细胞所占百分比进行评分。将染色强度分为4级:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;染色细胞所占的百分比:每张切片在400倍光学显微镜下随机选择5个视野,计数1 000个癌细胞,计算细胞阳性率,无阳性细胞为0分,1%~10%阳性细胞为1分,>10%~50%阳性细胞为2分,>50%~80%阳性细胞为3分,>80%~100%为4分。将两组评分相乘所得值,分为3个等级,0~1分为阴性(-),2~4分为弱阳性(+),5~12分为强阳性(++)。
1.5 免疫荧光双标记染色
手术新鲜标本置于4%的多聚甲醛中,4 ℃固定6~8 h,再依次移入20%、30%蔗糖溶液中(4 ℃)。待组织块沉底后,作冰冻连续切片,片厚5 μm。直接贴于黏附载玻片上,-80 ℃保存备用。将切片从-80 ℃环境中取出,37 ℃复温1 h后,用0.01 mol/L的PBS洗3次,每次10 min;滴加二抗来源(山羊)血清封闭室温2 h;甩去多余血清,加入一抗混合液:兔抗ARG-2(1∶100)以及小鼠抗caspase-3(1∶100),室温温育1 h后4 ℃温育12~14 h;用0.01 mol/L的PBS洗3次,每次10 min;擦去多余水分,滴加荧光二抗室温温育2 h;用0.01 mol/L的PBS洗3次,每次10 min;以抗荧光淬灭封片液封片,4 ℃避光保存于湿盒中。荧光显微镜下观察并拍照。
1.6 统计学处理
应用SPSS 17.0统计软件分析处理数据,免疫组织化学结果采用χ2检验分析,各组之间比较采用Spearman秩相关分析;对随访资料用log-rank检验并做出Kaplan-Meier生存曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 ARG-2在HCC组织中的表达情况
在mRNA水平上,ARG-2在正常肝组织、癌旁组织均无表达。在HCC组织中的表达明显增加(图1)。统计结果显示,HCC组织中ARG-2 mRNA表达水平明显高于正常肝组织和癌旁组织,其差异有统计学意义(P<0.01)。
在蛋白水平上,本研究组已发表的数据显示[1]:ARG-2在癌旁肝组织和正常肝组织不表达,在HCC组织中的表达高于癌旁肝组织和正常肝组织(P<0.01)。免疫组织化学检测结果显示,ARG-2的阳性染色定位于HCC细胞的细胞质内(图2)。
2.2 ARG-2表达与细胞增殖相关分子Ki-67、cyclin D1表达的相关性
结果显示,ARG-2表达与细胞Ki-67、cyclin D1表达呈正相关(分别r=0.247 8,P<0.01;r=0.372 7,P<0.01,表1,图2)。
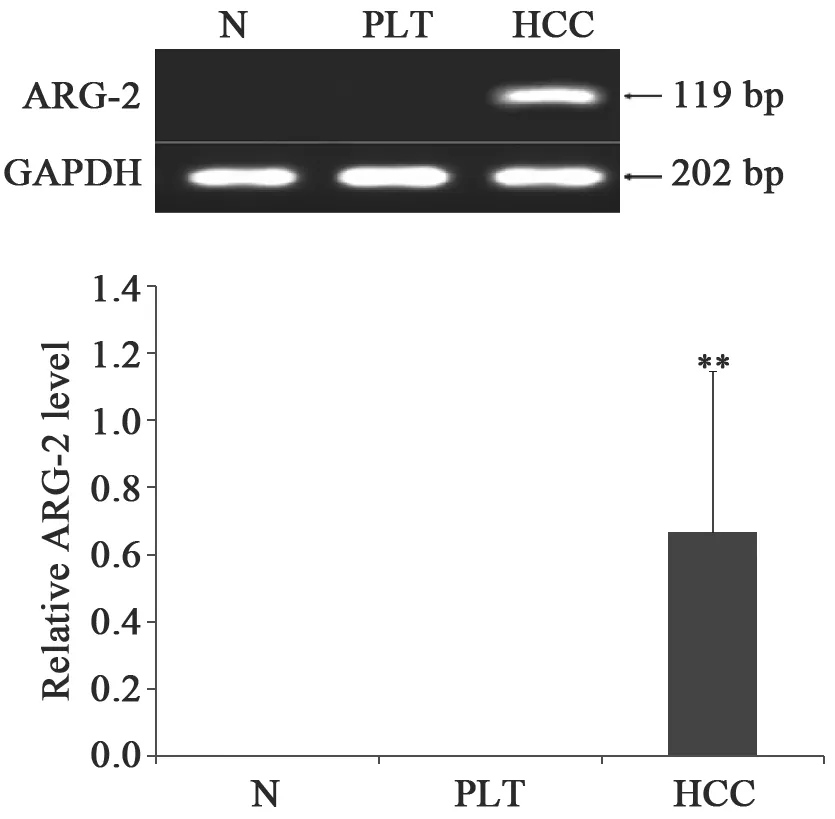
图 1 RT-PCR分析ARG-2 mRNA在正常肝组织、癌旁组织及HCC中的表达Fig. 1 RT-PCR analysis of ARG-2 mRNA expression in normal liver tissues, para-cancerous liver tissues and HCC tissues
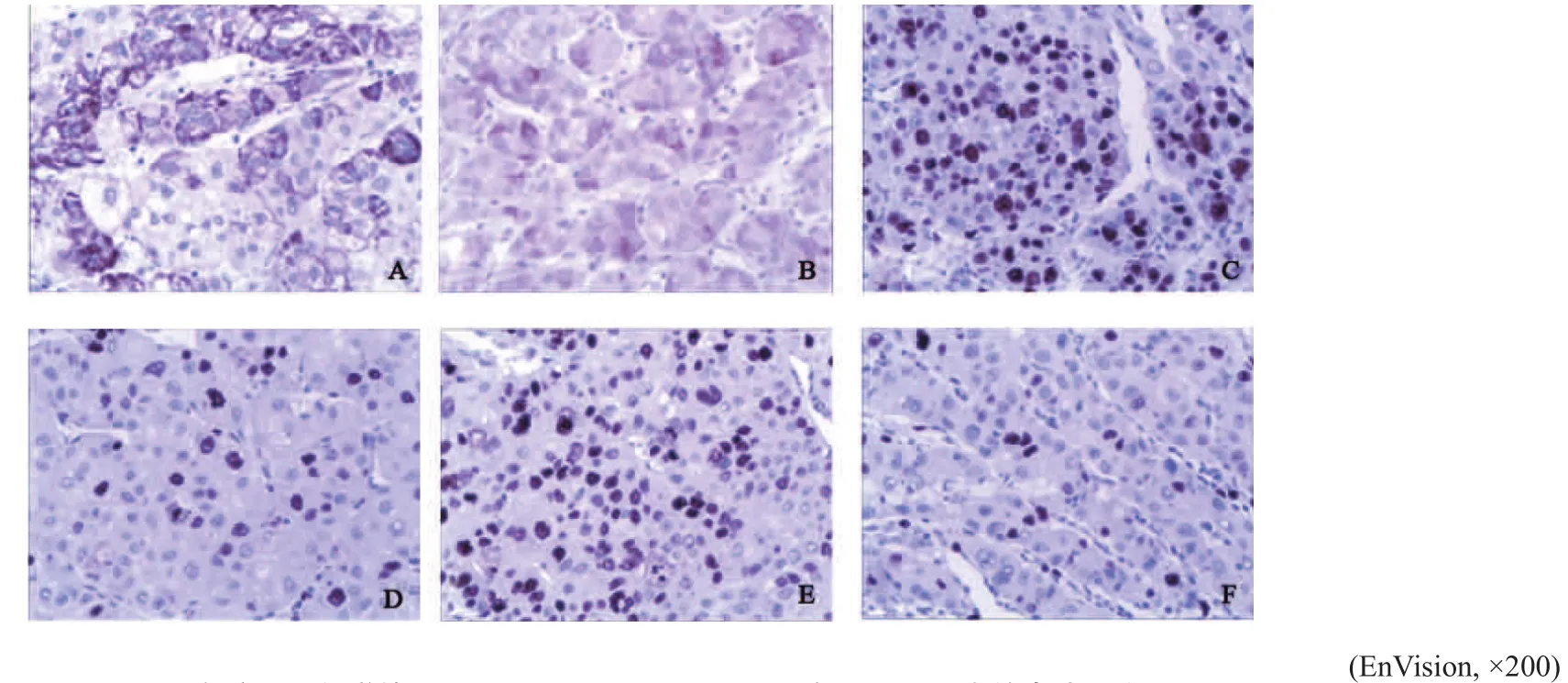
图 2 免疫组织化学检测ARG-2、Ki-67和cyclin D1在HCC组织中的表达及定位Fig. 2 Immunohistochemical analysis of the expressions of Arg-2, Ki-67 and cyclin D1 and their localization in HCC tissues
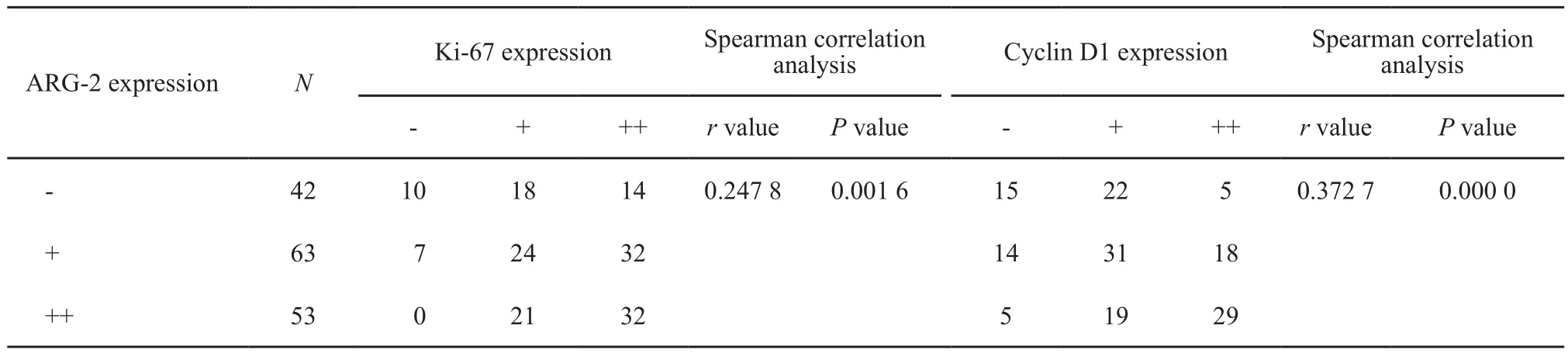
表 1 158例HCC组织中ARG-2表达与Ki-67、cyclin D1表达的相关性分析Tab. 1 The correlation of ARG-2 expression to Ki-67 and cyclin D1 expressions in 158 HCC tissues
2.3 ARG-2表达与凋亡相关蛋白caspase-3、caspase-8、caspase-9表达的相关性
本研究组进一步运用免疫组织化学方法分析158例HCC组织中ARG-2表达与caspase-3、caspase-8和caspase-9表达的相关性,结果显示:ARG-2表达与caspase-3、caspase-8表达呈正相关(r=0.191 0,P<0.05;r=0.180 5,P<0.05);而与caspase-9表达无明显相关性(r=0.108 9,P>0.05,表2)。
2.4 ARG-2与凋亡相关蛋白活化的caspase-3表达有共定位分析
为进一步分析ARG-2与细胞凋亡的相关性,我们运用免疫荧光双标记法检测HCC组织中ARG-2蛋白与活化的caspase-3共表达情况,结果显示,ARG-2与活化的caspase-3存在共表达(图3)。
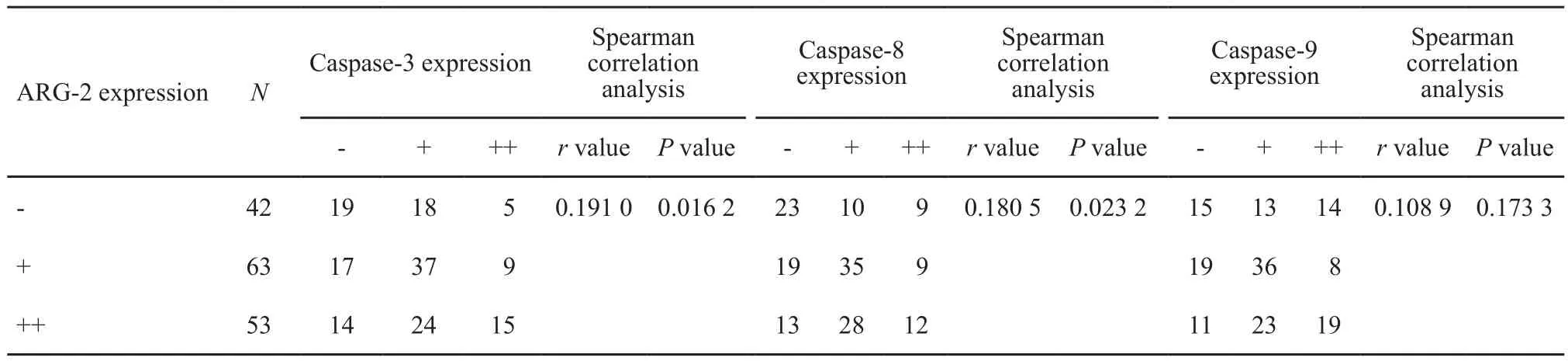
表 2 158例HCC组织中ARG-2表达与caspase-3, caspase-8, caspase-9表达的相关性分析Tab. 2 Correlation of ARG-2 expression to caspase-3, caspase-8 and caspase-9 expressions in 158 HCC tissues
2.5 ARG-2在凋亡癌细胞中的表达
运用细胞凋亡-Hoechst染色试剂盒检测HCC组织中凋亡细胞,结果显示,凋亡细胞的细胞核致密浓染,Arg阳性信号与凋亡细胞有共定位(图4)。
2.6 ARG-2蛋白与HCC患者预后的相关性分析
将HCC患者分为ARG-2(-)、ARG-2(+)和ARG-2(++)组,应用Kaplan-Meier法进行生存分析并绘制生存曲线,组间生存率比较用log-rank检验,结果显示:ARG-2(-)组中位生存时间为32个月,ARG-2(+)组中位生存时间为18个月,ARG-2(++)组中位生存时间为15个月,各组间差异有统计学意义,ARG-2(-)组高于ARG-2(+)和ARG-2(++)组(χ2=12.278,P=0.002,图5)。
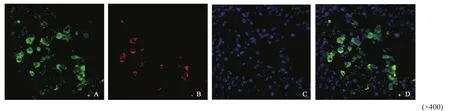
图 3 免疫荧光双标记显示ARG-2与活化的caspase-3有共表达Fig. 3 Immunofluorescence double labeling showed that ARG-2 was co-expressed with activated caspase-3
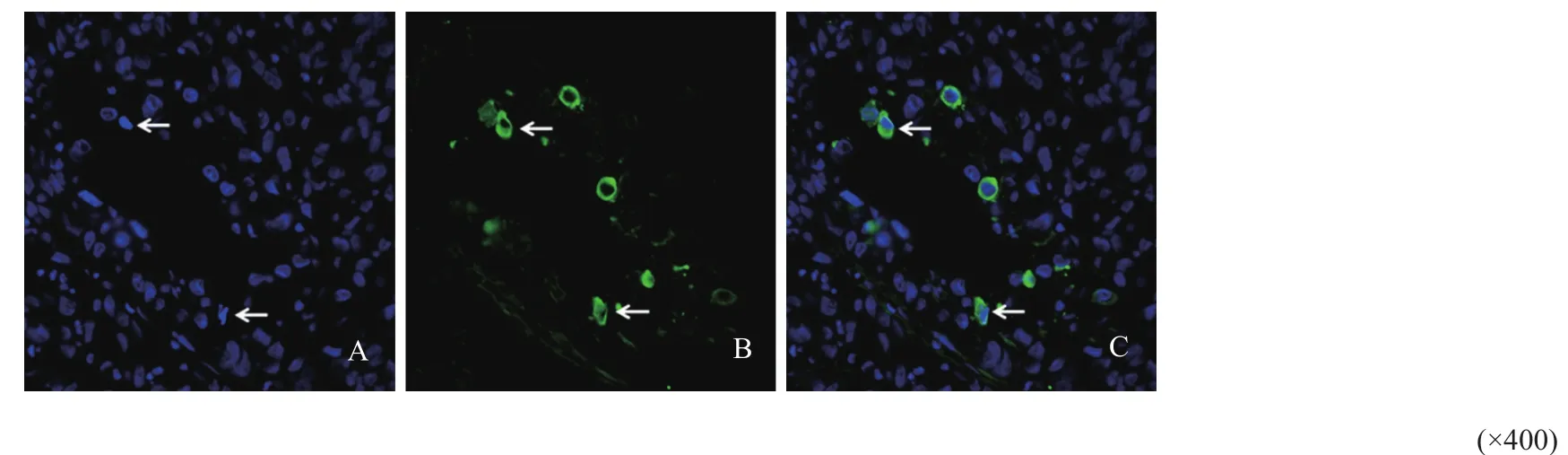
图 4 免疫荧光检测ARG-2与凋亡细胞的共表达情况Fig. 4 The co-expression of ARG-2 and apoptotic cells was detected by immunofluorescence
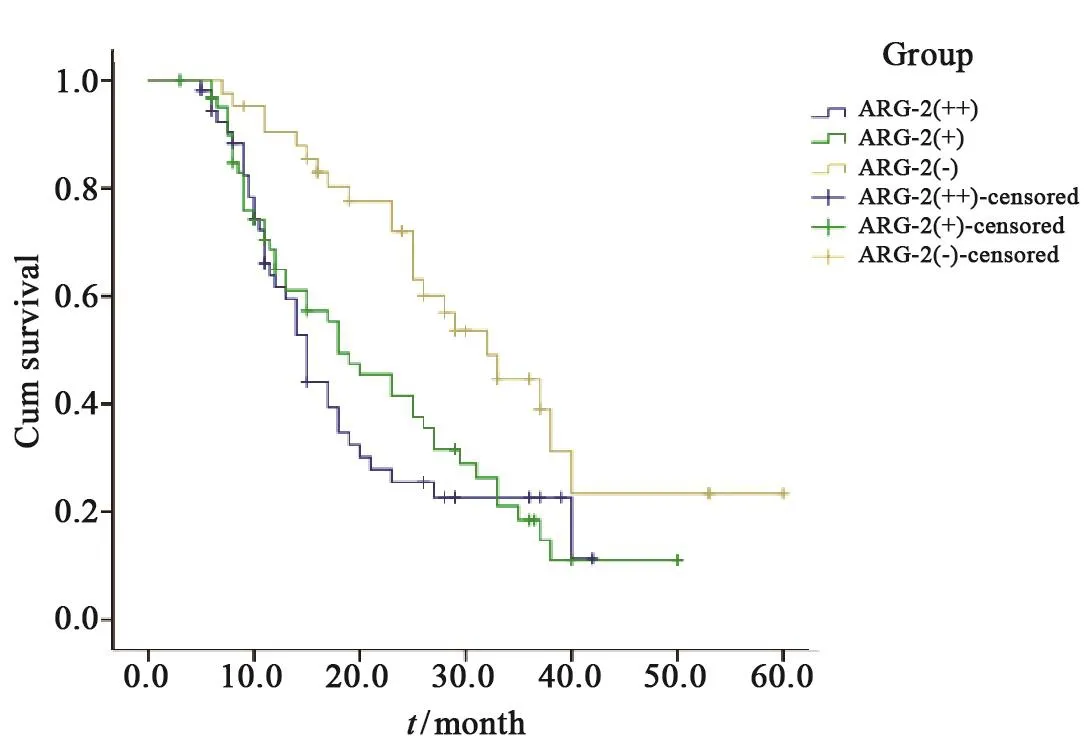
图 5 ARG-2(-)、ARG-2(+)和ARG-2(++)组HCC患者生存曲线Fig. 5 Survival curves of HCC patients in ARG-2(-), ARG-2(+) and ARG-2(++) groups
3 讨 论
目前发现Arg存在两种形式的同工酶:Arg-1型和ARG-2型,两者大约有60%的氨基酸序列一致,二者主要的区别在于表达部位、染色体定位等的不同[2-3]。ARG-2是一种线粒体酶,相对分子质量为39×103,其基因定位于14q24.1-24.3染色体,有着广泛的组织分布,主要在肾脏、脑、小肠、前列腺、乳腺以及巨噬细胞中表达[4-5]。ARG-2在不同的组织和器官中发挥着不同的作用,尤其对人体的新陈代谢、免疫功能调节等方面发挥着重要的作用。
本研究结果显示,ARG-2表达与Ki-67、cyclin D1表达呈正相关,表明ARG-2与HCC癌细胞增殖相关,可能参与调节HCC细胞增殖过程;已有研究发现,ARG-2在前列腺癌以及乳腺癌等中表达水平增加[6-7];在胶质母细胞瘤中,过表达ARG-2能够促进基质金属蛋白酶2/9 (matrix metalloproteinase 2/9,MMP2/9)表达,进而增强了肿瘤细胞增殖、迁移、侵袭及血管生成的恶性生物学行为能力[8]。表明ARG-2是部分肿瘤细胞生长、增殖的必需因素。另外,ARG-2通过催化精氨酸生成鸟氨酸,鸟氨酸进一步代谢为精胺、亚精胺等多胺,多胺又是细胞增殖和分化的重要组分,其在促进细胞增殖过程中发挥极其重要的作用[9-10]。总之,ARG-2可通过多种途径影响肿瘤细胞的增殖,而具体调控HCC增殖的方式还有待进一步的研究。
本研究采用免疫组织化学方法分析HCC组织中ARG-2表达与caspase-3、caspase-8和caspase-9表达的相关性,结果显示,ARG-2表达与caspase-3、caspase-8表达呈正相关;免疫荧光双标记结果显示,ARG-2与活化的caspase-3有共表达,并且ARG-2阳性信号与凋亡细胞有共定位;表明ARG-2可能参与调节HCC细胞的凋亡过程。Shosha等[11]的研究显示,在缺血再灌注损伤模型中神经元血管损伤凋亡是由高表达的ARG-2所介导的,ARG-2的表达缺失能明显减轻神经元血管损伤凋亡。McGovern等[12]在Nature杂志发表的研究结果表明,ARG-2在人胚胎发育过程中发挥着重要的免疫调节作用,胎儿树突状细胞通过ARG-2的活化促进调节性T淋巴细胞增殖,同时抑制T细胞产生肿瘤坏死因子α(tumour necrosis factor-α,TNF-α)发挥免疫抑制作用;ARG-2在HCC中的高表达可能也发挥免疫调节作用,进而影响肿瘤细胞的凋亡。ARG-2调控HCC细胞凋亡的具体机制还有待进一步的研究。另外,本研究还明确了ARG-2蛋白与HCC患者预后的相关性,ARG-2阳性表达提示更差的预后。
综上所述,ARG-2可能参与调节HCC细胞增殖、凋亡的过程,检测HCC组织中ARG-2的表达可以作为提示预后的参考指标。进一步研究ARG-2影响HCC生物学行为的作用机制可以为寻找新的HCC治疗靶点提供依据。
[1] 肖 锋,邵建国,钱 铮,等. 精氨酸酶2在肝细胞癌组织中的表达及临床意义[J]. 第二军医大学学报,2013,34(2): 155-159.
[2] MARKUS M. Arginase: an emerging key player in the mammalian immune system[J]. Br J Pharmacol, 2009, 158:638-651.
[3] 顾春燕,肖 锋,钱 铮,等. 精氨酸酶-1在肝细胞癌中的低表达及其临床意义[J]. 中国癌症杂志,2014, 24(6):438-445.
[4] ZHANG X, ZHANG J, ZHANG R, et al. Structural, enzymatic and biochemical studies on Helicobacter pylori arginase[J].Int J Biochem Cell Biol, 2013, 45(5): 995-1002.
[5] CHOI S, PARK C, AHN M, et al. Immunohistochemical study of arginase 1and 2 in various tissues of rats[J]. Acta Histochem,2012, 114(5): 487-494.
[6] GANNON P O, GODIN-ETHIER J, HASSLER M, et al.Androgen-regulated expression of arginase 1, arginase 2 and interleukin-8 in human prostate cancer[J]. PLoS One, 2010,5(8): e12107.
[7] PEREZ G, OLIVARES IM, RODRIGUEZ MG, et al. Arginase activity in patients with breast cancer: an analysis of plasma,tumors, and its relationship with the presence of the estrogen receptor[J]. Onkologie, 2012, 35: 570-574.
[8] COSTA H, XU X, OVERBEEK G, et al. Human cytomegalovirus may promote tumour progression by upregulating arginase-2[J]. Oncotarget, 2016, 7(30): 47221-47231.
[9] DIOGUARDI F S. The challenge of complexity and arginine metabolism[J]. Am J Clin Nutr, 2013, 98(2): 507-508.
[10] TONG B C, BARBUL A. Cellular and physiological effects of arginine[J]. Mini Rev Med Chem, 2004, 4(8): 823-832.
[11] SHOSHA E, XU Z, YOKOTA H, et al. Arginase 2 promotes neurovascular degeneration during ischemia/reperfusion injury[J]. Cell Death Dis, 2016, 7(11): e2483.
[12] MCGOVERN N, SHIN A, LOW G, et al. Human fetal dendritic cells promote prenatal T-cell immune suppression through arginase-2[J]. Nature, 2017, 546(7660): 662-666.

