动态对比增强磁共振成像感兴趣区勾画技术在乳腺癌诊断中的临床研究
钱利萍,周长玉,谢铁明,刘玉凤,喻迎星,许茂盛
1.浙江中医药大学第一临床医学院,浙江 杭州310006;
2.杭州市肿瘤医院放射科,浙江 杭州310002;
3.浙江省肿瘤医院放射科,浙江 杭州310022
动态对比增强磁共振(dynamic contrastenhanced magnetic resonance imaging,DCEMRI)是一种无创的、可通过一定的药代动力学模型计算出动态增强的定量参数、在体内分析肿瘤新生血管变化从而监测和预测肿瘤患者化疗反应的可靠成像手段。乳腺癌是女性常见的恶性肿瘤,利用DCE-MRI评价乳腺癌新辅助化疗疗效评估的研究颇多,但大多数研究并未针对感兴趣区(region of interest,ROI)不同勾画对磁共振功能参数变异性进行研究。既往研究往往采用一种ROI勾画方法研究肿瘤的动力学参数,存在主观臆断的可能性,忽略了同一观察者或不同观察者间变异性给研究带来的测量误差。
另外,DCE-MRI在乳腺癌治疗(包括强化形态、肿块大小、病理分级、淋巴结状态、疗效预测等)的相关性研究尚处于探索阶段,尤其在疗效预测上,不同研究的结果具有较大差异[1-3]。本研究拟通过4种不同ROI勾画方法评估不同观察者间及观察者内功能参数测量的变异性,寻找一种测量方法可靠、不同研究中心可重复性好的ROI勾画法,为临床上DCE-MRI功能参数在乳腺癌治疗反应监测中提供较好的研究方法及理论基础。
1 资料和方法
1.1 临床资料
2015年1月—2016年12月就诊于浙江省中医院的女性乳腺癌患者共30例,中位年龄54岁(32~63岁)。所有患者均经病理学明确诊断。治疗前均接受DCE-MRI检查。肿瘤分期依据国际抗癌联盟(Union for International Cancer Control)和美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7版乳腺癌分期,全组T分期中T1分期3例,T2期5例,T3期12例,T4期10例。
1.2 检查方法
采用GE公司SIGNA Excite HDx 3.0T磁共振扫描仪,HD 8通道专用乳腺相控线圈。患者取俯卧位,双侧乳房自然悬垂于线圈内。常规检查:扫描包括横轴位、冠状位、矢状位检查。序列包括T1WI、T2WI加脂肪抑制序列。T1WI扫描参数为:TR=960 ms,TE=9.3 ms,层厚5 mm,层间距0.5 mm,FOV=24 cm×24 cm,矩阵256×256,NEX=2;T2WI:TR=5 220 ms,TE=47.2 ms,层厚5 mm,层间距0.5 mm,FOV=24 cm×24 cm,矩阵256×256,NEX=2。脂肪抑制序列:TR=5.0 ms,TE=1.9 ms,层厚5 mm,层间距0.5 mm,矩阵256×256,NEX=2,FOV=24 cm×24 cm。动态增强磁共振检查:为获取DCE-MRI的3个定量参数值,需先行T1原始值图(T1map图)的扫描,在增强前通过小翻转角的T1map图与大翻转角的蒙片图拟合,计算出定量的T1值。随后于相同参数下行动态扫描,结合原始T1值获得各定量参数及其伪彩图。具体扫描如下:乳腺容积成像(volume imaging for breast assessment,VIBRANT)序列横断面扫描(TR=4.4 ms,TE=2.1 ms,层厚2 mm,层间隔0 mm,矩阵416×320,NEX=0.75次,FOV=34 cm),分别于注药前、注药后即刻、注药后70、140、210、280、350、420、490、560和630 s扫描,单次扫描时间为68 s。
1.3 图像分析
所有图像均采用iCAD软件(Nashua,NH)基于Tofts两室模型分析得到3种功能学参数,容量转移常数(volume transfer constant,Ktrans)指对比剂从血管内扩散到血管外的速度常数,细胞外间隙容积比(extracellular volume fraction,Ve)指血管外细胞外间隙占整个体素的容积比,速率常数(rate constant,Kep)指组织间对比剂经扩散重新回到血管内的速度常数。ROI勾画分别由两位从事乳腺磁共振诊断5年以上工作经验的放射科医师完成,采用下述4种方法分别勾画:① 全部瘤床区(Whole);② 最大强化层面(SliceMax);③含最大强化层面连续3层(Partial);④最大强化层面5%连续强化区域(5Max)。分别计算4种ROI勾画方法下功能参数值,并利用Bland-Altman方法评价观察者间及观察者内测量一致性。
1.4 统计学处理
2 结 果
2.1 临床资料
30例局部进展期乳腺癌患者全部为女性,年龄范围在32~63岁,中位年龄为54岁。
共有30个病灶,其中13个病灶位于左乳,17个病灶位于右乳。均于治疗前穿刺活检证实,组织病理学诊断结果显示,均为浸润性导管癌。
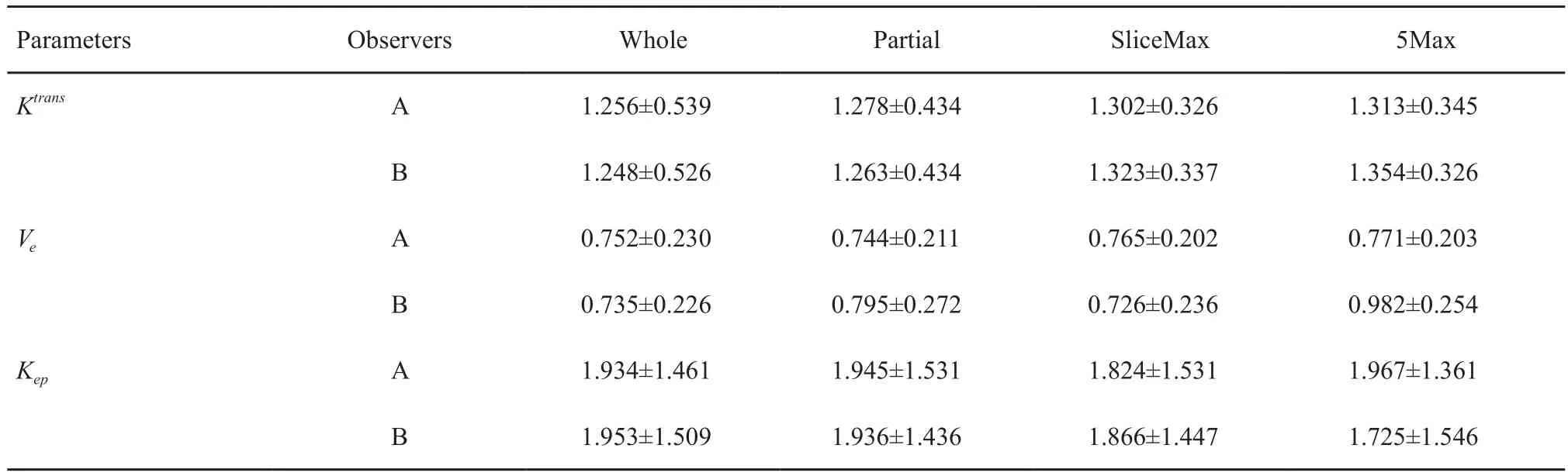
表 1 观察者A、B通过4种ROI勾画方法测量得到的功能参数值Tab. 1 Values of functional parameters based on four contouring methods of ROIs reported by observer A and B
2.2 不同观察者4种ROI勾画方法下测量乳腺瘤床区动态功能参数
将所有DCE-MRI图像利用软件分析,分别测量4种ROI勾画方法下功能参数Ktrans、Ve和Kep(表1)。分别将不同观察者采用4种ROI勾画方法得出的功能参数行Bonferroni检验,结果提示5Max法相较其他3种方法差异有统计学意义(P<0.05)。
2.3 不同观察者采用同一ROI勾画方法下测量乳腺瘤床区动态功能参数Ktrans一致性分析
分别将不同观察者同一ROI勾画方法下测量动态功能参数行Bland-Altman一致性分析,得出Whole法、SliceMax法、Partial、5Max方法下测量偏倚及95%CI,分别为0.002 vs -0.013~0.012、-0.003 vs -0.023~0.017、0.006 vs -0.018~0.029和-0.035 vs -0.054~0.018(图1)。前3种测量方法具有较好的观察者间一致性,而Max法不同观察者间测量一致性较差。

图 1 A、B两位观察者测量所得DCE-MRI功能参数Ktrans观察者间一致性Fig. 1 Inter-observer reproducibility of DCE-MRI fucntional parameters from observer A and B
3 讨 论
动态对比增强MRI检查通过综合病灶的形态学和动态强化特征,能较好地观察乳腺肿瘤的治疗反应,为早期预测乳腺癌化疗反应提供技术支持[4-5]。然而,正如其他功能成像方法一样,面临的较为突出的问题就是怎样寻找一种可靠的测量方法来保障功能参数观察者内及观察者间测量的一致性。
关于怎样勾画ROI,相关研究尚存在争议,并未达成一致。既往研究通常选择病灶最大径作为勾画ROI的层面,通过连续勾画强化区域从而获得功能参数值[6-7]。也有研究通过病灶最大层面为中心面,包含中心面和上、下2层共3个层面,测量每个层面强化最明显区,记录3个层面的定量DCE-MRI参数,取平均值[8-10]。另外也存在通过勾画全部肿瘤区域测定得出功能参数[11],其中包括或不包括坏死区域勾画方法[12-13]。在全部肿瘤区域勾画方法与强化明显区域选择性勾画方法的比较研究中,大多数学者愿意选择后者。Hayes等[14]在对15例局部晚期乳腺癌患者采用不同ROI勾画方法预测治疗反应的研究中,发现“逐点”勾画法与“热点”勾画法得到的动态参数具有相同的中位数值,而前者直方图上极(即“热点区”)具有更大的变化幅度。而Pickles等[15]研究得出“热点”勾画法更有利于预测肿瘤治疗反应。因此,不同ROI勾画方法在测量的时候可能具有不同的优势。
鉴于上述方法的不同优势,然而,有关不同ROI勾画方法选择的研究较少。本研究通过应用DCE-MRI技术比较不同ROI勾画下动态增强参数的一致性。结果显示同一观察者应用4种ROI勾画方法得出功能参数之间,除5Max方法外,其他方法之间差异无统计学意义,表明其他3种ROI勾画方法之间数据测量差异无统计学意义,间接揭示3种测量方法能够获得较好的观察者内一致性。类似的结果在头颈部肿瘤中应用也得到支持[16],该研究在18例头颈部鳞癌患者DCE-MRI图像中采用了与本研究中相同的ROI勾画方法,发现该方法具有较高的观察者内及观察者间平均变异系数比(aRCV),可能与测量时具有较多的离群值有关。本研究发现,5MAX法测量时具有较多的数值偏离于95%CI,正是反映了该方法较大的离散趋势。
本研究提示通过Whole法、Partial法及SliceMax法测量所得动态增强参数之间具有较好的观察者内及观察者间一致性,提示3种方法测量所得参数间并未见明显差异。因此在勾画ROI时可以考虑采用较为简便的测量方法,如SliceMax法。基于该方法操作简便,另外尽可能排除部分容积效应给测量带来的干扰。
本研究的不足之处在于选择的样本量较小,给统计造成一定的偏差。另外,进一步开展多中心的协同研究可能为经验的积累以及最佳ROI勾画方法提供更多的宝贵意见。
总之,通过特定的感兴趣勾画方法利用DCE-MRI技术获得乳腺癌肿瘤区动态参数值,能够保证较好的观察者内及观察者间一致性,为进一步乳腺癌临床治疗提供技术支持。
[1] WANG C H, YIN F F, HORTON J, et al. Review of treatment assessment using DCE-MRI in breast cancer radiation therapy[J]. World J Methodol, 2014, 4(2): 46-58.
[2] PINKER K, HELBICH T H, MORRIS E A. The potential of multiparametric MRI of the breast[J]. Br J Radiol, 2017,90(1069): 20160715.
[3] 王世威, 许茂盛, 丁雪委, 等. 半定量双回波动态对比增强MRI诊断乳腺肿瘤的价值[J].中华放射学杂志, 2013,47(8): 695-698.
[4] FAN M, WU G, CHENG H, et al. Radiomic analysis of DCEMRI for prediction of response to neoadjuvant chemotherapy in breast cancer patients[J]. Eur J Radiol, 2017, 94: 140-147.
[5] THIBAULT G, TUDORICA A, AFZAL A, et al. DCE-MRI texture features for early prediction of breast cancer therapy response[J]. Tomography, 2017, 3(1): 23-32.
[6] 罗 禹, 王培军,周永明, 等. 磁共振动态增强灌注成像参数图在乳腺良恶性病变诊断中的价值[J]. 医学影像学杂志, 2016, 26(4): 649-654.
[7] FUJIMOTO K, UEDA Y, KUDOMI S, et al. Automatic ROI construction for analyzing time-signal intensity curve in dynamic contrast-enhanced MR imaging of the breast[J].Radiol Phys Technol, 2016, 9(1): 30-36.
[8] 王 瑞, 刘万花, 李丽环, 等. 动态对比增强MRI定量参数与乳腺癌预后因子的相关性研究[J]. 中华放射学杂志,2016, 50(12): 950-953.
[9] 丁 婕, 朱 蓉, 蓉黄宁, 等. 动态对比增强不同时间分辨率下MRI线性参照模型和双室Tofts模型鉴别乳腺良、恶性病变的价值[J]. 中华放射学杂志, 2015, 49(11): 828-832.
[10] 李瑞敏, 顾雅佳, 彭卫军, 等. 定量动态增强磁共振评估乳腺癌新辅助化疗疗效的应用研究[J].中国癌症杂志, 2016,26(7): 623-628.
[11] CHO N, IM S A, PARK I A, et al. Breast cancer: early prediction of response to neoadjuvant chemotherapy using parametric response maps for MR imaging[J]. Radiolog, 2014, 272(2):385-396.
[12] NEWBOLD K, CASTELLANO I, CHARLES-EDWARDS E,et al. An exploratory study into the role of dynamic contrastenhanced magnetic resonance imaging or perfusion computed tomography for detection of intratumoral hypoxia in head-andneck cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 74(1):29-37.
[13] BISDAS S, SEITZ O, MIDDENDORP M, et al. An exploratory pilot study into the association between microcirculatory parameters derived by MRI-based pharmacokinetic analysis and glucose utilization estimated by PET-CT imaging in head and neck cancer[J]. Eur Radiol, 2010, 20(10): 2358-2366.
[14] HAYES C, PADHANI A R, LEACH M O. Assessing changes in tumour vascular function using dynamic contrast-enhanced magnetic resonance imaging[J]. NMR Biomed, 2002, 15(2):154-163.
[15] PICKLES M D, LOWRY M, MANTON D J, et al. Role of dynamic contrast enhanced MRI in monitoring early response of locally advanced breast cancer to neoadjuvant chemotherapy[J]. Breast Cancer Res Treat, 2005, 91(1): 1-10.
[16] CRACIUNESCU O I, YOO D S, CLELAND E, et al. Dynamic contrast-enhanced MRI in head-and-neck cancer: the impact of region of interest selection on the intra- and interpatient variability of pharmacokinetic parameters[J]. Int J Radiat Oncol Biol Phys, 2012, 82(3): e345-350.

