美国放射学会甲状腺结节影像报告系统和影像偶发甲状腺结节管理系列白皮书解读
刘如玉,张 波
中国医学科学院,北京协和医院超声医学科,北京100730
甲状腺结节是颈部最常见的疾病之一,人群中依靠触诊发现的结节达5%~10%[1],超声发现的甲状腺结节可达68%[2]。其中恶性结节占1.6%~12.0%[3-4]。约50%的恶性结节为微小癌,即最大径小于等于1 cm。全球范围内甲状腺癌的发病率都在增加,但死亡率基本保持稳定[5]。多数甲状腺恶性结节,特别是微小癌,具有惰性及非侵袭性行为,所以不必对发现的所有结节进行细针穿刺活检(fine-needle aspiration,FNA)和(或)手术切除目前已是共识[6-10]。因此对甲状腺结节进行恶性风险分层,并根据不同级别采取恰当的诊疗措施尤为重要。目前,超声是诊断甲状腺结节的首选检查方式,诊断准确率达74%~82%[12],优于其他影像学检查。但超声诊断存在观察者依赖性,不同观察者诊断效率不一。其中超声描述术语定义不一,是一致性较差的主要原因。建立标准化、规范化的报告系统是减少观察者差异,提升诊断水平的必经之路。自2009以来,一些专业学会和研究者提出了甲状腺影像报告及数据系统(Thyroid Imaging,Reporting and Data System,TI-RADS)[13-15],并根据超声风险分层推荐穿刺或随访[13-21],但标准各异,未被广泛使用。此外,随着高质量影像学的日益广泛应用,影像偶发甲状腺结节(incidental thyroid nodules,ITNs)(即:临床未发现或未怀疑,由影像检查偶然发现的甲状腺结节)愈来愈常见,超声发现的ITNs比例为20%~67%[22-23];胸部增强CT发现的为25%[24];CT及MRI发现的为16~18%[3,25];18FDG-PET发现的为1%~2%[26-27]。ITN多数为良性病变,体积较小,且恶性结节生物学行为多具有惰性特征。目前对于ITN的临床管理尚缺乏统一的规范标准。
自2012年起,美国放射学会(American College of Radiology,ACR)开始组建相关委员会,着手撰写甲状腺超声报告标准术语词典、基于超声报告词典的TI-RADS和ITNs临床管理路径。于2015年及2017年发表了“甲状腺超声报告词典:ACR TIRADS委员会白皮书”[28]和“ACR甲状腺影像报告和数据系统:ACR TI-RADS委员会白皮书”[29]。2015年发表了“影像偶发甲状腺结节管理:ACR偶发甲状腺结节委员会白皮书”[30]。该研究就以上3篇白皮书进行综述。
1 ACR TI-RADS
ACR TI-RADS委员会明确定义了甲状腺结节超声报告词典,包括成分、回声、形态、边缘和强回声5个征象。将每个特征的不同分类赋予不同分值,根据总分值赋予5种风险级别:TR1(良性)、TR2(非可疑恶性)、TR3(轻度可疑恶性)、TR4(中度可疑恶性)和TR5(高度可疑恶性)。结合病灶大小,推荐FNA和随访。
1.1 ACR TI-RADS超声报告词典[28]及评分[29]
1.1.1 成分
成分为描述结节的内部结构,即软组织及液体的组成比例。
⑴ 实性结节:结节完全或几乎完全由软组织组成,仅有极少的囊性成分(图1A),3 分。
⑵ 实性为主结节:软组织占结节体积的50%以上(图1B),1分。
⑶ 囊性为主结节:软组织占结节体积的50%以下(图1C),1分。
⑷ 囊性结节:完全为液性成分,0分。
⑸ 海绵征:主要由微小囊性成分组成,占结节体积的50%以上(图1D),0分。

图 1 成分Fig. 1 Composition
解释及说明:任何一个结节均符合5种分类中的一类,不易判断内部为出血还是实性成分时,采用彩色多普勒血流成像有助于鉴别诊断。15%~27%的实性结节为恶性结节[21],囊实性结节无论囊性为主还是实性为主,其恶性比例较低,前者约6.1%,后者约5.7%[31]。评估囊实性结节,最重要的是评估实性部分:如实性部分偏心且边缘呈锐角,恶性风险增加;实性部分为低回声分叶状、边缘不规则或点状强回声或有血流信号,恶性风险增加;如实性部分为等回声不偏心、边缘非锐角、边缘光滑、海绵征或彗星尾,良性可能性大。纯囊性或海绵征结节恶性风险极低[21]。海绵征有两种表现:其一为结节内超过50%的部分为微囊构成,52个结节中1个为恶性[32];其二为整个结节为微囊成分,210个结节中均为良性[33]。A: Solid nodule, a 46 years old male patient with 3.5 cm solid,hypoechoic nodule; Margins were smooth; Macrocalcifications were identified on other sections; Diagnosis: Medullary carcinoma; B:Predominately solid nodule, a 63 years old female patient with a 1.6 cm predominately solid, hyperechoic nodule; Margins were smooth;Note presence of punctate echogenic foci, and foci with small comet tail artifacts; Diagnosis: Colloid nodule (Bethesda 2); C: Predominately cystic nodule, a 26 years old male patient with a 4.5 cm predominately cystic nodule; Note solid components along superior/posterior wall(arrow); Diagnosis: Cystic nodule, non-diagnostic (Bethesda 1);Appearance of aspirate was consistent with old blood; Nodule recurred but no change over 2 years follow up; D: Spongiform nodule, a 49 years old female patient with 1.9 cm spongiform nodule in left lobe of thyroid; Diagnosis: Colloid nodule based on appearance, biopsy not performed
1.1.2 回声
结节内实性部分(非钙化)的回声水平,参照物为周围甲状腺组织。
⑴ 高回声:回声水平高于甲状腺组织(图2A),1分。
⑵ 等回声:回声水平与甲状腺组织相近,1分。
⑶ 低回声:回声水平低于甲状腺组织(图2B),2分。
⑷ 极低回声:回声水平低于邻近颈部肌肉(图2C),3分。
解释及说明:回声参照物应选择紧邻结节的正常甲状腺组织作对比。当甲状腺组织背景回声异常时,如桥本甲状腺炎,甲状腺结节实性成分的回声仍应以邻近甲状腺组织为参照,但需注明甲状腺组织背景回声改变情况。如果结节为混合回声,可以描述为以高回声、等回声或低回声为主。无回声评分0分,若回声不能确定,将回声评估为评分1分。
1.1.3 形态
纵横比大于1:横切面上前后径与横径之比大于1(图3),3分;反之为0分。
解释及说明:纵横比大于1是可疑恶性结节的重要超声特征。研究表明横切面和纵切面测量的纵横比差异无统计学意义[34-35]。为了测量简便一致,委员会选择横切面上测量的纵横比大于1作为标准。

图 2 [28] 回声Fig 2 Echogenicity
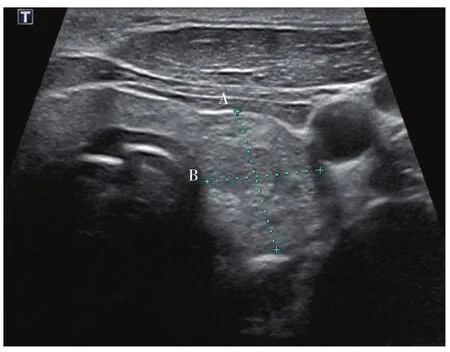
图 3 [28] 形态Fig. 3 Shape
1.1.4 大小
结节大小指纵切面测量最大长径、横切面测量前后径及横径。
解释及说明:结节大小不是乳头状甲状腺癌(papillary thyroid carcinoma,PTC)的独立预测因子。大结节更趋向系PTC以外的其他类型恶性结节,如滤泡癌、Hurthle或者其他类型癌[36]。目前多数学者认为对小于1 cm的结节穿刺活检应当更保守。近期的美国甲状腺学会(American Thyroid Association,ATA)指南[37]不推荐对大部分小于1 cm的结节进行穿刺活检。对于大于1 cm的结节,考虑到结节大小与恶性肿瘤风险之间的关系不明确,而其他超声特征的研究数据与结节恶性与否的关系更密切,委员会认为结节大小不应纳入TI-RADS评分标准内。
1.1.5 边缘
边缘是结节与甲状腺腺体组织或邻近腺体外结构的边界或界面。
⑴ 光滑:完整、规则的圆形或椭圆形(图4A),0分。
⑵ 边缘不规则:结节边缘有毛刺、锯齿或成锐角,伴或不伴周围组织浸润(图4B),2分。
⑶ 分叶:边缘局限性圆形软组织突入邻近腺体组织,单发或多发,大小不一(图4C),2分。
⑷ 边界不清:结节与甲状腺腺体组织边界难以辨认,无边缘不规则或分叶,0分。
⑸ 腺体外侵犯:结节延伸突破甲状腺被膜(图4D),3分。
⑹ 晕:由环绕结节周围的低回声形成的边界。完全或不完全环绕结节。可分为均匀细晕、均匀粗晕或不规则晕(辅助甲状腺结节形态判断及大小测量,未做相应评分)。
解释及说明:边界光滑常见于良性结节,33%~93%的恶性结节边缘光滑[32-44]。不规则或分叶状提示可疑恶性[45]。不规则边界体现了结节的侵袭性生长模式。边界不清不是恶性结节的特征,良性增生结节和甲状腺炎亦非常常见[32,40,46]。晕可能为结节周边的纤维包膜或假包膜。均匀的晕提示为良性结节,大部分恶性结节没有包膜。然而,10%~24%的恶性结节有完整或不完整的晕。甲状腺结节突破甲状腺被膜累及周围软组织提示侵袭性病变。由于之前对边缘的定义不一且观察者差异较大,分析这一特征的灵敏度及特异度具有一定的困难。若边缘不能确定,将边缘评估为0分。
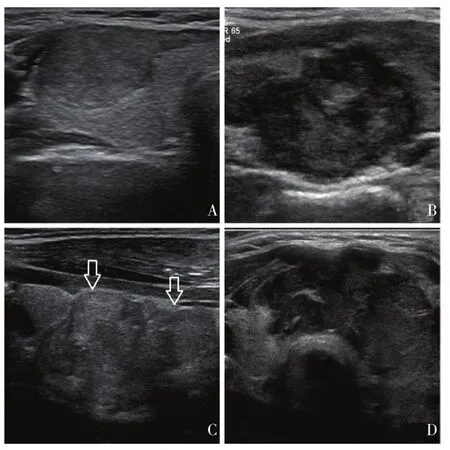
图 4 [28] 边缘Fig. 4 Margin
1.1.6 强回声灶
强回声灶为相对于周围组织回声显著增加的局部病灶,大小、形态不一,单发或簇状分布,后可伴声影。
⑴ 点状强回声:无后方声影,直径小于1 mm(图5A),包括实性成分内的小彗星尾征,3分。
⑵ 粗大钙化:后伴声影,可形态不规则(图5B),1分。
⑶ 周边钙化:钙化完全、部分环绕或占据结节的大部分边缘,常遮挡结节内部成分(图5C),2分。
⑷ 彗星尾征:彗星尾征是一种混响伪像,随深度增加回声衰减,宽度逐渐变窄,呈三角形。大彗星尾征:大于1 mm,0分;小彗星尾征:小于等于1 mm (图5D)。

图 5 [28] 强回声灶Fig. 5 Echogenic foci
解释及说明:强回声可以出现在良性、恶性结节。许多学者认为甲状腺结节内的点状强回声仅仅是微钙化,但是很多良性结节中亦可出现,因此把点状强回声定义为微钙化实为用词不当。点状强回声除了PTC的微钙化,还可以为一些不容易分辨的细小囊的后壁,这种现象在其他器官如卵巢和肾脏也很常见。尽管如此,点状强回声诊断恶性结节具有很高的特异度。粗大钙化结节的恶性风险增加,略高于原结节风险的2倍[32,39,47]。边缘钙化目前的研究结果不一致,一些研究表明恶性风险增加,而其他研究则相反[31,38]。最近有作者将慧尾征分为大小两种,15%具有小慧尾的结节为恶性[31],相反,在囊性或囊实性结节内发现大慧尾则良性可能性大[31,48]。对结节内的强回声,应该描述类型。如同一结节内有多种类型的强回声,均分别列举。如未出现强回声灶,无需描述。
1.2 ACR TI-RADS分级、随访[29](图6)
⑴ TR1,0分,良性。无需FNA。
⑵ TR2,2分,非可疑恶性。无需FNA。
⑶ TR3,3分,轻度可疑恶性。结节最大径大于等于2.5 cm,建议FNA;结节最大径大于等于1.5 cm,建议第1、3、5年随访。
⑷ TR4,4~6分,中度可疑恶性。结节最大径大于等于1.5 cm,建议FNA;结节最大径大于等于1.0 cm,建议第1、2、3、5年随访。
⑸ TR5,大于等于7分,高度可疑恶性。结节最大径大于等于1.0 cm,建议FNA;结节最大径大于等于0.5 cm,建议随访,每年1次至满5年。
解释及说明:随访满5年后,如结节大小不变,可停止影像学随访[49];若在随访过程中结节的ACR TI-RADS分级升高,则应在1年内重复进行超声检查。
1.3 报告注意事项
1.3.1 轴向测量
轴向测量3个径(图7):① 横切面最大径;②同一图像上垂直于该所测径的最大径;③ 矢状面最大长径。特别注意:纵横比测量与之不同,为横切面上平行于光束的前后径与垂直于光束的横径之比。如果结节周边有晕,测量时注意将晕包括在内。
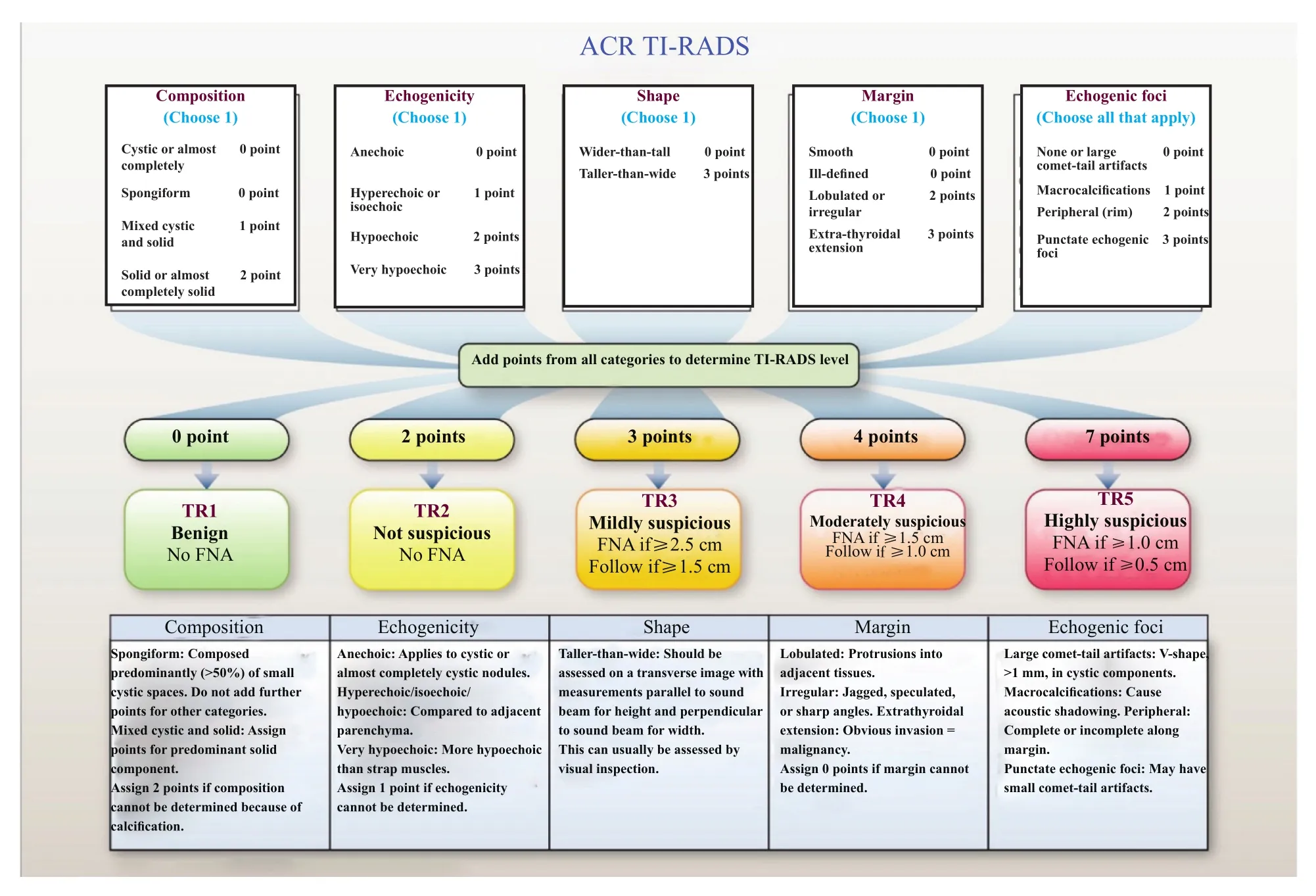
图 6 [29] ACR TI-RADS特征规范化系统5个特征类别、TR分级以及FNA指征或超声随访Fig. 6 Five categories on the basis of the ACR TI-RADS lexicon, TR levels, and criteria for FNA or ultrasound follow-up
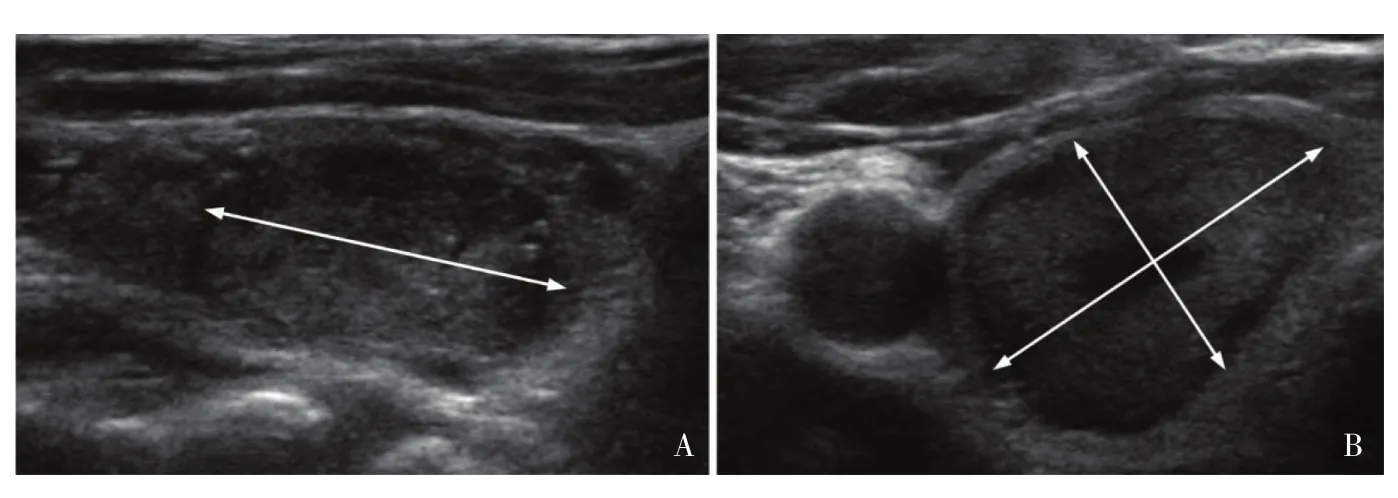
图 7 [29] 斜向等回声结节的矢状切面(A)及横切面(B)超声测量图像Fig. 7 The measurement of sagittal (A) and transverse (B) sonograms of an obliquely oriented hypoechoic nodule
1.3.2 结节位置
报告中应标明结节位置(左叶、右叶、峡部、上部、中部、下部,甚至侧方、中间、前方或后方),特别是甲状腺腺体回声不均或有多个结节时,为随访检测提供依据。
1.3.3 生长的定义
至少两个切面增长20%,并且最少增长2 mm或体积增大50%。
1.3.4 穿刺的结节数目
建议穿刺不超过两个ACR TI-RADS评分最高的结节,而不是体积最大的结节。
1.3.5 颈部淋巴结的评估
转移性淋巴结的特征:形态变圆,髓质消失,周边有血流,回声不均伴囊性部分及点状强回声。推荐对可疑淋巴结及最多两个甲状腺结节同时进行FNA。
2 影像偶发甲状腺结节管理
2.1 CT及MRI探查到的ITNs的管理[30](图8)
CT及MRI探查到的ITNs满足以下3个条件之一,则建议行超声评估:结节具有可疑恶性征象;结节大于等于1 cm且患者年龄小于35岁;结节大于等于1.5 cm且患者年龄大于等于35岁。可疑征象包括:淋巴结异常和(或)甲状腺结节侵袭局部组织器官。异常淋巴结征象包括:淋巴结肿大或伴囊性变、钙化和(或)增强强化。淋巴结肿大是指颈内静脉二腹肌淋巴结短径大于1.5 cm,其他区域淋巴结短径大于1 cm(注意:无论哪种影像学检查,单独运用短径来诊断淋巴结异常特异度均较低)。甲状腺癌淋巴结转移多见于Ⅳ区及Ⅵ区。
对于无可疑征象者,如预期寿命有限和(或)合并其他疾病,则无需进一步评估。除非临床医师认为有必要进一步评估或者患者或医师要求评估。对于普通人群,如患者年龄小于35岁且结节小于1 cm,年龄大于等于35岁且结节小于1.5 cm,无需进一步评估。如年龄小于35岁且结节大于等于1 cm,年龄大于等于35岁且结节大于等于1.5 cm,建议超声评估,根据超声表现推荐是否行FNA。
2.2 18FDG-PET及其他核医学检查探查到的ITNs的管理(图9)
2.2.1 局灶性摄取增多
预期寿命有限和(或)合并其他疾病,无需进一步评估,除非相关临床医师认为有必要进一步评估以及患者或医师要求评估;对普通人群建议行甲状腺超声评估。对于18FDG-PET高摄取ITNs,无论超声表现如何,均推荐行FNA;其他核医学高摄取结节,需根据超声表现推荐是否行FNA。
2.2.2 PET/CT或PET/MRI探查到的ITNs
PET/CT或PET/MRI探查到的ITNs且无转移性表现,管理方式同CT或MRI探查到的ITNs(图9)。
2.3 超声探查到的ITNs管理(图10)
超声探查到的ITNs是指在超声检查甲状腺以外结构时偶然发现的结节,如扫查颈部动脉、唾液腺、颈部淋巴结、甲状旁腺以及各种颈部包块。而因出现临床症状或触诊发现结节并不适用以下推荐。伴一个或多个可疑征象,建议甲状腺超声评估。超声可疑征象是指微钙化、极低回声、小分叶或边缘不规则和横切面纵横比大于1[14,46]。无可疑征象者同CT/MRI发现的ITNs。
3 结论
ACR TI-RADS和ACR ITNs管理路径白皮书是目前建立在最广泛的证据来源之上的关于甲状腺结节和偶发结节评估和临床管理的指南,适用范围广泛,相对简单,其优越性和局限性有待于在临床应用中验证和发现。目前一些委员会成员已经发起超声特征识别的观察者差异研究,当这一研究结果及其他证据出现后,将为修订该白皮书提供依据。

图 8 [30] CT及MRI探查到的ITNs管理流程图Fig. 8 Flowchart for ITNs detected by CT or MRI
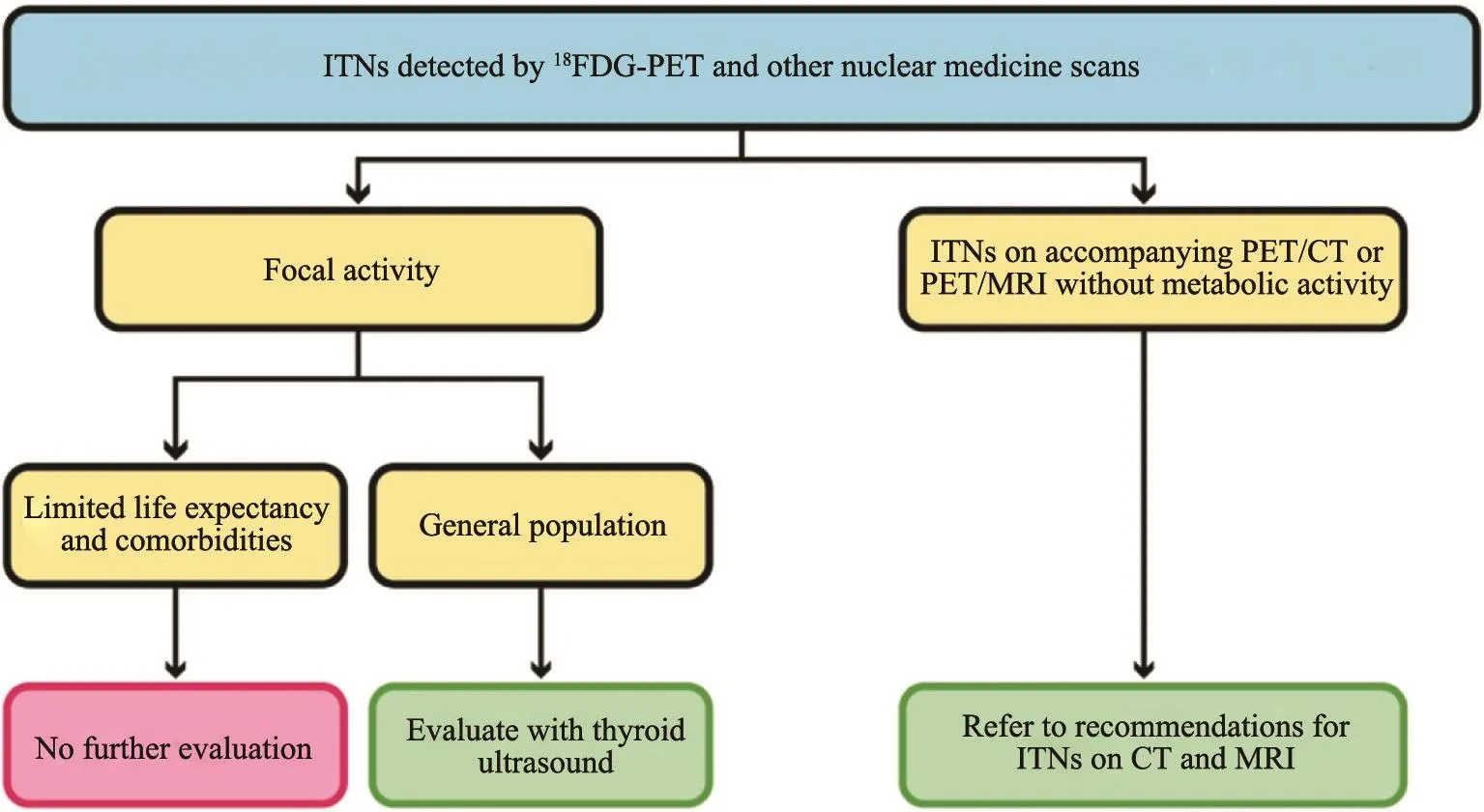
图 9 [30]18FDG-PET及其他核医学检查探查到的ITNs管理流程图Fig. 9 Flowchart for ITNs detected by 18FDG-PET and other nuclear medicine studies

图 10 [30] 甲状腺外结构超声检查探查到的ITNs管理流程图Fig. 10 Flowchart for ITNs detected by ultrasound for extrathyroidal structures
[1] EZZAT S, SARTI D A, CAIN D R, et al. Thyroid incidentalomas prevalence by palpation and ultrasonography [J]. Arch Intern Med, 1994, 154(16): 1838-1840.
[2] GUTH S, THEUNE U, ABERLE J, et al. Very high prevalence of thyroid nodules detected by high frequency (13 MHz)ultrasound examination [J]. Eur J Clin Invest, 2009, 39(8):699-706.
[3] NAM-GOONG I S, KIM H Y, GONG G, et al. Ultrasonographyguided fine-needle aspiration of thyroid incidentaloma:correlation with pathological findings [J]. Clin Endocrinol(Oxf), 2004, 60(1): 21-28.
[4] SMITH-BINDMAN R, LEBDA P, FELDSTEIN V A, et al.Risk of thyroid cancer based on thyroid ultrasound imaging characteristics: results of a population-based study [J].JAMA Intern Med, 2013, 173(19): 1788-1796.
[5] AHN H S, KIM H J, WELCH H G. Korea's thyroid-cancer"epidemic"-screening and over diagnosis [J]. New Engl J Med, 2014, 371(19): 1765-1767.
[6] VACCARELLA S, FRANCESCHI S, BRAY F, et al. Worldwide thyroid-cancer epidemic? The increasing impact of over diagnosis [J]. N Engl J Med, 2016, 375(7): 614-617.
[7] BAHL M, SOSA J A, NELSON R C, et al. Imaging-detected incidental thyroid nodules that undergo surgery: a single-center experience over 1 year [J]. AJNR Am J Neuroradiol, 2014,35(11): 2176-2180.
[8] KROEKER T R, LE NOBEL G, MERDAD M, et al. Outcomes of incidentally discovered thyroid nodules referred to a highvolume head and neck surgeon [J]. Head Neck, 2014, 36(1):126-129.
[9] HOBBS H A, BAHL M, NELSON R C, et al. Journal Club:incidental thyroid nodules detected at imaging: can diagnostic workup be reduced by use of the society of radiologists in ultrasound recommendations and the three-tiered system?[J]. AJR Am J Roentgenol, 2014, 202(1): 18-24.
[10] BONGIOVANNI M, SPITALE A, FAQUIN W C, et al. The bethesda system for reporting thyroid cytopathology: a metaanalysis [J]. Acta Cytol, 2012, 56(4): 333-339.
[11] ITO Y, URUNO T, NAKANO K, et al. An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid [J]. Thyroid, 2003, 13(4):381-387.
[12] JUN P, CHOW L C, JEFFREY R B. The sonographic features of papillary thyroid carcinomas: pictorial essay [J]. Ultrasound Q, 2005, 21(1): 39-45.
[13] PARK J Y, LEE H J, JANG H W, et al. A proposal for a thyroid imaging reporting and data system for ultrasound features of thyroid carcinoma [J]. Thyroid, 2009, 19(11): 1257-1264.
[14] KWAK J Y, HAN K H, YOON J H, et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk [J]. Radiology,2011, 260(3): 892-899.
[15] HORVATH E, MAJLIS S, ROSSI R, et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management [J]. J Clin Endocrinol Metab, 2009,94(5): 1748-1751.
[16] ZAYADEEN A R, ABU-YOUSEF M, BERBAUM K. Journal club: retrospective evaluation of ultrasound features of thyroid nodules to assess malignancy risk: a step toward TIRADS [J].AJR Am J Roentgenol, 2016, 207(3): 460-469.
[17] SHIN J H, BAEK J H, CHUNG J, et al. Ultrasonography diagnosis and imaging-based management of thyroid nodules:revised Korean Society of Thyroid Radiology consensus statement and recommendations [J]. Korean J Radiol, 2016,17(3): 370-395.
[18] SEO H, NA D G, KIM J H, et al. Ultrasound-based risk stratification for malignancy in thyroid nodules: a four-tier categorization system [J]. Eur Radiol, 2015, 25(7): 2153-2162.
[19] RUSS G. Risk stratification of thyroid nodules on ultrasonography with the French TI-RADS: description and reflections [J]. Ultrasonography, 2016, 35(1): 25-38.
[20] NA D G, BAEK J H, SUNG J Y, et al. Thyroid imaging reporting and data system risk stratification of thyroid nodules:categorization based on solidity and echogenicity [J].Thyroid, 2016, 26(4): 562-572.
[21] FRATES M C, BENSON C B, CHARBONEAU J W, et al.Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement[J]. Radiology, 2005, 237(3): 794-800.
[22] RAD M R, ZAKAVI S Z, LAYEGH P L, et al. Incidental thyroid abnormalities on carotid color Doppler ultrasound: frequency and clinical significance [J]. J Med Ultrasound, 2014, 23(1):25-28.
[23] EZZAT S, SARTI D A, CAIN D R, et al. Thyroid incidentalomas-prevalence by palpation and ultrasonography[J]. Arch Intern Med, 1994, 154(16): 1838-1840.
[24] AHMED S, HORTON K M, JEFFREY R B J R, et al. Incidental thyroid nodules on chest CT: review of the literature and management suggestions [J]. AJR Am J Roentgenol, 2010,195(5): 1066-1071.
[25] YOUSEM D M, HUANG T, LOEVNER L A, et al. Clinical and economic impact of incidental thyroid lesions found with CT and MR [J]. Am J Neuroradiol, 1997, 18(8): 1423-1428.
[26] SOELBERG K K, BONNEMA S J, BRIX T H, et al. Risk of malignancy in thyroid incidentalomas detected by F-18-fluorodeoxyglucose positron emission tomography: a systematic review [J]. Thyroid, 2012, 22(9): 918-925.
[27] SHIE P, CARDARELLI R, SPRAWLS K, et al. Systematic review: prevalence of malignant incidental thyroid nodules identified on fluorine-18 fluorodeoxyglucose positron emission tomography [J]. Nucl Med Commun, 2009, 30(9): 742-748.
[28] GRANT E G, TESSLER F N, HOANG J K, et al. Thyroid ultrasound reporting lexicon: white paper of the ACR thyroid imaging, reporting and data system (TIRADS) committee [J].J Am Coll Radiol, 2015, 12(12 Pt A): 1272-1279.
[29] TESSLER F N, MIDDLETON W D, GRANT E G, et al. ACR thyroid imaging, reporting and data system (TI-RADS): white paper of the ACR TI-RADS committee [J]. J Am Coll Radiol, 2017, 14(5): 587-595.
[30] HOANG J K, LANGER J E, MIDDLETON W D, et al. Managing incidental thyroid nodules detected on imaging: white paper of the ACR incidental thyroid findings committee [J]. J Am Coll Radiol, 2015, 12(2): 143-150.
[31] MALHI H, BELAND M D, CEN S Y, et al. Echogenic foci in thyroid nodules: significance of posterior acoustic artifacts[J].AJR Am J Roentgenol, 2014, 203(6):1310-1316.
[32] MOON W J, JUNG S L, LEE J H, et al. Benign and malignant thyroid nodules: US differentiation--multicenter retrospective study[J]. Radiology, 2008, 247(3):762-770.
[33] BONAVITA J A, MAYO J, BABB J, et al. Pattern recognition of benign nodules at ultrasound of the thyroid: which nodules can be left alone?[J]. AJR Am J Roentgenol, 2009, 193(1): 207-213.
[34] CHEN S P, HU Y P, CHEN B. Taller-than-wide sign for predicting thyroid microcarcinoma: comparison and combination of two ultrasonographic planes [J]. Ultrasound Med Biol,2014, 40(9): 2004-2011.
[35] MOON H J, KWAK J Y, KIM E K, et al. A taller-thanwide shape in thyroid nodules in transverse and longitudinal ultrasonographic planes and the prediction of malignancy [J].Thyroid, 2011, 21(11): 1249-1253.
[36] KAMRAN S C, MARQUSEE E, KIM M I, et al. Thyroid nodule size and prediction of cancer[J]. J Clin Endocrinol Metab,2013, 98(2): 564-570.
[37] HAUGEN B R, ALEXANDER E K, BIBLE K C, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer [J].Thyroid, 2016, 26(1): 1-133.
[38] KIM H G, MOON H J, KWAK J Y, et al. Diagnostic accuracy of the ultrasonographic features for subcentimeter thyroid nodules suggested by the revised American Thyroid Association guidelines[J]. Thyroid, 2013, 23(12):1583-1589.
[39] MOON H J, SUNG J M, KIM E K, et al. Diagnostic performance of gray-scale US and elastography in solid thyroid nodules[J].Radiology, 2012, 262(3): 1002-1013.
[40] AHN S S, KIM E K, KANG D R, et al. Biopsy of thyroid nodules: comparison of three sets of guidelines[J]. AJR Am J Roentgenol, 2010, 194(1): 31-37.
[41] FRATES M C, BENSON C B, DOUBILET P M, et al. Prevalence and distribution of carcinoma in patients with solitary and multiple thyroid nodules on sonography[J]. J Clin Endocrinol Metab, 2006, 91(9): 3411-3417.
[42] CHAN B K, DESSER T S, MCDOUGALL I R, et al. Common and uncommon sonographic features of papillary thyroid carcinoma[J]. J Ultrasound Med, 2003, 22(10): 1083-1090.
[43] PAPINI E, GUGLIELMI R, BIANCHINI A, et al. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features[J]. J Clin Endocrinol Metab, 2002, 87(5):1941-1946.
[44] HARACH H R, FRANSSILA K O, WASENIUS V M. Occult papillary carcinoma of the thyroid. A "normal" finding in Finland. A systematic autopsy study[J]. Cancer, 1985, 56(3):531-538.
[45] KIM E K, PARK C S, CHUNG W Y, et al. New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid[J]. AJR Am J Roentgenol, 2002, 178(3): 687-691.
[46] HOANG J K, LEE W K, LEE M, et al. US features of thyroid malignancy: pearls and pitfalls [J]. Radiographics, 2007,27(3): 847-860; discussion 61-65.
[47] KWAK J Y, HAN K H, YOON J H, et al. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk[J]. Radiology,2011, 260(3): 892-899.
[48] AHUJA A, CHICK W, KING W, et al. Clinical significance of the comet-tail artifact in thyroid ultrasound[J]. J Clin Ultrasound, 1996, 24(3): 129-133.
[49] DURANTE C, COSTANTE G, LUCISANO G, et al. The natural history of benign thyroid nodules [J]. JAMA, 2015, 313(9):926-935.

