黄芪甲苷对大鼠肺缺血再灌注损伤的保护作用及其机制研究
刘建平,何建峰
邯郸市中医院,河北 邯郸 056001
肺缺血再灌注损伤是临床上开展肺移植、体外循环心脏手术以及机体大出血时常发生的并发症,病理机制非常复杂,其中再灌注后肺水肿的出现、氧自由基的大量生成与过剩而诱发的氧化应激损伤以及继发性肺细胞凋亡被认为是造成肺缺血再灌注损伤的关键因素[1-2]。黄芪甲苷为我国传统中药黄芪的主要有效成分之一,具有抗炎、降血脂等多种药理学活性[3-4]。近年来,李铁成等[5]和马小亮等[6]通过动物实验研究发现,黄芪甲苷能够通过改善抗氧化酶活性、提高自由基清除能力、抑制细胞凋亡而表现出对肝组织缺血在灌注损伤大鼠和心肌缺血再灌注损伤大鼠的保护作用,但黄芪甲苷是否对肺缺血再灌注损伤大鼠具有保护作用尚未见文献报道。本实验通过夹闭左肺门45分钟后松夹的方法制备肺缺血再灌注损伤大鼠模型,研究黄芪甲苷对大鼠肺缺血再灌注损伤的保护作用。
1 材料与方法
1.1 药物与试剂 黄芪甲苷(成都锦泰和医药化学技术有限公司,批号:150114,纯度≥98%);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、髓过氧化物酶(MPO)、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所;HE、TUNEL试剂盒购于北京博奥森生物工程有限公司。
1.2 实验动物 清洁级雄性SD大鼠7周龄,体质量220~260 g,由河北省实验动物中心提供[动物实验许可证号:SCXK(冀)2013-1-003,动物实验合格证号:201410012]。
1.3 动物分组与模型制备 取50只实验用大鼠随机分为假手术组、模型组和黄芪甲苷低、中、高剂量组(20、40、80 mg/kg)组,每组 10 只;黄芪甲苷各治疗组分别于术前30分钟由腹腔注射给药,假手术组和模型组分别给予等体积的生理盐水。除假手术组外,其余各组大鼠均参照Xia ZY等[7]报道的方法制备肺缺血再灌注损伤大鼠模型:经腹腔注射乌拉坦实施麻醉后,行气管插管,连接动物呼吸机(设置频率为50次/min,呼吸比例为1∶1,潮气量为10 mL/kg),于左胸第4肋和第5肋间开胸,游离左肺门后,用无创血管夹闭左肺门,45分钟后松夹以恢复血流,整个过程辅助机械通气;假手术组行手术通路,除不夹闭左肺门外,其余操作同手术组。再灌注2小时后,实施麻醉后开腹经辅助动脉取血,1 500 rpm离心10分钟取上层血清;开胸取左肺下叶组织,进行各指标的检测。
1.4 肺组织W/D的测定 肺组织经生理盐水冲
洗干净并用滤纸吸干后,称重为湿重(W);置于60℃烘干箱 24小时后称重为干重(D),平行计算各组大鼠两者之比为肺组织W/D。
1.5 肺组织中抗氧化酶活性的检测 肺组织用冷生理盐水冲洗干净后,加入适量冷裂解液行研磨匀浆,按照各试剂盒操作方法步骤,通过紫外-可见分光光度计平行测定各组大鼠肺组织中抗氧化酶(SOD、GSH-Px、CAT)活性。
1.6 血清中M PO活性、M D A含量的检测 然后按照试剂盒操作步骤,通过紫外-可见分光光度计平行测定各组大鼠血清中MPO活性、MDA含量。
1.7 肺组织形态结构的观察 肺组织经4%多聚甲醛固定、石蜡包埋、切片(厚度为5 μm)和展片处理后,行常规HE染色,然后通过光学显微镜观察各组大鼠肺组织形态结构改变。
1.8 肺细胞凋亡状况的观察及凋亡指数 (A I)的计算 取经“1.7”项制备的肺组织石蜡切片,按试剂盒操作步骤依次进行处理后行TUNEL染色,然后通过光学显微镜平行观察肺组织细胞凋亡状况(细胞核黄褐色为阳性着色);AI的计算:每张切片随机选取6个视野,计数每个视野中肺细胞总数和阳性凋亡细胞数,然后计算各组大鼠肺组织细胞AI:AI(%)=(凋亡细胞数/肺总细胞数)×100%
1.9 统计学方法 运用SPSS 15.0进行统计分析,计量资料以(s)表示,组间均数比较采用单因素方差分析;计数资料采用 χ2检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 各组大鼠肺组织W/D 与假手术组比较,模型组大鼠肺组织W/D显著升高,差异有统计学意义(P<0.05);与模型组比较,黄芪甲苷中、高剂量组(40、80 mg/kg)W/D显著降低,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠肺组织W/D比较(s)
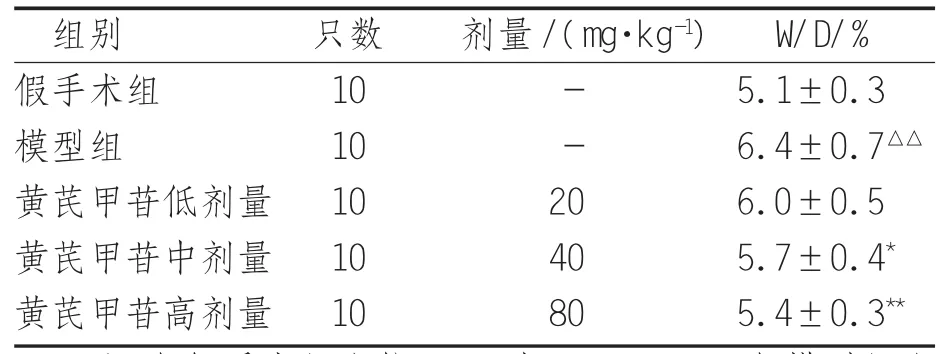
表1 各组大鼠肺组织W/D比较(s)
注:与假手术组比较,△△表示P<0.01;与模型组比较,*表示 P<0.05,**表示 P<0.01
组别 只数 剂量/(mg·kg-1) W/D/%假手术组 10 - 5.1±0.3模型组 10 - 6.4±0.7△△黄芪甲苷低剂量 10 20 6.0±0.5黄芪甲苷中剂量 10 40 5.7±0.4*黄芪甲苷高剂量 10 80 5.4±0.3**
2.2 各组大鼠肺组织抗氧化酶活性 与假手术组比较,模型组大鼠肺组织中抗氧化酶(SOD、GSH-Px、CAT)活性显著降低,差异有统计学意义(P<0.05);与模型组比较,黄芪甲苷(40、80mg/kg)组SOD、GSH-Px、CAT活性均显著升高,差异有统计学意义(P<0.05)。见表2。
2.3 各组大鼠血清中MPO活性、MDA含量 与假手术组比较,模型组大鼠血清中MPO活性、MDA含量显著升高,差异有统计学意义(P<0.05);与模型组比较,黄芪甲苷(40、80 mg/kg)组MPO活性、MDA含量显著降低,差异有统计学意义(P<0.05)。见表3。
表2 各组大鼠肺组织SOD、GSH-Px、CAT活性比较(s)

表2 各组大鼠肺组织SOD、GSH-Px、CAT活性比较(s)
注:与假手术组比较,△△表示P<0.01;与模型组比较:*表示P<0.05,**表示P<0.01
组别 只数 剂量/(mg·kg-1) SOD/(U·mgprot-1) GSH-Px/(U·mgprot-1) CAT/(U·mgprot-1)假手术组 10 - 16.2±1.4 106.4±13.6 2.0±0.4模型组 10 - 10.7±1.2△△ 83.5±11.7△△ 0.9±0.2△△黄芪甲苷低剂量 10 20 12.0±1.6 87.3±10.9 1.1±0.3黄芪甲苷中剂量 10 40 13.5±1.4* 94.2±13.1 1.4±0.5*黄芪甲苷高剂量 10 80 15.0±1.7** 102.3±15.0** 1.7±0.4**
表3 各组大鼠血清中MPO活性、MDA含量比较(s)

表3 各组大鼠血清中MPO活性、MDA含量比较(s)
注:与假手术组比较,△△表示P<0.01;与模型组比较,*表示P<0.05,**表示P<0.01
组别 只数 剂量/(mg·kg-1) MPO(IU·L-1) MDA(nmol·L-1)假手术组 10 - 3.6±0.5 3.1±0.4模型组 10 - 9.4±1.7△△ 8.5±0.6△△黄芪甲苷低剂量 10 20 7.5±1.8 7.4±0.8黄芪甲苷中剂量 10 40 5.3±1.5* 5.6±0.6**黄芪甲苷高剂量 10 80 4.2±1.6** 4.3±0.5**
2.4 各组大鼠肺组织形态结构 假手术组大鼠肺组织结构和细胞形态均未见异常;模型组大鼠肺组织呈现肺泡结构紊乱,上皮细胞变性、坏死,肺泡内有大量的液体渗出,炎症细胞浸润等明显的病理性形态学改变;而与模型组比较,黄芪甲苷(40、80 mg/kg)组肺组织病理性形态学变化明显改善,以黄芪甲苷(80 mg/kg)组效果最为显著。见图1。

图1 各组大鼠肺组织形态结构(HE×400)
2.5 各组大鼠肺细胞凋亡状况及A I 经TUNEL染色后假手术组大鼠肺组织可见极少量凋亡细胞,而模型组大鼠肺组织细胞凋亡状况较假手术组明显加重;与模型组比较,黄芪甲苷各组细胞凋亡状况呈不同程度改善,其中以黄芪甲苷高剂量组效果最为显著。见图2。计算AI发现:与假手术组比较,模型组大鼠肺组织细胞AI明显增高,差异有统计学意义(P<0.05);与模型组比较,黄芪甲苷(40、80 mg/kg)组AI显著降低,差异有统计学意义(P<0.05)。见表4。
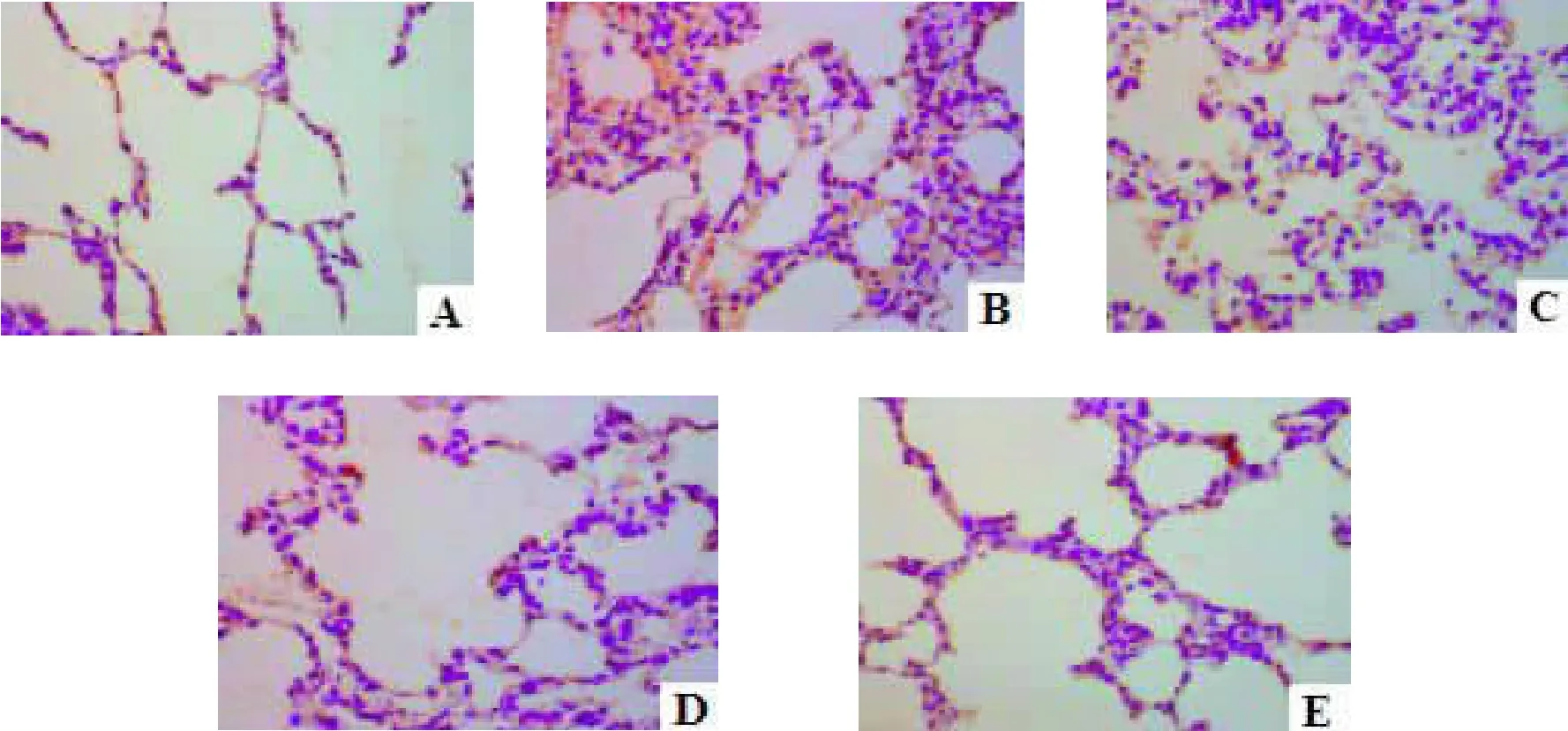
图2 各组大鼠肺组织细胞凋亡状况(TUNEL)
表4 各组大鼠肺细胞凋亡率(s)
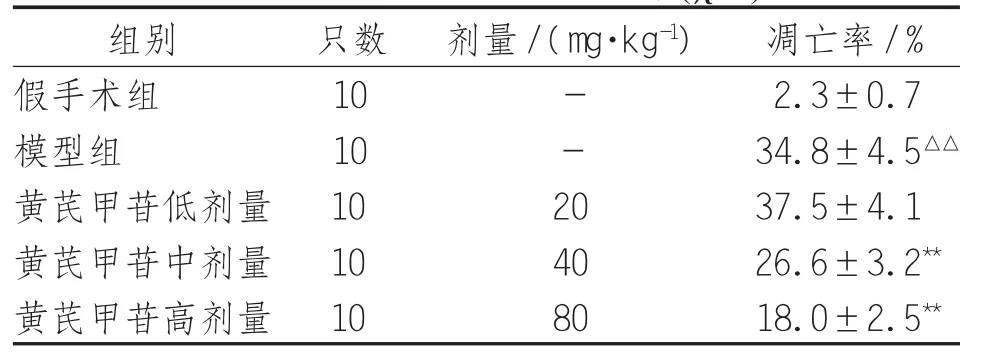
表4 各组大鼠肺细胞凋亡率(s)
注:与假手术组比较,△△表示P<0.01;与模型组比较,**表示P<0.01
组别 只数 剂量/(mg·kg-1) 凋亡率/%假手术组 10 - 2.3±0.7模型组 10 - 34.8±4.5△△黄芪甲苷低剂量 10 20 37.5±4.1黄芪甲苷中剂量 10 40 26.6±3.2**黄芪甲苷高剂量 10 80 18.0±2.5**
3 讨论
肺缺血再灌注损伤病理机制非常复杂,廖秀清等[1]和柴军等[2]研究发现,再灌注后出现的广泛的氧化应激损伤和肺细胞凋亡是肺缺血再灌注损伤发生发展的重要因素。刘国辉等[8]和程建等[9]通过药物干预肺缺血再灌注大鼠模型,抑制肺细胞凋亡从而对大鼠肺缺血再灌注损伤起到保护作用,为我们今后研发缓解肺缺血再灌注损伤的新型药物提供了新的思路。
黄芪甲苷为我国传统中药黄芪的主要有效成分之一,具有多种药理学活性。本实验对采用夹闭左肺门45 min后松夹的方法制备的肺缺血再灌注损伤大鼠模型进行研究发现,经黄芪甲苷中、高剂量组(40、80 mg/kg)预处理能够显著降低肺缺血再灌注损伤大鼠W/D、改善肺组织形态结构和细胞形态病变、抑制肺细胞凋亡,提示黄芪甲苷对肺缺血再灌注大鼠具有保护作用。
正常生理状态下,体内生成的氧自由基能够在超氧化物歧化酶(SOD)催化作用下还原生成H2O2[10],并进一步在GSH-Px或CAT的作用下还原生成对人体无害的 H2O 和 O2[11],因此 SOD、GSH-Px、CAT 的活性能够反映机体抗氧化能力;脂质过氧化终产物丙二醛(MDA)水平能够间接反映机体氧化应激损伤程度。髓过氧化物酶(MPO)是中性粒细胞特有的酶,其活性能够反映中性粒细胞激活和浸润,也能间接反映组织氧化应激损伤程度[12]。细胞凋亡是一种可由多种因素诱发的继发性行为,而氧化应激损伤正是诱发细胞凋亡的重要因素之一。本研究发现:经黄芪甲苷(40、80 mg/kg)预处理能够有效改善抗氧化酶(SOD、GSH-Px、CAT)活性、降低血清中 MPO 活性和MDA含量;提示黄芪甲苷具有降低肺缺血再灌注损伤大鼠氧化应激损伤的作用,从而间接抑制肺细胞凋亡。
总之,黄芪甲苷对大鼠肺缺血再灌注损伤具有保护作用,其作用机制可能与番茄红素能够有效改善机体抗氧化酶活性、抑制肺组织氧化应激损伤以及抑制肺细胞凋亡有关。
[1]廖秀清,熊平,肖晓山.黄芪甲甙对大鼠肺缺血再灌注损伤的保护作用[J].广东医学,2009,30(12):1778-1780.
[2]柴军,王大为,沈洁.七氟烷对大鼠缺血再灌注后肺组织氧自由基的影响[J].实用药物与临床,2009,12(3):156-158.
[3]Yang J,Li J,Lu J,et al.Synergistic protective effect of astragaloside IV-tetramethylpyrazine against cerebral ischemic-reperfusion injury induced by transient focal is chemia[J].J Ethnopharmacol,2012,140(1):64-72.
[4]曲丽君,曲晓峰.大豆异黄酮对大鼠血脂和抗氧化作用的研究[J].中国医药导报,2013,15(12):2090-2091.
[5]李铁成,马宝丰,李德生,等.黄芪甲苷对大鼠肝缺血/再灌注损伤的保护作用[J].天津中医药,2014,31(10):621-623.
[6]马小亮,王桂敏.黄芪甲苷灌胃预处理对大鼠心肌缺血再灌注损伤的保护作用[J].中国老年学杂志,2015,35(17):4795-4796.
[7]Xia ZY,Gao J,Ancharaz AK.Protective effect of ischemic post conditioning on lung ischemia-reperfusion injury in rats and the role of hemeoxygenase-1[J].Chin J Traum,2009,12(3):162-166.
[8]刘国辉,陈燕斐,谢清灵,等.银杏提取物对大鼠肺缺血再灌注损伤细胞凋亡、NO含量NOS活性的影响[J].中国现代医学杂志,2009,19(21):3205-3211.
[9]程建,程青,杨剑虹,等.丹参对大鼠肺缺血再灌注损伤保护作用的研究[J].海南医学院学报,2009,15(11):1349-1352.
[10]Patel SB,Santani D,Patel V,et al.Anti-diabetic effects of ethanol extract of bryonia laciniosa seeds and its saponins rich fraction in neonatally streptozotocin-induced diabetic rats[J].Pharmacognosy Res,2015,7(1):92-99.
[11]Bacanl M,Aydn S,Taner G,et al.The protective role of ferulic acid on sepsis-induced oxidative damage in Wistar albino rats.Environ Toxicol Pharmacol,2014,38(3):774-782.
[12]段若望,李明新,宋炯.不同血液pH值对大鼠肺移植时缺血再灌注损伤的影响[J].中华麻醉学杂志,2010,30(6):685-687.

