益元生血方对再生障碍性贫血患者外周血T淋巴细胞亚群的影响*
申小惠,张文君,杨新蔚,展 锐,温少瑾甘肃省中医院,甘肃 兰州 730050
再生障碍性贫血(aplastic anemia,AA)是一组以造血干祖细胞损伤、全血细胞减少为主要临床表现的骨髓造血功能衰竭性疾病,也是一种以造血组织为靶细胞的自身免疫性疾病。临床主要表现为全血细胞减少导致的贫血、出血和感染。目前多数学者认为AA是一种与CD4+T细胞亚群功能异常有关,由T细胞介导的自身免疫性疾病[1]。AA患者免疫异常会使机体Th1/Th2 T淋巴细胞群比例失调、CD4+/CD8+T细胞亚群比例严重紊乱,使机体产生各种负性调控因子(如IFN-γ和TNF-α等),抑制正常造血干细胞生长,最终引起骨髓衰竭[2]。其中Th17细胞作为促炎细胞,可诱导自身免疫性疾病的发生;而Treg细胞则具有抗炎和维持自身免疫耐受的作用,两者在细胞分化发育过程中存在着制约关系,Treg/Th17细胞失衡可导致许多自身免疫性疾病的发生[3-4]。目前已有研究表明AA外周血中Treg细胞明显减少,而Th17细胞显著升高[5-6],可以肯定Treg/Th17细胞的比例与AA的发病、预后密切相关。近年来,笔者就以健脾补肾、调气和血、化瘀解毒为立法依据的自拟益元生血方对AA患者外周血T细胞免疫的调节作用进行了观察,现报道如下:
1 资料与方法
1.1 临床资料 根据随机对照表选取2014年1月至2016年5月在甘肃省中医院肿瘤血液科二部就诊的10例AA患者为观察组,其中男6例,女4例;年龄40~70岁,平均(52.34±16.03)岁。另选健康对照者10例为对照组,其中男5例,女5例;年龄 40~70岁,平均(56.24±14.14)岁。2组性别、年龄等基础资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 纳入:1)符合AA西医诊断标准[7]者;2)中医辨证属脾肾亏损,邪毒内蕴证型[8]者;3)已停用化疗药物、造血生长因子或糖皮质激素2周以上者;4)未经抗生素或抗病毒药物治疗的活动性感染者;5)本人同意参与此项试验研究,依从性好,资料完整,可随访者;6)纳入者经医学伦理委员会审定同意。
1.3 排除标准 排除:1)不符合上述纳入标准者;2)对本方案治疗药物过敏者;3)妊娠期或哺乳期妇女;4)精神疾病患者;5)合并其他血液系统或非血液系统肿瘤,或有较严重的心、肝、肾等重要脏器器质性病变者;6)依从性差或因各种原因终止研究可能性大、不能完成研究流程者;7)病情危重,难以对本次实验的有效性作出确切评价者。
1.4 实验药物 益元生血方药物组成:黄芪20 g,菟丝子15 g,女贞子20 g,何首乌15 g,丹参10 g,三七10 g,鸡血藤10 g,白花蛇舌草10 g,半枝莲10 g,牡丹皮 15 g,白术 12 g,党参 15 g,当归 10 g,生地黄10 g。上述药物均由甘肃省中医院提供。1.5 实验试剂 人淋巴细胞分离液(深圳达科为公司);FITC anti-human CD4、PerCP/Cy5.5 anti-human CD8、PE anti-human IL-17A、APC anti-human IFN-γ、APC anti-human IL-4、PE anti-human CD25、PMA+Ionomycin淋巴细胞刺激物、Cell Staining Buffer(美国Biolegend公司);改良型RPMI-1640培养基(赛默飞世尔生物化学制品有限公司);益元生血方水提物(甘肃省中医院制剂中心提供)。
1.6 实验仪器 显微镜(日本OLYMPUS公司);低温冰箱(广州菱志电子公司);离心机(北京亚泰科隆仪器技术有限公司);A06061422超净工作台(苏净集团安泰公司);酶联仪(美国BIO-RAD公司);流式细胞仪(美国BD公司)。
1.7 实验方法
1.7.1 AA患者外周血T淋巴细胞与益元生血方水提物共培养后时效量效关系测定 无菌抽取诊断后治疗前AA患者和正常人对照组外周血5mL,用EDTA抗凝后,加入人外周血淋巴细胞分离液5 mL,1 500 r/min,离心后,沉淀为淋巴细胞,弃上清液,并加入1 mL培养液于沉淀中,吹匀,调整细胞密度为 7×104个 /mL,每孔 100 μL。将益元生血方水提物用完全RPMI-1640稀释至以下浓度10%、5%、2.5%、1.25%、0.625%,每孔 100 μL 加入到含各组淋巴细胞悬液的96孔板中,每个浓度梯度设10个复孔,同时设正常人淋巴细胞悬液+完全RPMI-1640培养液,设完全RPMI-1640培养液空白对照组、培养时间分别为24、36、48、72小时。培养结束前4小时各孔加MTS(浓度为5 mg/mL)20 μL,继续CO2培养箱孵育4小时后,酶标仪570 nm处检测吸光度值,并用完全RPMI-1640培养液空白对照孔调零,结果用OD值表示,依据MTS的实验结果以确定最佳药物浓度和最佳培养时间,进行后续实验。
1.7.2 干预方法 采集2组研究对象外周血5 mL,制备外周血淋巴细胞悬液,将制备好的淋巴细胞混悬液加入到24孔板中,细胞浓度为2×l07个/mL,每孔500 μL。观察组淋巴细胞悬液加入5%益元生血方水提取物、对照组淋巴细胞悬液予同剂量完全RPMI-1640培养液,每孔500 μL,每组设10个复孔,CO2培养箱培养36后,各组分别标记收集在2 mL离心管中,2 500 r/min,离心5分钟,弃上清液。1 mol/L PBS洗涤细胞沉淀,用1 mL PBS重悬细胞沉淀,调整细胞浓度为1×107个/mL。取各组细胞悬液300 μL分别加入到3个2 mL离心管中,第 1 管加 FITC- 抗人 CD4 0.5 μL,PerCP/cy5.5-抗人 CD8 5 μL;第 2 管加 APC- 抗人 IFN-γ 5 μL,APC-抗人IL-4 5 μL;第3管加PE-抗人IL-17A1.25μL,PE-抗人CD251.25μL,混匀。4℃避光孵育30分钟后,PBS洗细胞3次,洗毕,2 500 r/min离心5分钟,弃上清,加500 μL PBS于细胞沉淀中,轻轻吹匀,上流式细胞仪检测。
1.8 观 察 指 标 2 组 CD4+、CD8+、IFN-γ、IL-4、IL-17、CD4+CD25+T淋巴细胞亚群的分化;益元生血方干预前后 CD4+、CD8+、IFN-γ、IL-4、IL-17、CD4+CD25+T淋巴细胞亚群的分化。
1.9 统计学方法 数据采用SPSS 21.0统计软件进行统分析,所有数据均以(s)表示,组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 A A患者外周血T淋巴细胞与益元生血方水提物共培养后时量效关系测定 培养时间为36小时时,各组T淋巴细胞增殖活性均优于24、48和72小时,药物浓度为5%时各组T淋巴细胞增殖活性均优于 10%、2.5%、1.25%、0.625%,但都达不到正常组水平,差异具有统计学意义(P>0.05)。因此,后续实验研究将培养时间定为36小时,药物浓度定为5%,见表1。
2.2 外 周 血 CD4+、CD 8+、IFN-γ、IL-4、IL-17、CD 4+CD 25+T淋巴细胞 与正常对照组比较,观察组外周血 CD4+、CD4+/CD8+、IL-4、CD4+CD25+的表达明显下降(P<0.05),CD8+、IFN-γ、IL-17 的表达显著升高(P<0.05)。见表2。
2.3 益元生血方水提物干预后A A患者外周血CD4+、CD 8+、IFN-γ、IL-4、IL-17、CD4+CD25+T淋巴细胞变化 与干预前比较,干预后CD4+、CD4+/CD8+、IL-4、CD4+CD25+的 表 达 下 降 (P <0.05),CD8+、IFN-γ、IL-17 的表达显著升高(P<0.05)。见表3。
3 讨论
AA的发病与免疫紊乱关系密切,异常的免疫反应可损伤造血干细胞[9]。CD4+T细胞在维持机体的正常免疫应答中起着重要作用,其细胞的分化和细胞因子的异常调节在炎症及自身免疫性疾病中发挥重要作用。CD4+T细胞又分为Th1、Th2、Th17及调节性T细胞,其中Th1主要辅助细胞免疫,分泌IL-2及IFN-γ等。Th1细胞激活程度与机体造血功能呈负相关,同时IFN-γ可抑制正常骨髓细胞的分化、增殖、对造血干、祖细胞生长起抑制作用[10]。Th2则主要辅助体液免疫,分泌IL-4及IL-13等。Th1/Th2细胞的极化在机体免疫应答调节中发挥着重要作用,研究发现AA患者出现Th1细胞极化现象,呈现Th1细胞优势反应,而Th1/Th2细胞比例明显失衡[11]。Th17细胞与多种自身免疫性疾病关系密切,主要分泌IL-17等,IL-17可通过刺激内皮细胞发挥TGF-β等细胞因子,对骨髓造血发挥抑制作用,且IL-17可直接活化髓系祖细胞NF-κB,抑制祖细胞的增殖或促进其凋亡[12]。CD4+Treg细胞大约占CD4+T细胞的5%~10%,表达CD25分子和细胞毒性T淋巴细胞相关抗原(CTLA-4),活化的CD4+CD25+Treg主要通过接触抑制的方式抑制T细胞的活化和增殖,其通过抑制效应CD8+T细胞促进骨髓造血恢复[13]。而CD8+T细胞被异常激活后,可抑制自体及异体祖细胞集落形成,说明其与造血功能衰竭密切相关[14]。
表1 2组A A患者外周血T淋巴细胞与益元生血方水提物共培养后时效量效关系测定比较(s)

表1 2组A A患者外周血T淋巴细胞与益元生血方水提物共培养后时效量效关系测定比较(s)
注:*表示与对照组同培养时间比较,P<0.05;#表示相同浓度间比较,P<0.05;△表示相同时间点组间比较,P<0.05
组别 例数 药物浓度/% 不同培养时间增殖活性/h 24 36 48 72对照组 10 - 0.236±0.016 0.409±0.007 0.275±0.002 0.230±0.012观察组 10 10 0.052±0.005* 0.082±0.006* 0.084±0.003* 0.082±0.008*5 0.128±0.009* 0.188±0.008*#△ 0.125±0.014* 0.121±0.008*2.5 0.109±0.010* 0.109±0.012* 0.078±0.006* 0.078±0.009*1.25 0.075±0.008* 0.078±0.006* 0.052±0.006* 0.045±0.006*0.625 0.050±0.004* 0.062±0.012* 0.044±0.004* 0.041±0.003*
表2 2 组外周血 CD4+、CD8+、IFN-γ、IL-4、IL-17、CD4+CD25+T 淋巴细胞亚群百分率比较(s)
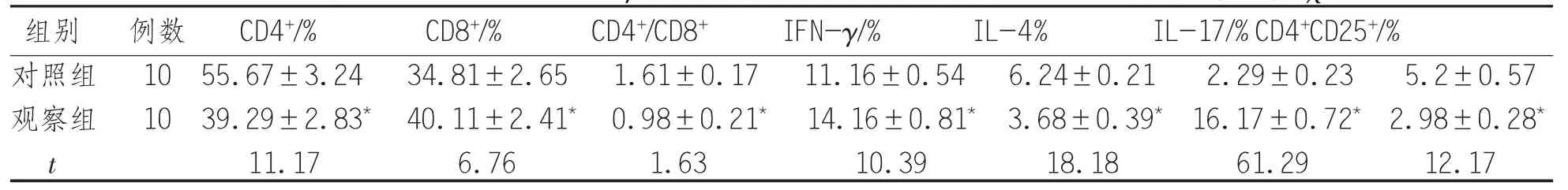
表2 2 组外周血 CD4+、CD8+、IFN-γ、IL-4、IL-17、CD4+CD25+T 淋巴细胞亚群百分率比较(s)
注:*表示与对照组比较,P<0.05
组别 例数 CD4+/% CD8+/% CD4+/CD8+ IFN-γ/% IL-4% IL-17/%CD4+CD25+/%对照组 10 55.67±3.24 34.81±2.65 1.61±0.17 11.16±0.54 6.24±0.21 2.29±0.23 5.2±0.57观察组 10 39.29±2.83* 40.11±2.41* 0.98±0.21* 14.16±0.81* 3.68±0.39* 16.17±0.72* 2.98±0.28*t 11.17 6.76 1.63 10.39 18.18 61.29 12.17
表3 益元生血方水提物干预前后AA患者外周血CD4+、CD8+、IFN-γ、IL-4、IL-17、CD4+CD25+T淋巴细胞变化(s)

表3 益元生血方水提物干预前后AA患者外周血CD4+、CD8+、IFN-γ、IL-4、IL-17、CD4+CD25+T淋巴细胞变化(s)
注:*表示与益元生血方干预后比较,P<0.05
干预前 10 51.24±2.83* 38.52±1.55* 1.33±0.08* 13.21±0.73* 4.68±0.48* 12.29±0.41* 2.98±0.28*干预后 10 39.29±2.83 40.11±2.41 0.98±0.21 14.16±0.81 3.68±0.39 16.17±0.72 2.24±0.31 t 9.30 4.68 1.53 9.16 7.31 11.41 7.74
本实验研究发现AA患者外周血中CD4+、IL-4、CD4+CD25+的表达明显下降,CD8+、IFN-γ、IL-17 的表达显著升高。这与文献报道一致[15]。AA是通过免疫机制介导的一种自身免疫性疾病,本研究再次证实AA的发病机制与免疫功能的紊乱有一定的相关性。AA属中医“虚劳”“血证”范畴,临床上均有脾肾亏损、瘀毒内停的表现。中医认为脾肾亏损、瘀毒内停是AA的主要病机,本研究采用健脾补肾、调气和血、化瘀解毒的方法,自拟“益元生血方”治疗此病。该方由黄芪、白术、党参、菟丝子、女贞子、当归、何首乌、生地黄、丹参、三七、鸡血藤、白花蛇舌草、半枝莲、炒牡丹皮等组成,诸药相合,甘温助阳,养血和营,化瘀解毒,使脏腑得以运化,血液得以化生;滋阴与温阳并举,补虚而不壅滞,祛邪而不伤正,标本兼顾,动静结合,寒温并济,共奏健脾补肾,活血解毒之功。益元生血方水提物与AA患者外周血共培养后,AA患者外周血CD4+、IL-4、CD4+CD25+的表达升高,CD8+T 细胞,IFN-γ、IL-17的表达下降。
综上所述,益元生血方可以增加AA患者外周血 CD4+、IL-4、CD4+CD25+的表达,下调 CD8+T 细胞、IFN-γ、IL-17的表达,益元生血方可能通过调节AA患者免疫功能以发挥治疗的作用。益元生血方是我们长期临床实践的经验总结,疗效显著,但限于样本数有限,未能进行系统全面的分子学,蛋白组学研究其机制,在后续实验研究中将进一步对其机制进行深入研究。
[1]Young NS,Bacigalupo A,Marsh JC.Aplastic anemia:pathophysiology and treatment [J].Biol Blood Marrow Transplant,2010,16(1):119-125.
[2]Maciejewski JP,Selleri C.Evolution of clonal cytogenetic abnormalitiesin aplasticanemia[J].Leuk Lymphoma,2004,45(3):433-440.
[3]Zhou L,Lopes JE,Chong MM,et al.TGF-beta-induced Foxp3 inhibits T(H)17cell differentiation by antagonizing RORgammat function[J].Nature,2008,453(7192):236-240.
[4]Afzali B,Lombardi G,Lechler RI,et al.The role of T helper 17(Th17)and regulatory T cells in human organ transplantation and autoimmune disease[J].Clin Exp Immunol,2007,148(1):32-46.
[5]Solomou EE,Rezvani K,Miel ke S,et al.Deficient CD4+CD25+FOXP3+T regulatory cells in acquired aplastic anemia[J].Blood,2007,110(5):1603-1606.
[6]Peffault de Latour R,Visconte V,Takaku T,et al.Th17 immune responses contribute to the pathophysiology of aplastic anemia[J].Blood,2010,116(20):4175-4184.
[7]张之南.血液病诊断及疗效标准[M].2版.北京:科学出版社,1998:279-281.
[8]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:183-188.
[9]Castellino F,Germain RN.Cooperation between CD4+and CD8+T cells:when,where,and how[J].Annu Rev Immunol,2006,24(5):19-40.
[10]傅晋翔,张学光,虞斐.再生障碍性贫血患者骨髓造血干/祖细胞对细胞因子反应性下降[J].中华血液学杂志,2001,22(4):205-207.
[11]张红霞,吴广胜,郭蔚玲.再生障碍性贫血患者血清Th1/Th2细胞及相关细胞因子和T细胞亚群变化及意义[J].海南医学院学报,2016,22(10):1024-1026.
[12]Starnes T,Broxmeyer HE,Robertson MJ,et al.Cutting edge:IL-17D,anovelmemberofthe IL-17 family,stimulates cytokine production and inhibits hemopoiesis[J].Journal of immunology,2002,169(2):642-646.
[13]杨友卫,郑智茵,姚红章.Th17/Treg细胞失衡与再生障碍性贫血研究进展[J].中国实验血液学杂志,2012,20(1):214-218.
[14]翟春燕,魏武,纪爱芳,等.马钱子碱对再生障碍性贫血患者T细胞分泌功能和增殖能力的影响[J].中国实验血液学杂志,2011,19(2):435-438.
[15]黄云鹏,张伟华,张秀莲,等.再生障碍性贫血患者外周血T细胞亚群及Th1/Th2细胞分析[J].山西医科大学学报,2005,36(4):443-445.

