化学法和生物法制备巨菌草腐植酸的比较
尚校兰,李宏宇,杨伊婷,梁菁菁(廊坊师范学院生命科学学院,河北 廊坊 065000)
腐植酸 (humic acid,HA) 是由动植物残体经过微生物的分解和合成以及地球化学的一系列过程形成的由芳香族及其多种官能团构成的天然有机高分子聚合物[1]。按照颜色和分子量不同,腐植酸可以分为黑腐酸、棕腐酸和黄腐酸[2],其中黄腐酸的某些生物活性高于其他组分的腐植酸,在工业、农业、环保、医药、食品等方面有广泛的应用[3-5]。
腐植酸的形成有6种学说,糖胺缩合学说、多酚学说、起源于木质素的多酚学说、木质素学说、细胞自溶学说、微生物合成学说[6]。原生腐植酸属于不可再生资源,因此寻找其他腐植酸的来源成了可持续发展战略的迫切需求,于是生化腐植酸应运而生。目前,生化腐植酸主要由秸秆、蔗渣、木屑等工农业废弃物通过化学方法或生物发酵方法提取。吕品等[7]利用硝酸、乙酸提取了稻草中的腐植酸,腐植酸含量分别增加了19.29%和17.23%, 黄腐酸含量分别增加了32.91%和 22.89%;Plácido和Capareda[8]利用浓度分别为2.5%、5.0%和10.0%的KMnO4、H2SO4、NaOH于50 ℃ 24 h和120 ℃ 15倍大气压1 h处理棉花(Gossypiumspp.)废弃物制备黄腐酸,发现低温常压长时下,各处理的黄腐酸含量从大到小依次为2.5% NaOH处理、10.0% NaOH处理、5.0% NaOH处理、10.0% H2SO4处理、5.0% H2SO4处理、2.5% H2SO4处理;高温高压短时下,黄腐酸含量从大到小依次为10.0% KMnO4处理、5.0% KMnO4处理、2.5% NaOH处理、5.0% NaOH处理、2.5% KMnO4处理、10.0% NaOH处理、2.5% H2SO4处理。曹均等[9]利用玉米(Zeamays)秸秆发酵制备腐植酸;姜爱莉[10]利用锯末、玉米面和棉籽油进行发酵,得到产物使用3.5% NaOH,于60 ℃下浸提1.5 h,黄腐酸的产率可达46.9%。
巨菌草(Pennisetumsp.),隶属被子植物门单子叶植物纲禾本科狼尾草属。属于多年生植物,直立丛生,植株高大,株高一般为3~5 m,最高可达8 m。利用巨菌草制备生化腐植酸的研究尚未见报道。本研究以巨菌草为原料,利用巨菌草纤维素、木质素含量高的特点,通过化学方法及生物发酵方法制备其本身并不含有的生化腐植酸,为巨菌草资源化、产业化开辟新途径。
1 材料与方法
1.1 材料
巨菌草由福建农林大学引种,于廊坊师范学院种植后采收烘干。枯草芽孢杆菌(Bacillussubtilis)、毛霉(Mucor)、根霉(Rhizopus)、青霉(Penicillium)由廊坊师范学院微生物实验室提供。分析用试剂均为国产分析纯。
1.2 仪器与设备
马弗炉(YHG-9039A,上海姚式仪器设备厂); 恒温培养箱(YMJ-250F,上海姚式仪器设备厂); 高压灭菌锅(YX-350Z,上海三申医疗器械有限公司); 离心机(TD-10K,上海卢湘仪离心机仪器有限公司)。
1.3 方法
1.3.1巨菌草处理
1)化学方法处理巨菌草 巨菌草粉碎烘干后,分别加入 90 mL不同浓度的乙酸(10.0%、20.0%、30.0%、40.0%、50.0%、60.0%、70.0%、80.0%、90.0%、100.0%)、草酸(2.5%、5.0%、7.5%、10.0%、12.5%)、盐酸(7.5%、15.0%、22.5%、30.0%、37.5%)、硝酸(12.5%、25.0%、37.5%、50.0%、62.5%)和氨水(5.0%、10.0%、15.0%、20.0%、25.0%),以蒸馏水为对照,加入反应液后在室温下搅拌均匀后,放入70 ℃水浴中反应30 min,取出试样在80 ℃下烘干,分别测定试样的纤维素、半纤维素、木质素、总腐植酸、黄腐酸的含量。
2)发酵方法处理巨菌草 称取15 g粉碎的巨菌草加入90 mL蒸馏水摇晃均匀,灭菌。将培养成熟的毛霉、根霉、青霉、枯草芽孢杆菌分别接种到巨菌草溶液中培养,其中毛霉、根霉、青霉巨菌草溶液放入26 ℃培养箱中摇床发酵,发酵周期30 d;枯草芽孢杆菌巨菌草溶液放入33 ℃培养箱中摇床发酵,发酵周期30 d。取出培养好的巨菌草灭菌,烘干。
1.3.2指标测定 纤维素、半纤维素、木质素含量测定采用中性洗涤纤维法测定[11];总腐植酸和黄腐酸的测定采用容量法[12]。
1.3.3数据处理 采用SPSS 16.0软件对所测数据统计分析,n=3,用平均值和标准误表示测定结果,分别对不同浓度化学试剂处理、不同发酵时间处理的巨菌草进行单因素方差分析;并用Tukey’s-b法对各测定数据进行多重比较。采用Excel 2010制图。
2 结果
2.1 化学法制备巨菌草腐植酸的含量
硝酸提取有利于总腐植酸和黄腐酸的溶出(图1)。与对照相比,12.5%、25.0%、37.5%、50.0%、62.5%的硝酸使巨菌草中总腐植酸和黄腐酸均显著升高(P<0.05),其中37.5%和62.5%硝酸能得到较高含量的黄腐酸,37.5%的总腐植酸含量最高,比对照提高了2.86倍。与对照相比,37.5%硝酸处理的巨菌草中纤维素含量无显著变化(P>0.05),半纤维素和木质素的含量显著下降(P<0.05)。
草酸提取有利于总腐植酸和黄腐酸的溶出(图2),2.5%、5.0%和10.0%浓度的草酸提取未使黄腐酸含量发生显著变化(P>0.05),而7.5%和12.5%提取均使黄腐酸含量显著升高(P<0.05)。2.5%和12.5%的草酸更有利于总腐植酸的溶出。所有浓度的草酸均使纤维素和半纤维素的含量升高,而木质素含量无显著变化(P>0.05)。
盐酸有利于总腐植酸和黄腐酸的溶出(图3),7.5%、15.0%、22.5%、30.0%、37.5%的盐酸会使黄腐酸和腐植酸含量显著升高(P<0.05),同时,盐酸处理会使纤维素、木质素、半纤维素的含量下降。
乙酸处理对黄腐酸的溶出影响不大(图4),但10.0%、20.0%、40.0%、50.0%、60.0%、70.0%乙酸处理有利于总腐植酸的溶出,且50.0%乙酸处理具有最优效果。
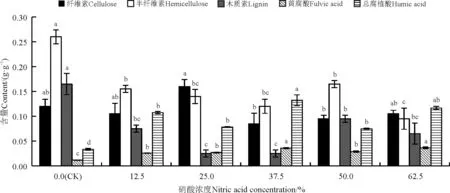
图1 不同浓度硝酸处理对巨菌草各成分的影响Fig. 1 Effect of different nitric acid concentrations on components of Pennisetum sp.
同一指标不同小写字母表示不同处理间差异显著(P<0.05),下同。
Different lowercase letters of the same index indicate significant differences among different treatment groups at the 0.05 level; similarly for the following figures.
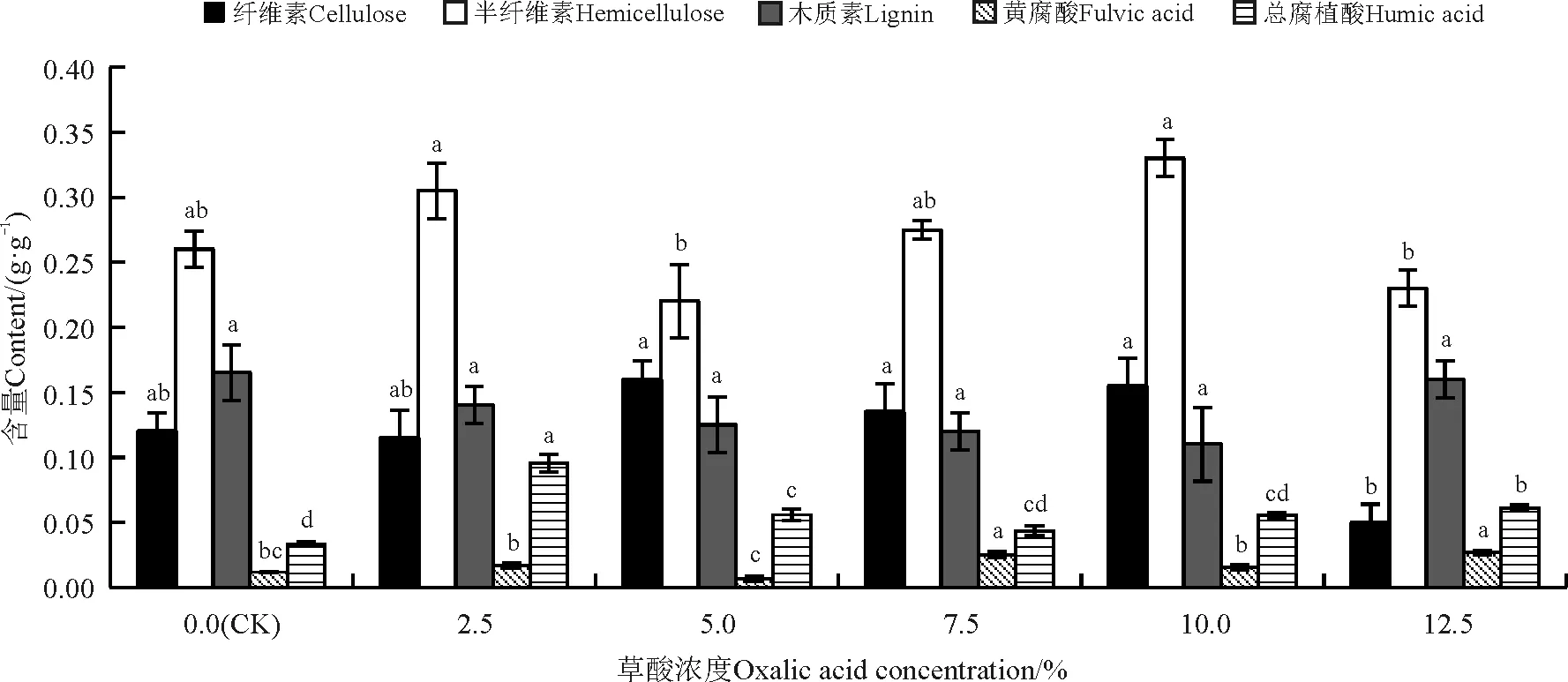
图2 不同浓度草酸处理对巨菌草各成分的影响Fig. 2 Effect of different oxalic acid concentrations on components of Pennisetum sp.

图3 不同浓度盐酸处理对巨菌草各成分的影响Fig. 3 Effect of different hydrochloric acid concentrations on components of Pennisetum sp.

图4 不同浓度乙酸处理对巨菌草各成分的影响Fig. 4 Effect of different acetic acid concentrations on components of Pennisetum sp.
5.0%、10.0%、15.0%、20.0%、25.0%的氨水处理均有利于总腐植酸含量的提高(图5),尤其是10.0%氨水处理的巨菌草的总腐植酸含量得到了显著提高(P<0.05),5.0%、10.0%、15.0%的氨水处理后巨菌草的黄腐酸含量得到显著提高(P<0.05)。10.0%、15.0%、20.0%氨水处理后,木质素含量下降。
综上所述,10.0%氨水提取巨菌草得到的腐植酸含量最高,其次为37.5%硝酸和37.5%盐酸,草酸和乙酸提取得到的腐植酸最少。
2.2 生物法制备巨菌草腐植酸的含量
经过枯草芽孢杆菌发酵的巨菌草纤维素含量、半纤维素含量、木质素含量下降,黄腐酸含量和总腐植酸含量升高。随着发酵时间的延长,纤维素含量有所下降(图6)。与对照相比,10和20 d发酵的巨菌草纤维素含量下降但不显著(P>0.05),30和60 d显著下降(P<0.05);半纤维素含量随发酵时间延长也有所下降,与对照相比,10、20、30 d发酵的巨菌草半纤维素含量下降不显著(P>0.05),而60 d表现为显著下降(P<0.05);木质素含量随发酵时间延长也有所下降,与对照相比,10、20、30 d发酵的巨菌草木质素含量下降不显著(P>0.05),而60 d表现为显著下降(P<0.05);总腐植酸含量随发酵时间延长有所升高,与对照相比,10 d发酵的巨菌草总腐植酸含量升高不显著(P>0.05),20、30、60 d显著升高(P<0.05);黄腐酸含量随发酵时间延长也有所升高,和对照相比,10、20d发酵的巨菌草黄腐酸含量升高不显著(P>0.05),而30和60 d显著升高(P<0.05)。
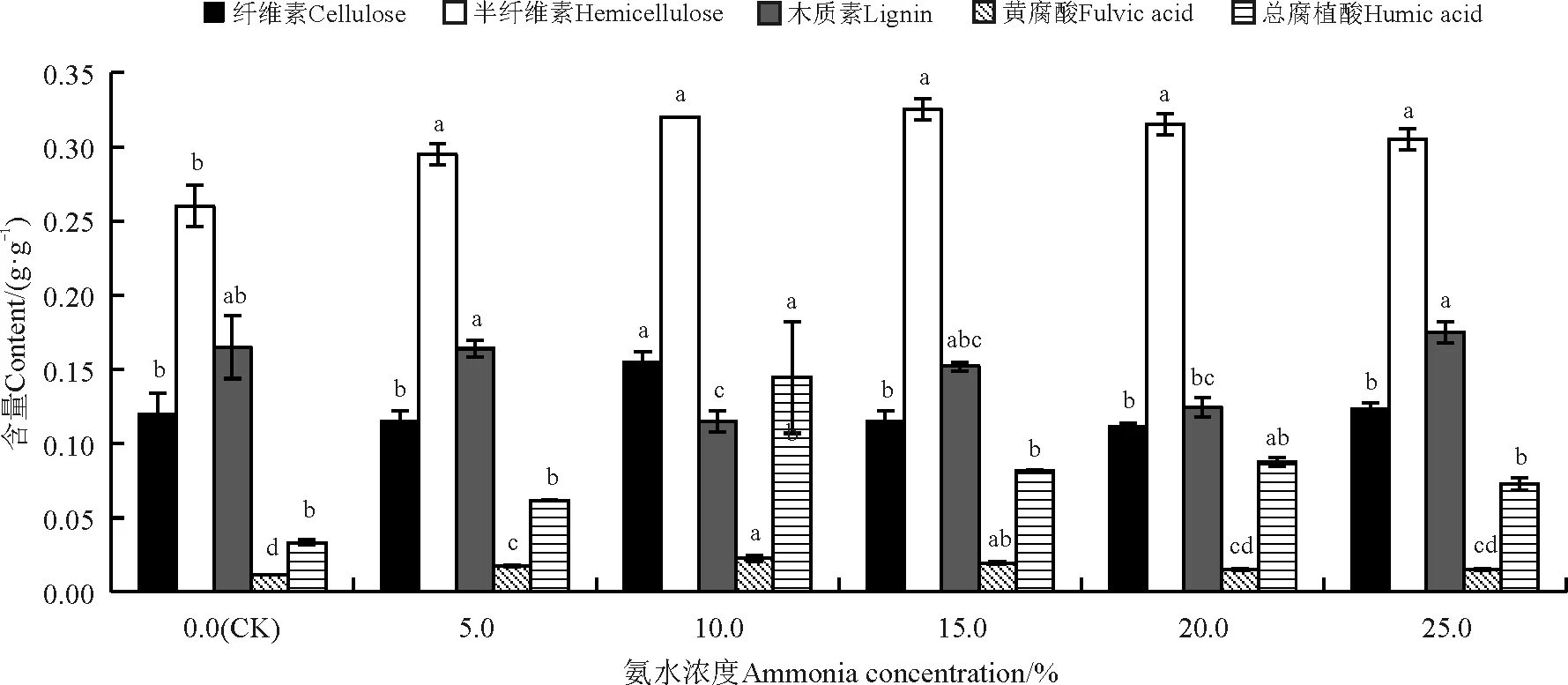
图5 不同浓度氨水处理对巨菌草各成分的影响Fig. 5 Effect of different ammonia concentrations on components of Pennisetum sp.
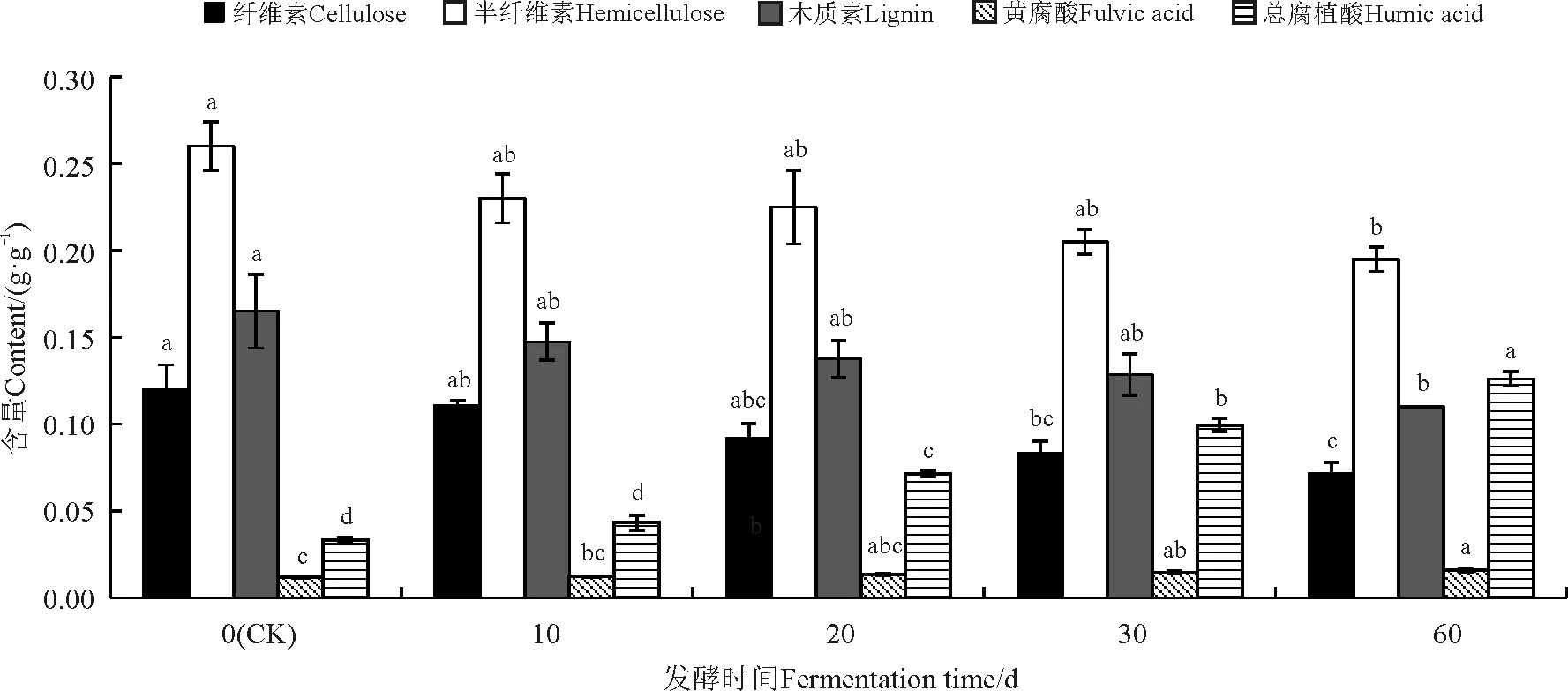
图6 枯草芽孢杆菌发酵对巨菌草各成分的影响Fig. 6 Effect of fermentation with Bacillus subtilis on components of Pennisetum sp.
随着毛霉发酵时间的延长,纤维素含量和半纤维素含量均不显著降低(P>0.05)(图7);木质素含量随发酵时间延长也有所下降,与对照相比,10、20 d发酵的巨菌草木质素含量下降不显著(P>0.05),而30和60 d显著下降 (P<0.05);总腐植酸含量随发酵时间延长有所升高,与对照相比,10、20、30、60 d均显著 升高(P<0.05);黄腐酸含量随发酵时间延长也有所升高,与对照相比,10 d发酵的巨菌草黄腐酸含量升高不显著(P>0.05),而20、30和60 d显著升高(P<0.05)。
经过根霉发酵的巨菌草纤维素含量、半纤维素含量、木质素含量下降,黄腐酸含量和总腐植酸含量升高。随着发酵时间的延长,纤维素含量有所下降,与对照相比,10、20和30 d发酵的巨菌草纤维素含量下降不显著(P>0.05),60 d下降显著(P<0.05)(图8);半纤维素含量随发酵时间延长也有所下降,与对照相比,10、20、30 d发酵的巨菌草半纤维素含量下降不显著(P>0.05),而60 d显著下降(P<0.05);木质素含量随发酵时间延长也有所下降,与对照相比,10 d发酵的巨菌草木质素含量下降不显著(P>0.05),而20、30和60 d显著下降(P<0.05);总腐植酸含量随发酵时间延长有所升高,与对照相比,10、20、30和60 d均显著升高(P<0.05);黄腐酸含量随发酵时间延长也有所升高,与对照相比,10 d发酵的巨菌草黄腐酸含量升高不显著(P>0.05),而20、30和60 d显著升高(P<0.05)。
经过青霉发酵的巨菌草纤维素含量、半纤维素含量、木质素含量下降,黄腐酸含量和总腐植酸含量升高。随着发酵时间的延长,纤维素含量、半纤维素含量和木质素含量均不显著降低 (P>0.05)(图9);总腐植酸含量随发酵时间延长有所升高,与对照相比,10 d发酵的巨菌草总腐植酸含量升高不显著(P>0.05),20、30、60 d显著升高 (P<0.05);黄腐酸含量随发酵时间延长也有所升高,与对照相比,10 d发酵的巨菌草黄腐酸含量升高不显著(P>0.05),而20、30和60 d显著升高 (P<0.05)。
3 讨论与结论
鲁宇菡[13]利用黑木耳菌糠发酵制备生化黄腐酸,发现0~1 mol·L-1的NaOH有利于生化黄腐酸的溶出,生化黄腐酸的含量最高可达6%。吕品等[7]利用硝酸、乙酸、草酸、盐酸、氨水提取稻草中的腐植酸,发现这5种试剂提取后腐植酸的含量均显著升高(P<0.05),其中硝酸>乙酸>盐酸>氨水>草酸,本研究得到的结果不一致。
硝酸处理巨菌草后,纤维素含量未发生显著变化(P>0.05),而半纤维素和木质素含量显著下降(P<0.05),总腐植酸和黄腐酸均显著升高(P<0.05),根据瓦克斯曼学说[14-15],木质素是构成腐殖质的基本原料,因此,可以认为硝酸处理有利于半纤维素和木质素向总腐植酸和黄腐酸转化。盐酸处理的巨菌草和硝酸处理类似,也可以用瓦克斯曼的木质素转化学说来解释。乙酸处理也有利于纤维素向总腐植酸转化。10.0%、15.0%、20.0%的氨水处理也有利于木质素向黄腐酸和总腐植酸转化。草酸处理虽然有利于总腐植酸和黄腐酸的溶出,但是纤维素和半纤维素的含量同时升高,而木质素含量无显著变化(P>0.05),因此不能用木质素的转化学说来解释,原因还需要进一步探讨。
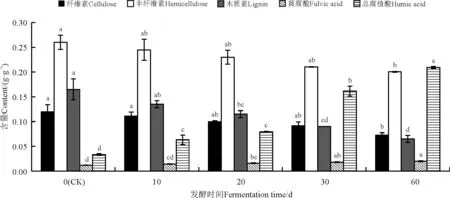
图8 根霉发酵对巨菌草各成分的影响Fig. 8 Effect of fermentation with Rhizopus on components of Pennisetum sp.
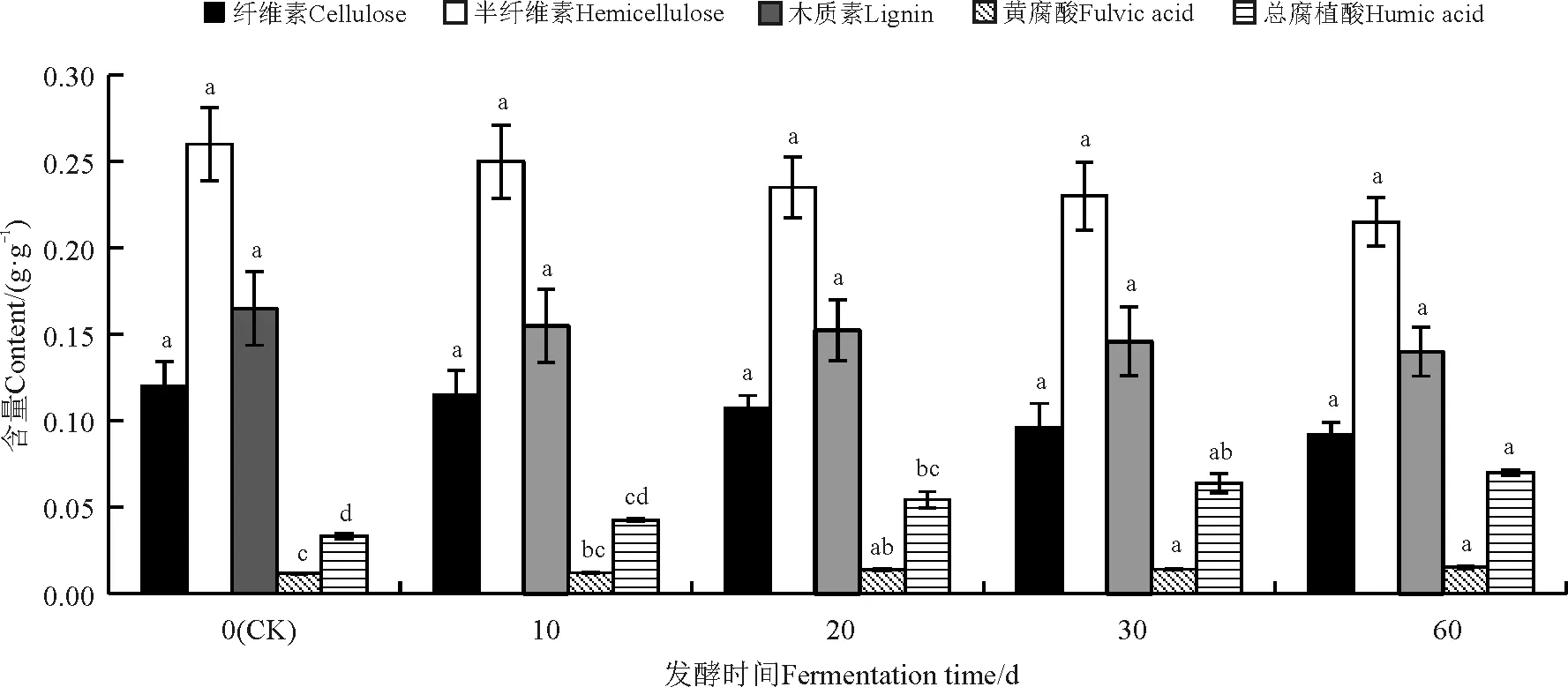
图9 青霉发酵对巨菌草各成分的影响Fig. 9 Effect of fermentation with Penicillium on components of Pennisetum sp.
多种微生物具有降解纤维素和半纤维素的能力,刘志坚等[16]利用枯草芽孢杆菌发酵蔗渣制备腐植酸,发现提高接种量和通气量,延长发酵时间,控制37 ℃发酵,有利于提高腐植酸含量。木霉和青霉等多种真菌也已被证明可降解纤维素[17-18]。杭怡琼等[19]等通过向培养基质(稻草秸秆+20%棉籽壳)接种侧耳真菌菌株发现,基质中木质素和纤维素含量在培养一段时间后明显减少。Badis[20]认为链霉菌菌株能在木质素降解和腐殖质更新方面具有一定的作用。侯勇[21]利用牛粪发酵秸秆,发现随着发酵时间的延长,纤维素、木质素及半纤维素含量下降,而腐殖质的含量有所升高。Kakezawa等[22]发现真菌可加快稻草秸秆的腐殖化。
不同微生物在降解木质素、 形成腐殖质中所扮演的角色不同, 真菌在腐殖质形成中起关键作用,而细菌、放线菌起辅助作用[23]。本研究表明,经过毛霉发酵的巨菌草纤维素含量、半纤维素含量、木质素含量下降,黄腐酸含量和总腐植酸含量升高。
本研究中,枯草芽孢杆菌、毛霉、根霉、青霉在巨菌草腐殖质的形成中均起到了积极作用,这和来航线等[24]的研究一致。发酵法制备巨菌草的总腐植酸和黄腐酸均是由纤维素、半纤维素和木质素的降解所致[25],真菌可能在细胞内形成醌或其他芳香族化合物,在分泌到体外以及细胞自溶时很容易缩合-聚合成腐殖质[26]。其中根霉对木质素的降解程度最高,与对照相比,到发酵结束,木质素降解了2.54倍,这和Dümig等[27]的研究结果一致,根霉发酵的巨菌草中总腐植酸和黄腐酸含量最高,和对照相比,总腐植酸含量提高了5.26倍,黄腐酸含量提高了0.71倍。青霉发酵的巨菌草中总腐植酸含量和黄腐酸含量最低,和空白相比,总腐植酸含量提高了1.09倍,黄腐酸含量提高了0.32倍。
与化学法相比,根霉发酵制备得到的总腐植酸含量是10.0%氨水提取得到的总腐植酸含量的1.45倍,毛霉发酵制备得到的总腐植酸含量是10.0%氨水提取得到的总腐植酸含量的1.29倍,而枯草芽孢杆菌和青霉发酵制备得到的总腐植酸含量比10.0%氨水提取得到的总腐植酸含量低。37.5%硝酸提取得到的黄腐酸含量是毛霉发酵制备得到的黄腐酸含量的1.79倍,22.5%盐酸提取得到的黄腐酸含量是毛霉发酵制备得到的黄腐酸含量的1.98倍。
化学法和生物发酵法均能提高巨菌草中腐植酸和黄腐酸含量,且都和巨菌草中纤维素、半纤维素或木质素的降解有关。总体来说,生物发酵法制备得到的总腐植酸含量比化学法提取得到的总腐植酸含量要高,而化学方法提取得到的黄腐酸含量比生物发酵法制备得到的黄腐酸含量要高。
References:
[1] 呼吉亚,红梅,德海山,王忠武,韩国栋.地形与放牧对土壤腐殖质组成成分的影响.草业科学,2014,31(9):1603-1608.
Hu J Y,Hong M,De H S,Wang Z W,Han G D.Influence of terrain and grazing intensities on soil humus composition.Pratacultural Science,2014,31(9):1603-1608.(in Chinese)
[2] Tehranifar A,Ameri A.Effect of humic acid on nutrient uptake and physiological characteristics ofFragariaananassavar.camarosa.Journal of Biological & Environmental Sciences,2012,6:77-79.
[3] 张丽珍,陈伟,史静,刘建荣,王德宏,陈本建. 腐殖酸钠对紫花苜蓿生长及生物量的影响.草业科学,2016,33(1):101-109.
Zhang L Z,Chen W,Shi J,Liu J R,Wang D H,Chen B J.Effects of sodium humate on growth and biomass of alfalfa.Pratacultural Science,2016,33(1):101-109.(in Chinese)
[4] 杨永花,廖伟彪,汉梅兰,王世新,张建旗.有机肥料对藤本月季生长及开花的影响.草业科学,2014,31(8):1450-1454.
Yang Y H,Liao W B,Han M L,Wang S X,Zhang J Q.Effects of organic fertilizers on growth and florescence of climbing rose.Pratacultural Science,2014,31(8):1450-1454.(in Chinese)
[5] Manas D,Soumya G,Kheyali S.Effect of humic acid application on accumulation of mineral nutrition and pungency in garlic (AlliumsativumL.).International Journal of Biotechnology & Molecular Biology Research,2014,5(2):7-12.
[6] 王菊花.微生物对土壤腐殖质形成及结构的影响研究.长春:吉林农业大学硕士学位论文,2007.
Wang J H.The study on the effect of microorganism in the formation and structure of soil humus.Master Thesis.Changchun:Jilin Agricultural University,2007.(in Chinese)
[7] 吕品,于志民,周琳.稻草提取类腐植酸物质及其对水稻苗生长的影响.国土与自然资源研究,2007(2):92-93.
Lyu P,Yu Z M,Zhou L.Extract HA and FA from straw and the effect on rice seedlings.Territory & Natural Resources Study,2007(2):92-93.(in Chinese)
[8] Plácido J,Capareda S.Production of silicon compounds and fulvic acids from cotton wastes biochar using chemical depolymerization.Industrial Crops & Products,2015,67:270-280.
[9] 曹均,林启美,李旭,赵小蓉,李贵桐,孙明德,曹庆昌.风化煤与玉米秸秆发酵过程中腐植酸及氮磷的变化.腐植酸,2009(3):18-23.
Cao J,Lin Q M,Li X,Zhao X R,Li G T,Sun M D,Cao Q C.Changes of humic acid,N and P during incubation of leonardite with maize straw.Humic Acid,2009(3):18-23.(in Chinese)
[10] 姜爱莉.发酵制备黄腐酸的研究.烟台大学学报,2000,13(3):205-209.
Jiang A L.Study on fermenting preparation of fulvic acid.Journal of Yantai University,2000,13(3):205-209.(in Chinese)
[11] 张崇玉,王保哲,张桂国,尹朋辉,路绪明.饲料中的粗纤维、NDF、ADF 和 ADL 含量的快速测定方法.山东畜牧兽医,2015,36(9):20-22.
Zhang C Y,Wang B Z,Zhang G G,Yin P H,Lu X M.Method for rapid determination of crude fiber,NDF,ADF and ADL content in feeds.Shandong Animal Husbandry and Veterinary Medicine,2015,36(9):20-22.(in Chinese)
[12] 北京市腐植酸分析方法会战小组.腐植酸总量的测定.北京师院学报,1975(S2):65-79.
Humic Acid Group of Beijing.Analysis method of determination of total humic acid.Journal of Beijing Teachers College,1975(S2):65-79.(in Chinese)
[13] 鲁宇菡.利用黑木耳菌糠制取生化黄腐酸及应用的研究.延吉:延边大学硕士学位论文,2010.
Lu Y H.The study on application and preparation of biochemical fulvic acid with fungus chaff of auricularia auricular.Master Thesis.Yanji:Yanbian University,2010.(in Chinese)
[14] 席北斗,刘鸿亮,白庆中,黄国和,曾光明,李英军.堆肥中纤维素和木质素的生物降解研究现状.环境工程学报,2002,3(3):19-23.
Xi B D,Liu H L,Bai Q Z,Huang G H,Zeng G M,Li Y J.Study on current status of lignin and cellulose biodegradation in composting process.Chinese Journal of Environmental Engineering,2002,3(3):19-23.(in Chinese)
[15] 刘保平.作物秸秆的微生物降解研究.哈尔滨:东北农业大学博士学位论文,2009.
Liu B P.Study on microbial degradation of crop stalks.PhD Thesis.Harbin:Northeast Agricultural University,2009.(in Chinese)
[16] 刘志坚,林娟,谢航,吕文静.枯草芽孢杆菌发酵生产腐植酸条件研究.福州大学学报,2009,37(2):294-297.
Liu Z J,Lin J,Xie H,Lyu W J.Study on the fermentation conditions of humic acid byBacillussubtilis.Journal of Fuzhou University,2009,37(2):294-297.(in Chinese)
[17] 边文骅.腐植酸形成的生物学机理研究概况.河北师范大学学报,2000,24(4):526-530.
Bian W H.The general situation of the biological mechanism of the formation of humic acid.Journal of Hebei Normal University,2000,24(4):526-530.(in Chinese)
[18] 陈芙蓉,曾光明,郁红艳,习兴梅.堆肥化中木质素的生物降解.微生物学杂志,2008,28(1):88-93.
Chen F R,Zeng G M,Yu H Y,Xi X M.Biodegradation of ligninin compost environment.Journal of Microbiology,2008,28(1):88-93.(in Chinese)
[19] 杭怡琼,薛惠琴,郁怀丹,陈谊.白腐真菌对稻草秸秆的降解及其有关酶活性的变化.菌物学报,2001,20(3):403-407.
Hang Y Q,Xue H Q,Yu H D,Chen Y.Rice straw degradation by white rot fungi and variance of activities of related enzymes.Mycosystema,2001,20(3):403-407.(in Chinese)
[20] Badis A.Characterization and biodegradation of soil humic acids and preliminary identification of decolorizing actinomycetes at Mitidja plain soils (Algeria).African Journal of Microbiology Research,2009,3(13):997-1007.
[21] 侯勇.秸秆发酵制取生化腐殖酸过程中的理化特性及微生物学特性研究.成都:四川农业大学博士学位论文,2013.
Hou Y.Physicochemical and microbial properties in the process of biochemical humic acids producing by straw fermentation.PhD Thesis.Chengdu:Sichuan Agricultural Uniersity,2013.(in Chinese)
[22] Kakezawa M,Mimura A,Takahara Y.Application of two-step composting process to rice straw compost.Soil Science and Plant Nutrition,1992,38(1):43-50.
[23] 窦森,王帅.不同微生物对形成不同腐殖质组分的差异性研究进展.吉林农业大学学报,2011,33(2):119-125.
Dou S,Wang S.Review of different microorganisms effect on humus formation.Journal of Jilin Agricultural University,2011,33(2):119-125.(in Chinese)
[24] 来航线,程丽娟,王中科.几种微生物对土壤腐殖质形成的作用.西北农业大学学报,1997,25(6):79-82.
Lai H X,Cheng L J,Wang Z K.Effect of several microorganisms on the formation of soil humus.Journal of Northwest Kasetsart University,1997,25(6):79-82.(in Chinese)
[25] 胡承彪,韦立秀,韦原连.不同林型人工林土壤微生物区系及生化活性研究.微生物学杂志,1990(z1):14-20.
Hu C B,Wei L X,Wei Y L.Studies on the soil microfolra and the soil biochemical activity of artifical forests on different types of forest.Journal of Microbiology,1990(z1):14-20.(in Chinese)
[26] Martin J P.Microorganisms and soil aggregation:Ⅱ.fnfluence of bacterial polysaccharides on soil structure.Soil Science,1946,61(2):157-166.
[27] Dümig A,Rumpel C,Dignac M F,Kögel-Knabner I.The role of lignin for the δ13C signature in C4grassland and C3forest soils.Soil Biology & Biochemistry,2013,57:1-13.(in Chinese)

