丛枝菌根真菌和磷对干旱胁迫下紫花苜蓿幼苗生长与生理特征的影响
林子然,张英俊(中国农业大学动物科学技术学院,北京 100094)
随着温室效应的日益加剧,气候持续变暖,全球性干旱现象愈加严峻。世界上超过1/3的土地,尤其是42.9%的耕地处于干旱或半干旱的状态[1]。水分是影响作物生产的首要因素[2],干旱严重限制植物的生长发育,致使作物大面积减产,对牧草生产和畜牧业发展带来极严重损失。紫花苜蓿(Medicagosativa)是一种优质的豆科牧草,有着生物量高、品质好、 家畜喜食等特点。但干旱会严重影响紫花苜蓿的质量和产量[3-4]。
丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)是一种自然界中存在广泛的共生微生物。AMF侵染植物根部后会形成致密的菌丝网,增大与土壤接触面积,可从土壤中吸收更多更深层的水分[5-6],进而提高宿主植物的抗旱能力。前人对紫花苜蓿[7]、小麦(Triticumaestivum)[8]等的研究表明,与未接种丛枝菌根真菌的植株相比,接种AMF对植物的株高、根系生长、营养物质的累积、光合效应等方面都有显著的提高。而对大豆(Glycinemax)等豆科植物,具有减缓干旱协迫下生物量减少的趋势,并显著的缓解干旱对大豆的氧化损伤[9]。丛枝菌根真菌同时可以促进植物对土壤中磷元素吸收和利用[10],而不同的磷浓度对菌根侵染率有一定的影响,从而对AMF抗旱性产生影响[11]。但是AMF对于牧草抗旱性的研究较少,而且接种丛植菌根真菌在不同磷浓度下改善水分胁迫作用的三因素试验,以及他们之间的互作效应尚未见相关文献报道。
本研究以紫花苜蓿品种WL 168 HQ为试验材料,探究水、磷、丛枝菌根真菌对于紫花苜蓿抗旱性能的影响,旨为紫花苜蓿抗旱性评价和充分利用丛枝菌根真菌促进苜蓿生产提供理论依据。
1 材料与方法
1.1 试验材料
紫花苜蓿种子WL168HQ购于北京正道生态科技有限公司,秋眠级2,适用于放牧及干草生产。接种摩西球囊霉菌(Glomusmosseae)由中国农业大学资源与环境学院提供。10 g沙土样品菌剂孢子数平均为216个。
1.2 试验设计
试验于中国农业大学资源与环境学院温室进行,温室的温度变化范围为28~38 ℃。试验采取三因素完全随机试验设计。试验水分处理:充足水分(W1,田间持水量75%~80%)、轻度干旱(W2,田间持水量55%~60%)、中度干旱(W3,田间持水量35%~40%)、重度干旱(W4,田间持水量15%~20%);磷施加量浓度:P1,无磷Hogland营养液;P2,0.25 mmol·L-1KH2PO4Hogland营养液;P3,0.5 mmol·L-1KH2PO4Hogland营养液;以及是否接种AMF。共24个处理,每个处理4个重复,共计96盆。
试验开始前,每盆(花盆上口径19 cm,下口径14.5 cm,高18 cm)装未施肥低磷土壤(pH 6.9),过2 mm筛后按河沙与土1∶1(质量比)混匀,培养土基本养分状况:全氮0.7 g·kg-1,速效磷5.4 mg·kg-1,全钾12.3 mg·kg-1。所有培养基质均在中国农业科学院原子能所用γ射线(25 kGy)灭菌处理,装土前将苗、盆用无水乙醇消毒,每盆装入3.5 kg培养土。一半盆栽中加入20 g摩西球囊霉菌,另一半加入等量γ射线灭菌菌剂。于5月18日播种,每盆点播40粒种子,于5月31号间苗,每盆留15株长势均一的苜蓿幼苗以备试验测定。植株正常生长25 d后进行干旱胁迫,采用称重法控制水分。在试验的第1、15、30天时分别将P1:无磷Hogland营养液、P2: 0.25 mmol·L-1KH2PO4Hogland营养液、P3:0.5 mmol·L-1KH2PO4Hogland营养液施加在不同植株中,每次施加150 mL。在胁迫25 d时对株高和土壤含水量进行测量,并分别剪取叶片,将其放于冰盒内带回实验室,并储藏于-80 ℃冰箱中,用于测定叶片含水量、丙二醛等生理指标,剩余5株幼苗整株取样,65 ℃烘干24 h,用于测定生物量。从每个盆栽中取出10条完整的根,先用自来水清洗干净,再用去离子水多次冲洗,最后用吸水纸将多余水分去除,选取新鲜根系进行测定菌根侵染率。
1.3 指标测定
紫花苜蓿的株高采用卷尺测量基部到植株最高部位的自然距离;叶片相对含水量采用烘干称量法测定;根茎比(root/shoot)为地下生物量和地上生物量的比值,菌根侵染率采用台盼蓝染色法测定[12],光合指标用Li-6400进行测定,超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)法测定[13],脯氨酸(Pro)采用茚三酮法测定[14],丙二醛(MDA)采用硫代巴比妥酸法测定[15]。
1.4 数据处理
试验数据采用SPSS 22.0软件进行分析,对植物的抗干旱胁迫能力的测定采用t检验,其余指标采用One-Way ANOVA进行方差分析。不同处理间的交互作用及影响采用一般线性模型进行分析,用Ducan法进行多重比较,试验结果为平均值±标准差(SD)。*,P<0.05;**,P<0.01;***,P<0.001。
2 结果与分析
2.1 不同处理对株高的影响
结果表明,随着水分胁迫的加剧,无论是否接种AMF,紫花苜蓿的株高均显著下降(P<0.05)。在W1、W2的水分条件下株高显著高于在W3、W4的水分条件下的株高(P<0.05)。在W1和W2处理组,接种AMF的紫花苜蓿株高均显著(P<0.05)高于未接种AMF(图1)。在未接种AMF的W1处理下,P3处理组的株高均显著高于P2;随着水分的降低,这种差异逐渐减小,各个磷处理间差异不显著;且在W1条件下,高浓度磷处理会显著提高株高。而在接种AMF的条件下,磷浓度对植株高度无显著影响。据此推测,植株高度对不同水分、AMF、磷条件响应不同。
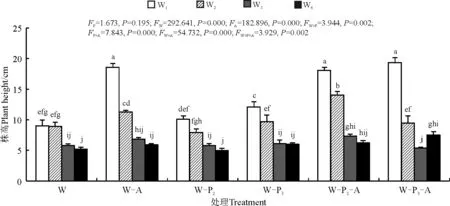
图1 不同水分、磷浓度下接种菌根真菌后紫花苜蓿株高Fig. 1 Plant height of alfalfa under different water and phosphorus concentrations and inoculation of mycorrhizal fungi
W:不同程度干旱胁迫处理;W-A:不同程度干旱胁迫+接种AMF处理;W-P2:不同程度干旱胁迫+P2浓度磷处理;W-P3:不同程度干旱胁迫+P3浓度磷处理;W-P2-A:不同程度干旱胁迫+P2浓度磷+接种AMF处理;W-P3-A:不同程度干旱胁迫+P3浓度磷+接种AMF处理。不同小写字母表示不同干旱协迫处理间差异显著(P<0.05)。下同。
W: different degrees of drought stress; W-A: different degrees of drought stress+AMF inoculation; W-P2: different degrees of drought stress+P2concentration of phosphorus treatment; W-P3: different degrees of drought stress+P3concentration of phosphorus treatment; W-P2-A: different degrees of drought stress+P2concentration of phosphorus+AMF treatment; W-P3-A: different degree of drought stress+P3concentration of phosphorus+AMF inoculation. Different lowercase letters mean significant difference among different water treatments at the 0.05 level; similarly for the following figures.
2.2 不同处理对植株菌根侵染率的影响
在各个水分梯度下,施加P2和P3处理组菌根侵染率显著高于无磷处理组(P<0.05)。而在W1、W2的水分梯度下,施磷后植株菌根侵染率显著高于W3、W4水分梯度(图2)。由此可知,施加磷处理会显著提高对植株的菌根侵染率。
2.3 不同处理对生物量的影响
不同干旱胁迫对生物量的影响不显著(P>0.05)。在相同干旱胁迫条件下,不同浓度磷处理在对紫花苜蓿地上生物量和地下生物量影响不显著(P>0.05)。在磷浓度相同时,紫花苜蓿的地上生物量随水分的降低而降低。接种AMF在W1和W2时地上地下生物量明显高于未接种AMF组,在W3和W4时地上生物量变化与未接种AMF相比差异不显著。而不同处理对地下生物量未产生显著影响。
2.4 不同处理对叶片相对含水量的影响
相对含水量是干旱条件下细胞脱水的一个重要指标。随着干旱胁迫程度的加剧,各处理组叶片的相对含水量均显著下降(P<0.05)。而各处理组中,无论是否接种AMF,磷浓度的变化对叶片相对含水量未产生显著影响。W3条件下接种AMF,可以显著的增加叶片的相对含水量(P<0.05),且提高在低水分处理下的叶片持水能力;当水分胁迫加剧时,磷的添加和AMF侵染可以有效地增加苜蓿叶片中相对含水量。施加P2并接种AMF相对于同水平上未接种AMF相对水分含量增加了73.08%。
2.5 紫花苜蓿相关生理指标
2.5.1不同处理对叶片MDA含量的影响 随着干旱胁迫程度的加剧,紫花苜蓿叶片中MDA含量呈增加趋势,且在W4时达到最大值(图5)。而不同磷浓度在轻度干旱状况下(W3)对紫花苜蓿MDA含量有一定抑制作用(P<0.05),而在其他处理组中影响不显著(P>0.05)。在相同水分条件下添加AMF后对比未添加AMF处理组,MDA变化不显著(P>0.05)。
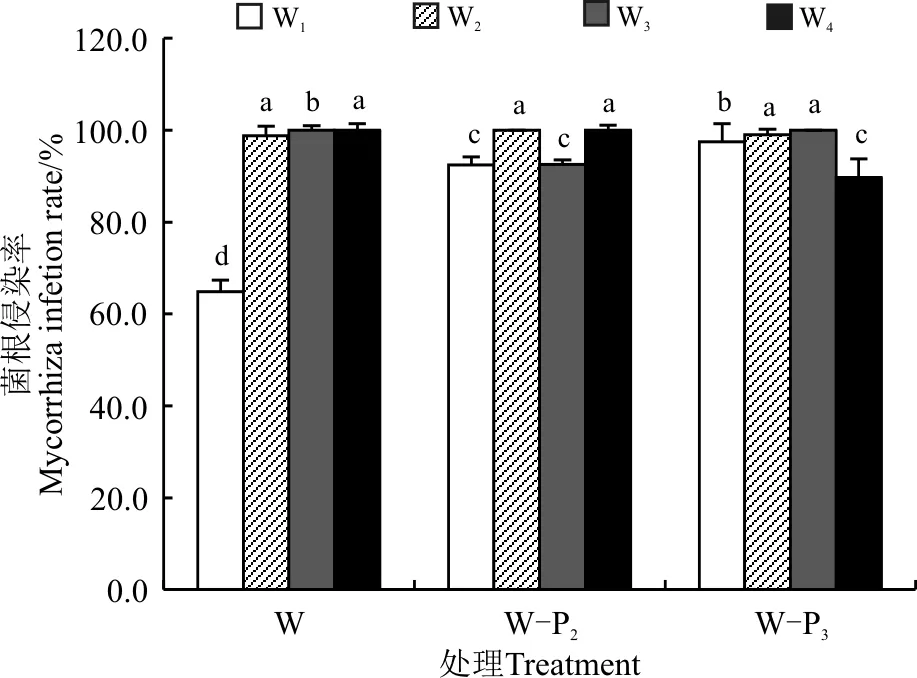
图2 不同水分、磷浓度下接种菌根真菌后紫花苜蓿菌根侵染率Fig. 2 Alfalfa mycorrhiza infection rate under different water & phosphorus concentrations and inoculation of mycorrhizal fungi
2.5.2不同处理对叶片SOD活性的影响 随着水分胁迫的增加,SOD活性显著下降(P<0.05)(图6)。但在W2、W3水分梯度条件下,添加AMF后SOD的活性都显著高于未添加AMF的处理(P<0.05)。而在P3条件处理下,植株内SOD活性相较于P2处理组显著下降(P<0.05)。
3 讨论与结论
3.1 干旱胁迫下不同磷浓度及AMF侵染对紫花苜蓿生长的影响
干旱胁迫会导致幼苗发育缓慢。本研究中,低于正常水分条件下生长的幼苗长度均被抑制,且抑制作用随着干旱胁迫的加剧而显著增强。接种AM真菌后可以显著地减缓紫花苜蓿因水分胁迫导致株高降低趋势,这与于洁等[16]的研究结论一致。而与未施加磷的对照组相比,接种AMF且施加0.25 mmol·L-1KH2PO4处理组株高和地上生物量显著增加,说明接种AMF可以有效缓解干旱对紫花苜蓿生长的抑制作用。在接种AMF且0.5 mmol·L-1KH2PO4营养液处理下,株高增加显著。这可能是由于磷参与了植株的光合作用,施加磷最利于叶绿体合成光合作用产物,进而促进了植株高度的增加;但与0.25 mmol·L-1KH2PO4组对比株高增加不显著,且地上生物量增长亦不显著。因此,无法证明这两个梯度磷水平可以改善植株的抗旱性能。而高浓度磷添加的营养液并未显著提高植株的菌根侵染率,甚至还有所下降,这可能是由于在高磷条件下,随着寄主植物磷营状况的改善,菌根真菌的菌丝生长受到抑制,因而降低了菌根侵染率[17]。研究发现,干旱胁迫下,在所有磷浓度处理条件下施用AMF均可以增加紫花苜蓿的地上生物量,提高植株的持水能力,使紫花苜蓿能在水分亏缺条件下维持生长。这与石伟琦等[18]施用AMF促进紫花苜蓿生物量的结论相一致,而与李重祥[19]在紫花苜蓿上的研究不完全一致,可能是因为选用不同菌种与不同寄主植物的亲和效应不同,从而产生了不同的试验结果。
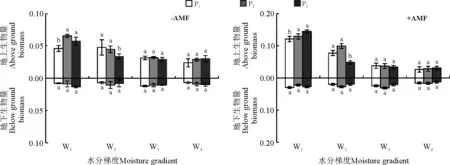
图3 不同水分、不同磷浓度条件下接种菌根真菌后紫花苜蓿生物量Fig. 3 Alfalfa biomass under different moisture & phosphorus concentrations after inoculation of mycorrhizal fungi
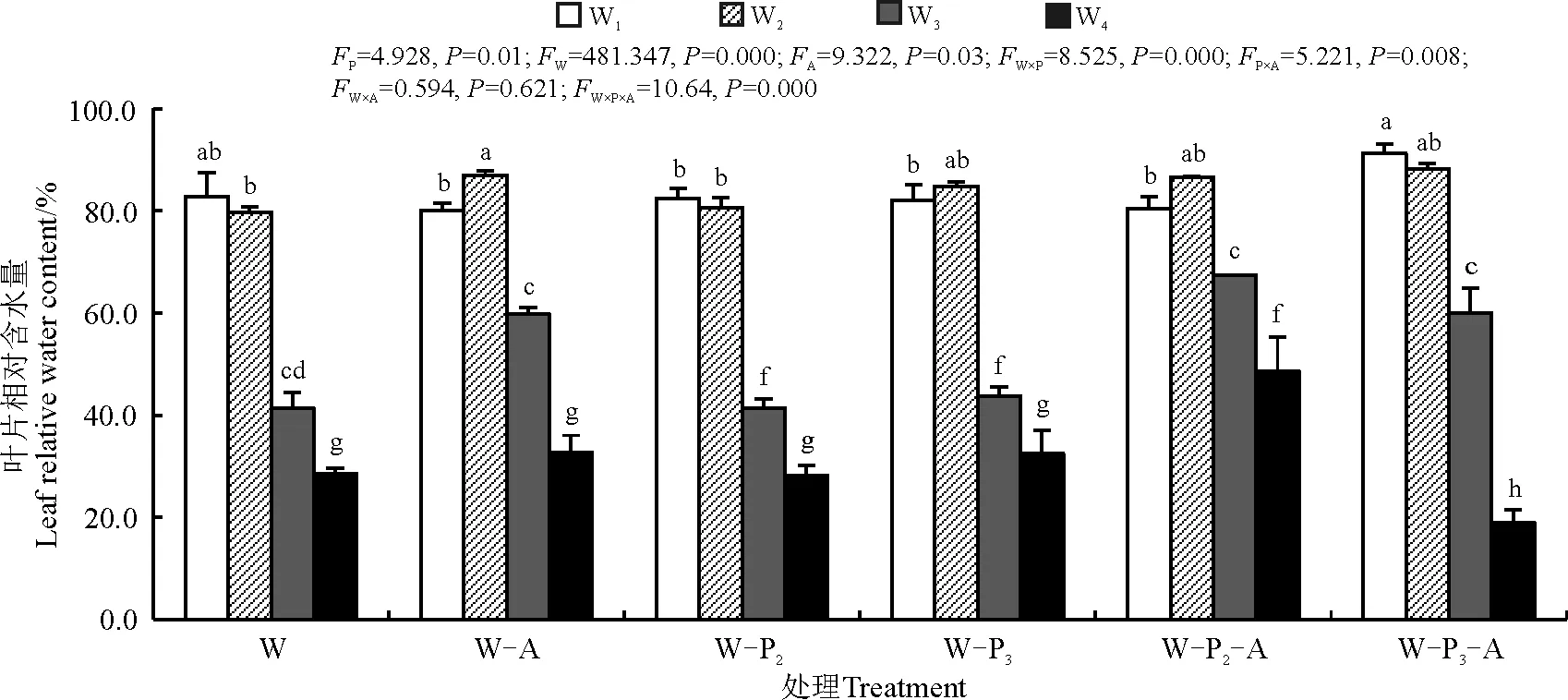
图4 不同水分、不同磷浓度下接种菌根真菌后紫花苜蓿叶片相对含水量Fig. 4 Relative water content of alfalfa leaves under different moisture & phosphorus concentrations after inoculation of mycorrhizal fungi
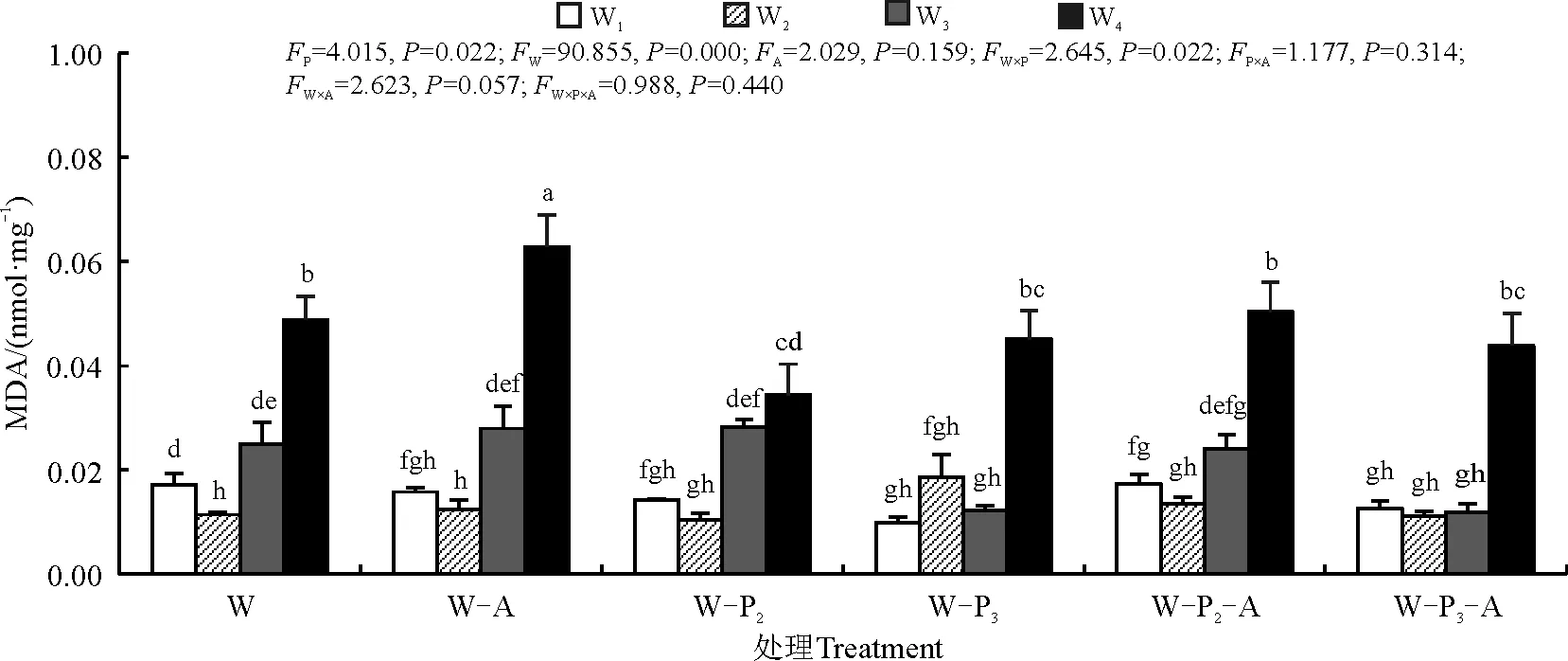
图5 不同水分、不同磷浓度条件下接种菌根真菌后紫花苜蓿体内MDA含量Fig. 5 MDA content in alfalfa under different water & phosphorus concentrations and inoculation of mycorrhizal fungi
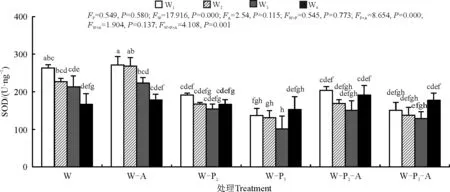
图6 不同水分、不同磷浓度下接种菌根真菌对紫花苜蓿体内SOD活性量的影响Fig. 6 SOD activity in alfalfa under different water & phosphorus concentrations and inoculation of mycorrhizal fungi
3.2 干旱胁迫下不同磷浓度及AMF侵染对紫花苜蓿相关生理指标的影响
叶片相对含水量是反映植物水分状况的重要生理指标。在干旱胁迫条件下,接种丛枝菌根真菌显著地提高了叶片中的相对含水量,因为AMF在根系周围形成的菌丝体网络可以帮助植物从更深的土层、更小的土壤缝隙中汲取更多的水分,菌丝体网络也增大了根系与土壤的接触面积[20]。本研究得出紫花苜蓿叶片中相对水分含量的改变,主要是通过水、磷和AMF三者间的互作进行调控;水分条件较好(W1、W2),接种AMF,且施0.5 mmol·L-1KH2PO4营养液时,植株叶片持水能力较强,结合前人研究表明,施入磷肥有利于水分的吸收利用[21]。而当水分胁迫增加时(W3、W4),菌根的形成受到水分不足和磷浓度过高的抑制,可能影响菌丝活性,在深度干旱条件下也影响了植株根系的生长。随着水分的不断减少,植物产生MDA等有害物质逐渐增多,MDA可作为植物膜损伤的主要指标,用以鉴别植物抗逆性的强弱。本研究中,丙二醛含量随着干旱胁迫增强升高,这与前人的研究结论相一致[15],说明干旱对植物具有较强的损伤作用,使细胞膜破损,细胞液外渗,影响紫花苜蓿正常的生长以及组织器官进行正常的生理反应;接种AMF的处理组产生的MDA含量则显著下降,这与前人的研究[22-24]结果一致,证明接种AMF菌种可以通过提高植株内抗氧化酶活性的方式来共同适应干旱胁迫,对维持植株正常生长及抗性生长具有重要生态学意义。在水分条件较好的处理组中,0.25 mmol·L-1KH2PO4水平下MDA含量高于无磷施入和0.5 mmol·L-1KH2PO4水平,而在中度和重度干旱胁迫条件下,施入磷浓度越高MDA含量则相对越低,说明在中度至重度干旱时施入磷肥可以降低有害物质的产生。SOD是一种能消除生物体在新陈代谢过程中产生的有害物质的酶类物质,当遭遇水分胁迫时,SOD的活性显著降低[25-26]。在本研究中,在一定水分条件下(W2)接种AMF显著提高了紫花苜蓿植株内SOD活性;且在相同水分条件下,无论处理组是否接种AMF,随着施磷量的增加SOD活性呈现下降趋势。这与赵平娟等[27]的研究结果不尽相同,AMF的接种并未在干旱状态下通过改善SOD酶活性的方式以延缓植株受伤害的速度,这可能是由于不同品种对于AMF的响应不同,对不同品种酶活性刺激产生差异。
3.3 干旱胁迫、不同磷浓度和AMF的互作机理
干旱胁迫随着环境状况的日益恶劣,已经作为对植物生长状态威胁最大的自然因素被人们广泛关注,目前已有众多研究人员对提高植株的抗性能力进行了研究。但目前研究较多的是单一改善条件处理对不同种类植株的抗性影响,对于多种条件联合处理植株的抗性改善作用还不太明了。从理论上讲,联合施用相对于单一施用具有更好的改善抗性作用,但也不排除可能存在拮抗作用的情况。
本研究分别以3种条件且分为不同的浓度分别进行处理,结果表明在特定的干旱胁迫条件下(W2),同时施加适量磷并接种AMF联合处理对植株株高的影响相较于相同干旱胁迫条件下的单独处理显著增强;而在干旱严重的条件下(W3、W4),同时施加适量磷并接种AMF联合处理对植株叶片含水量的影响相较于相同干旱胁迫条件下的单独处理显著增强,提高了植株的持水能力,有助于植株抗旱;而在一定的干旱的条件下(W3),同时施加适量磷并接种AMF联合处理相较于单一处理,减少了植株内的MDA含量,但在重度干旱条件下(W4)影响不显著;而高磷浓度与接种AMF甚至抑制了植株SOD活性,这可能与磷浓度过高,使得植株内部抗氧化酶活性受到影响,导致氧化胁迫的进一步加剧有关[28]。也可能是由于在菌根共生结构中,宿主植物紫花苜蓿在为AMF提供碳源的同时,也从菌根共生体中获得了N、P等营养元素,因而造成了对试验结果的影响[29]。而干旱同时也影响了AMF菌丝在根系上的定植,AMF与植株内生真菌和其他微生物之间可能产生的互作效应[30]以及试验过程不同区域光照强度可能出现的偏差,均可能使得不同植株之间的生长出现不同程度影响。此外,AMF、适宜磷浓度联合处理在适宜的水分条件下比任一单独处理及两两联合作用产生的效果更优,虽然联合处理比单独处理植株的抗性更好但其不存在交互作用,说明在适宜的水分及适宜的磷浓度下这3种条件联合处理仅存在累加作用;而AMF与较高浓度磷之间存在交互作用且联合作用和单独处理相比没有明显差别甚至有所抑制。说明AMF与高浓度的磷水平间可能存在拮抗作用。
综上所述,在紫花苜蓿植株中接种AMF及施加磷营养液可以从生长、生理生化指标等多方面显著的改善植株的抗旱能力,缓解因水分胁迫对植株造成的损伤。其中,在添加正常磷浓度Hogland(0.25 mmol·L-1KH2PO4)营养液的条件下,接种AMF对紫花苜蓿干旱胁迫的改善效果最为显著。
References:
[1] 董杰,贾学锋.全球气候变化对中国自然灾害的可能影响.聊城大学学报(自然科学版),2004,17(2):58-62.
Dong J,Jia X F.The possible impacts of global climate change on natural disasters in China.Journal of Liaocheng University(Natural Science Edition),2004,17(2):58-62.(in Chinese)
[2] 李梦元.黄花苜蓿抗旱性研究进展.绿色科技,2014(8):41-44.
Li M Y.The research progress on drought resistance ofMedicagosativaL. Green Science and Technology,2014(8):41-44.(in Chinese)
[3] 汪精海,齐广平,康燕霞,马彦麟,史晓巍,朱璇浩.干旱半干旱地区紫花苜蓿营养品质对水分胁迫的响应.草业科学,2017,34(1):112-118.
Wang J H,Qi G P,Kang Y X,Ma Y L,Shi X W,Zhu X H.Effects of water stress on nutritional quality of alfalfa in arid and semiarid areas.Pratacultural Science,2017,34(1):112-118.(in Chinese)
[4] 沈艳,谢应忠.干旱对紫花苜蓿叶绿素含量与水分饱和亏缺的影响.农业科学研究,2004,25(2):25-28.
Shen Y,Xie Y Z.Effect of chloropnyll content and wsd of alfalfa and corrblated relations under drought stress.Journal of Ningxia Agricultural College,2004,25(2):25-28.(in Chinese)
[5] Wu Q S,Xia R X,Zou Y N.Improved soil structure and citrus growth after inoculation with three arbuscular mycorrhizal fungi under drought stress.European Journal of Soil Biology,2008,44(1):122-128.
[6] 张俊伶,李晓林,杨志福.VA菌根的菌丝桥及其生态意义.世界农业,1996(11):37-40.
Zhang J L,Li X L,Yang Z F.VA mycorrhizal hyphae and their ecological significance.World Agriculture,1996(11):37-40.(in Chinese)
[7] 任爱天,娜丽克斯·外里,鲁为华,杨洁晶,马春晖,刘红玲.AM真菌对紫花苜蓿细根生长及其生物量动态特征的影响.西北植物学报,2014,34(12):2535-2543.
Ren A T,Nakers Waili,Lu W H,Yang J J,Ma C H,Liu H L.Effect of the arbuscular mycorrhizal fungi on the dynamic characteristics of fine root growth and biomass of alfalfa.Acta Botanica Boreali-Occidentalia Sinica,2014,34(12):2535-2543.(in Chinese)
[8] 王立,王敏,马放,李哲,吴洁婷,安广楠.丛枝菌真菌对小麦的促生长效应与根腐病抑制效应.哈尔滨工业大学学报,2015,47(4):15-19.
Wang L,Wang M,Ma F,Li Z,Wu J T,An G N.The effect of AMF on the promotion and resistance againstFusariumsolaniof wheat seeding.Journal of Harbin Institute of Technology,2015,47(4):15-19.(in Chinese)
[9] Grümberg B C,Urcelay C,Shroeder M A,Luna C.The role of inoculum identity in drought stress mitigation by arbuscular mycorrhizal fungi in soybean.Biology and Fertility of Soils,2015,51(1):1-10.
[10] 郭艳娥,李芳,李应德,段廷玉.AM真菌促进植物吸收利用磷元素的机制.草业科学,2016,33(12),2379-2390.
Guo Y E,Li F,Li Y D,Duan T Y.Progress in the elucidation of the mechanisms of arbuscular mycorrhizal fungi in promotion of phosphorus uptake and utilization by plants.Pratacultural Science,2016,33(12),2379-2390.(in Chinese)
[11] 景新新,王发园.丛枝菌根真菌对改善植物磷素营养机制的研究进展.湖北农业科学,2016,55(8):1908-1912.
Jing X X,Wang F Y.Research progress of arbuscular mycorrhizal fungi on improving plant phosphorus nutrition mechanism.Hubei Agricultural Sciences,2016,55(8):1908-1912.(in Chinese)
[12] 盛萍萍,刘润进,李敏.丛枝菌根观察与侵染率测定方法的比较.菌物学报,2011,30(4):519-525.
Sheng P P,Liu R J,Li M.The arbuscular mycorrhizal infection rate of observation and comparison of determination method.Mycosystema,2011,30(4):519-525.(in Chinese)
[13] Beyer W F Jr,Fridovich I.Assaying for superoxide dismutase activity:Some large consequences of minor changes in conditions.Analytical Biochemistry,1987,161(2):559-566.
[14] Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies.Plant and Soil,1973,39(1):205-207.
[15] Wang W B,Kim Y H,Lee H S,Kim K Y,Deng X P,Kwak S S.Analysis of antioxidant enzyme activity during germination of alfalfa under salt and drought stresses.Plant Physiology & Biochemistry,2009,47(7):570-577.
[16] 于洁,贾振宇,梁燕,德英,武自念,穆怀彬.丛枝菌根真菌接种对紫花苜蓿抗旱性的影响.中国草地学报,2016,38(5):13-18.
Yu J,Jia Z Y,Liang Y,De Y,Wu Z N,Mu H B.Effects of arbuscular mycorrhizal fungi inoculation on drought resistance of alfalfa.Chinese Journal of Grassland Sciences,2016,38(5):13-18.(in Chinese)
[17] 刘灵.大豆根形态构型对磷效率的影响及其与菌根的相互作用.广州:华南农业大学博士学位论文,2006.
Liu L.Effects of soybean root morphology and configuration on phosphorus efficiency and their interaction with mycorrhizal fungi.PhD Thesis.Guangzhou:South China Agricultural University,2006.(in Chinese)
[18] 石伟琦,丁效东,张士荣.丛枝菌根真菌对羊草生物量和氮磷吸收及土壤碳的影响.西北植物学报,2011,31(2):357-362.
Shi W Q,Ding X D,Zhang S R.Effects of arbuscular mycorrhizal fungi on biomass,nitrogen and phosphorus uptake and soil carbon inLeymuschinensis.Acta Botanica Boreali-Occidentalia Sinica,2011,31(2):357-362.(in Chinese)
[19] 李重祥.紫花苜蓿高效丛枝菌根菌的筛选及利用研究.呼和浩特:内蒙古农业大学硕士学位论文,2010.
Li Z X.Screening and utilization of high efficient arbuscular mycorrhizal fungi in alfalfa.Master Thesis.Huhhot:Inner Mongolia Agricultural University,2010.(in Chinese)
[20] Benabdellah K,Abbas Y,Abourouh M,Aroca R,Azcón R.Influence of two bacterial isolates from degraded and non-degraded soils and arbuscular mycorrhizae fungi isolated from semi-arid zone on the growth ofTrifoliumrepens,under drought conditions:Mechanisms related to bacterial effectiveness.European Journal of Soil Biology,2011,47(5):303-309.
[21] 张士功,刘国栋,窦玉清,刘更另.低磷和干旱胁迫对小麦生长发育影响的研究初探.西北植物学报,2002,22(3):574-578.
Zhang S G,Liu G D,Dou Y Q,Liu G L.Preliminary study on the effects of low phosphorus and drought stress on the growth and development of wheat.Journal of Northwest China Botany,2002,22(3):574-578.(in Chinese)
[22] 王同智,包玉英.AM真菌对濒危物种四合木及近缘种霸王抗旱性的影响.华北农学报,2014,29(3):170-175.
Wang T Z,Bao Y Y.Effect of AM fungi on the drought resistance of four species of endangered species and endangered species of the genus.Chinese Journal of Agricultural Sciences,2014,29(3):170-175.(in Chinese)
[23] 宋会兴,彭远英,钟章成.干旱生境中接种丛枝菌根真菌对三叶鬼针草(BidenspilosaL.)光合特征的影响.生态学报,2008,28(8):3744-3751.
Song H X,Peng Y Y,Zhong Z C.Effect of photosynthetic characteristics in the arid habitats of arbuscular mycorrhizal fungi of Bidens pilosa (BidenspilosaL.).Journal of Ecology,2008(8):3744-3751.(in Chinese)
[24] 刘爱荣,陈双臣,刘燕英,李艳楠,贺超兴.丛枝菌根真菌对低温下黄瓜幼苗光合生理和抗氧化酶活性的影响.生态学报,2011,31(12):3497-3503.
Liu A R,Chen S C,Liu Y Y,Li Y N,He C X.Effects of arbuscular mycorrhizal fungi on photosynthetic physiology and antioxidant enzyme activities of cucumber seedlings under low temperature.Chinese Journal of Ecology,2011,31(12):3497-3503.(in Chinese)
[25] 田帅,刘振坤,唐明.不同水分条件下丛枝菌根真菌对刺槐生长和光合特性的影响.西北林学院学报,2013,28(4):111-115.
Tian S,Liu Z K,Tang M.Effects of arbuscular mycorrhizal fungi on growth and photosynthetic characteristics ofRobiniapseudoacaciaunder different water conditions.Journal of Northwest Forestry College,2013,28(4):111-115.(in Chinese)
[26] 张攀,杨培志,王卫栋,张志强,韩博,王亚芳,曹玉曼,呼天明.干旱胁迫下根瘤菌共生紫花苜蓿抗旱生理变化研究.草地学报,2013,21(5):938-944.
Zhang P,Yang P Z,Wang W D,Zhang Z Q,Han B,Wang Y F,Cao Y M,Hu T M.Study on the physiological changes of drought resistance ofRhizobiumsymbiotic alfalfa(MedicagosativaL.)under drought stress.Chinese Journal of Grassland,2013,21(5):938-944.(in Chinese)
[27] 赵平娟,安锋,唐明.丛枝菌根真菌对连翘幼苗抗旱性的影响.西北植物学报,2007,27(2):396-399.
Zhao P J,Aa F,Tang M.Effect of arbuscular mycorrhizal fungi on drought resistance ofForsythiasuspenseseedlings.Acta Botanica Boreali-Occidentalia Sinica,2007,27(2):396-399.(in Chinese)
[28] 范媛媛,袁妙淼,邓梅峰,杨万年.高浓度氮、磷胁迫对伊乐藻SOD、POD和CAT活性的影响.氨基酸和生物资源,2007,29(3):38-41.
Fan Y Y,Yuan M M,Deng M F,Yang W N.Effects of high nitrogen and phosphorus stress on activities of SOD,POD and CAT ofElodeanuttite.Amino Acids and Biological Resources,2007,29(3):38-41.(in Chinese)
[29] 任爱天,鲁为华,杨洁晶,刘红玲,马春晖.不同磷水平下AM真菌对紫花苜蓿生长和磷利用的影响.中国草地学报,2014,36(6):72-78.
Ren A T,Lu W H,Yang J J,Liu H L,Ma C H.Effects of AM fungi on the growth and phosphorus utilization of alfalfa under different phosphorus levels.Chinese Journal of Grassland,2014,36(6):72-78.(in Chinese)
[30] 李芳,张峰,高萍,段廷玉.农业生态系统中AM真菌、禾草内生真菌及病原菌互作.草业科学,2016,33(2):219-229.
Li F,Zhang F,Gao P,Duan T Y.Progress of research on the interactions of arbuscular mycorrhizal fungi,grass endophyte and plant pathogens in agro-ecosystem.Pratacultural Science,2016,33(2):219-229.(in Chinese)

