UAS-Hey转基因果蝇品系的构建与鉴定
刘松年,荆凌华,伍 星,赵 鑫
(河南科技大学临床医学院/河南科技大学第一附属医院急诊科,河南洛阳 471003)
Hey基因(Hairy/E(spl)-related with YRPW motif)属于碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子超家族成员,具有bHLH结构域、Orange结构域及羧基末端的YRPW保守四肽。哺乳动物的Hey基因包括Hey1、Hey2、HeyL 3个成员,在发育过程中主要表达于神经系统、心脏、血管、体节等组织,作为Notch信号通路的直接靶基因参与神经发生、心血管系统形成及骨骼发育等[1-3]。有研究表明,Hey1基因高表达与胶质瘤的病理发生和侵袭密切相关[4];Hey2基因敲除小鼠出现明显的心血管缺损表型,包括法洛四联症、膜性室间隔缺损、心室肥大等畸形,出生数天后大部分纯合缺失小鼠即死于心力衰竭[5]。系统研究Hey基因的功能和调控网络,阐明其突变或异常表达的致病机制,可以更好地揭示Hey基因所参与的生物学过程,为其在临床治疗中的应用提供理论依据。然而作为哺乳动物Hey基因相对应的同源基因,果蝇Hey基因的功能尚未系统研究[6-7]。序列比对分析发现果蝇Hey与哺乳动物Hey的bHLH结构域具有97%的序列相似性,因此,研究果蝇Hey基因的功能和调控将为哺乳动物Hey基因的相关研究提供借鉴。GAL4/UAS表达系统利用组织特异性启动子或增强子活化酵母转录激活因子GAL4的表达,随后GAL4蛋白特异性结合融合有靶基因的UAS,从而调控靶基因在特定组织特定时期过量表达,因而是研究基因功能的有力工具[8]。本研究运用分子克隆和显微注射技术构建UAS-Hey转基因果蝇,为运用GAL4/UAS系统过量表达Hey基因,进一步研究Hey基因在发育中的功能和调控机制奠定基础。
1 材料与方法
1.1材料 W1118野生型果蝇、elav-GAL4果蝇品系、B1/CyO;TM2/TM6B双平衡果蝇品系和pUAST载体为本实验室保存,兔抗Hey多克隆抗体由本实验室制备。cDNA合成试剂盒、高保真PCR扩增试剂盒、限制酶EcoR Ⅰ和Xho Ⅰ、碱性磷酸酶、T4连接酶、DNA相对分子质量Marker、凝胶回收试剂盒、DH5α感受态细胞、质粒纯化试剂盒等购自TaKaRa公司;组织裂解液、BCA蛋白定量试剂盒、蛋白相对分子质量Marker、硝酸纤维素膜(NCM)、HRP标记的羊抗兔IgG、DAB显色试剂盒等购自Sangon公司;兔抗β-Tubulin单克隆抗体(ab179513)购自Abcam公司;TRIzol试剂等购自Invitrogen公司;PCR纯化试剂盒、质粒Midi提取试剂盒等购自QIAGEN公司;卤烃油700购自Sigma公司。其他化学试剂为国产分析纯。
1.2方法
1.2.1果蝇胚胎总RNA提取与质检 收集胚胎时,将野生型W1118果蝇转至卵收集笼,供给涂有酵母的葡萄汁培养板。收集20 h后用尼龙膜网收集卵,50%次氯酸钠溶液处理2 min去除几丁质外壳,然后用蒸馏水充分冲洗。取100枚胚胎置于1.50 mL离心管中,加入1.00 mL TRIzol试剂后冰上迅速匀浆,然后按照厂家的说明书提取,总RNA样品于-80 ℃保存备用。Nanodrop检测RNA样品的浓度和纯度,1%琼脂糖凝胶电泳评估样品的完整性。
1.2.2pUAS-Hey重组质粒构建 取质检合格的RNA样品作为模板,按照cDNA合成试剂盒的说明书进行逆转录反应合成第1链cDNA。然后以cDNA合成反应液作为模板,利用PCR技术扩增果蝇Hey基因的编码序列,并在两端分别加上EcoR Ⅰ和Xho Ⅰ酶切位点,正向引物:GCCGAATTCATG GAT CAC AAC ATG;反向引物: TAACTCGAGTCA ATA GGC CAT CTC,由GENEWIZ公司合成。PCR反应体系(50.00 μL)包括:10×缓冲液(含有Mg2+)5.00 μL,dNTP混和液(2.50 mmol/L)4.00 μL,正、反向引物(10.00 μmol/L)各1.00 μL,模板cDNA(100.00 ng/μL)1.00 μL,DNA聚合酶(5 U/μL)0.25 μL,灭菌蒸馏水37.75 μL。PCR扩增程序为94 ℃解链4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 30 s,共35个循环;72 ℃延伸8 min。PCR产物进行1%琼脂糖凝胶电泳检测。pUAST载体和纯化的PCR产物分别用EcoR Ⅰ和Xho Ⅰ于37 ℃酶切2 h,酶切产物进行1%琼脂糖凝胶电泳,然后利用凝胶回收试剂盒分别回收目的片段。回收产物于20 ℃在T4连接酶作用下连接4 h,连接产物通过热休克法转化DH5α感受态细胞,然后涂板培养并进行筛选和扩增。(1)从LB/Amp培养板上挑选单菌落接种至LB/Amp培养液中,37 ℃振荡培养2 h,以菌液作为模板进行菌落PCR筛选。(2)将阳性菌落培养液转移至锥形瓶中扩大培养,37 ℃振荡过夜,利用质粒纯化试剂盒提取阳性菌落所包含的质粒,然后用EcoR Ⅰ和Xho Ⅰ进行酶切鉴定。经过酶切验证后送至TaKaRa公司测序,测序正确后利用质粒Midi提取试剂盒抽提,得到高浓度和高纯度的pUAS-Hey重组质粒,用于显微注射。
1.2.3显微注射与转基因果蝇筛选、平衡和定位 注射前1 d将约200只W1118果蝇转至卵收集笼,供给涂有酵母的葡萄汁培养板进行适应。第2天供给新鲜的葡萄汁培养板,避光环境下于25 ℃收集胚胎40 min。室温下用次氯酸钠溶液处理胚胎去除外壳,去离子水充分冲洗,然后于18 ℃在显微镜下将卵呈线性排列,通过双面胶粘在载玻片上。在胚胎表面涂一层卤烃油700保湿,置于倒置显微镜下将显微注射针插入胚胎尾端极细胞部位,注入显微注射液后迅速退出。其中显微注射液的配制为pUAS-Hey重组质粒25.00 μg,Δ2-3辅助质粒5.00 μg,注射用缓冲液50.00 μL。将显微注射后的胚胎置于琼脂培养基上18 ℃培养,在注射后36~72 h挑取已孵化的幼虫转至玉米培养基,于18℃再培养3~4 d,然后转至25 ℃培养5 d,这段时间及时挑出羽化的雄蝇和处女蝇,分别与W1118品系的处女蝇和雄蝇杂交。杂交后置于25 ℃培养,约10 d后观察其子代。mini-white标记基因的表达可使野生型W1118果蝇的复眼由白色变为红色,因此通过观察子代复眼是否变红,即可明确目的基因有没有整合入基因组且处于可表达的区域。筛选出的UAS-Hey转基因红眼果蝇分别与B1/CyO、TM2/TM6B双平衡品系杂交,进行定位和平衡,从而获得稳定遗传的转基因品系,见图1。
1.2.4转基因果蝇的PCR验证 分别提取转基因果蝇和野生型W1118果蝇的基因组DNA作为模板,选择pUAST载体通用引物进行PCR扩增,正向引物:5′-GCT TCG TCT ACG GAG CGA CAA TTC AAT TCA AAC-3′,反向引物:5′-GCA GTA GCC TCA TCA TCA CTA GAT GGC ATT TCT TC-3′,由GENEWIZ公司合成。PCR反应体系包括(50.00 μL):10×缓冲液(含有Mg2+)5.00 μL,dNTP混和液(2.50 mmol/L)4.00 μL,正、反向引物(10.00 μmol/L)各1.00 μL,模板DNA(150.00 ng/μL)1.00 μL,DNA聚合酶(5 U/μL)0.25 μL,灭菌蒸馏水37.75 μL。PCR扩增程序为94 ℃解链4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃延伸8 min。PCR产物进行琼脂糖凝胶电泳检测。
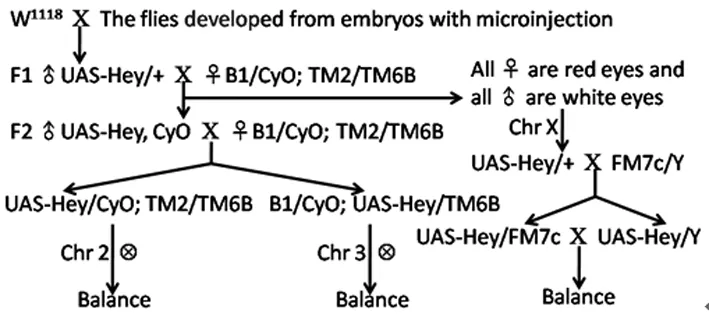
图1 UAS-Hey转基因果蝇的平衡和定位
1.2.5Western blot检测Hey蛋白表达水平 将构建好的UAS-Hey转基因果蝇与elav-GAL4果蝇品系杂交,使Hey基因靶向表达于神经系统。分别选取UAS-Hey果蝇品系、elav-GAL4/UAS-Hey果蝇品系的成虫,将其脑组织切下后立即加入组织裂解液匀浆,冰上孵育20 min,14 000×g离心10 min,收集上清液蛋白样品。采用BCA蛋白定量试剂盒测定其浓度,与蛋白上样缓冲液混合后100 ℃变性5 min,上样进行蛋白电泳。电泳结束后将蛋白转移至NCM,5%脱脂奶粉37 ℃封闭2 h。然后加入抗Hey抗体(1∶1 000)或抗β-Tubulin抗体(1∶2 000),4 ℃孵育过夜,HRP标记羊抗兔IgG(1∶1 000),37 ℃孵育1 h,DAB显色后采用凝胶成像系统进行图像采集和灰度分析,生物学重复3次。

2 结 果
2.1总RNA样品质量检测结果 提取的RNA质量直接影响后续的实验结果,因此对总RNA样品首先进行纯度和完整性的检测。本次实验所提取的3个总RNA样品的浓度分别为258.04、238.15、215.88 ng/μL;OD260/280分别为2.03、1.98、2.02,纯度符合标准;琼脂糖凝胶电泳结果如图2所示,18S条带宽而亮,无拖尾和弥散等情况,表明总RNA样品是完整的,也不存在基因组和盐成分等污染。另外,Agilent生物分析仪检测电泳图的基线均平整。因此,所提取的3个总RNA样品均可用于后续的逆转录PCR扩增。
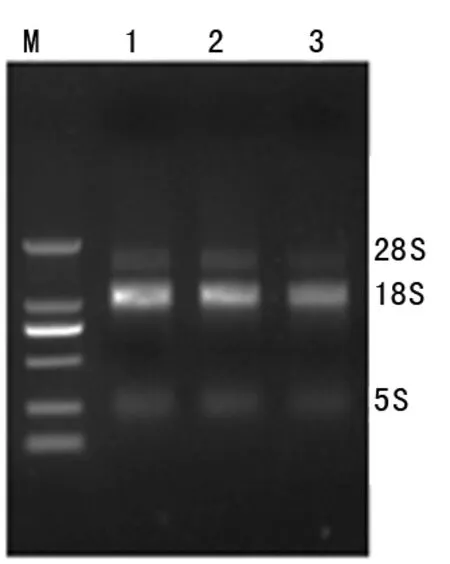
M:分子量Marker;1~3:总RNA样品
图2总RNA样品的琼脂糖凝胶电泳
2.2pUAS-Hey重组质粒构建结果 利用逆转录PCR技术扩增果蝇Hey基因编码序列,并在两端分别添加EcoR Ⅰ和Xho Ⅰ酶切位点,琼脂糖凝胶电泳结果显示,特异性扩增的PCR产物大小与理论值1.296 kb相符(图3)。pUAST载体和PCR产物分别用EcoR Ⅰ和Xho Ⅰ双酶切,回收的酶切产物进行连接、转化和涂板培养。提取PCR筛选阳性菌落的质粒DNA进行酶切分析, EcoR Ⅰ和Xho Ⅰ双酶切后得到1.296 kb的目的片段(图4)。并对阳性质粒进一步测序鉴定,测序结果与数据库比对未发现点突变和移码突变,所构建的pUAS-Hey重组质粒与理论相符。
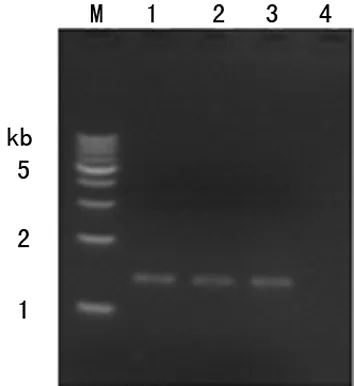
M:相对分子质量Marker;1~3:逆转录PCR扩增产物;4:无模板阴性对照
图3逆转录PCR扩增Hey基因编码序列
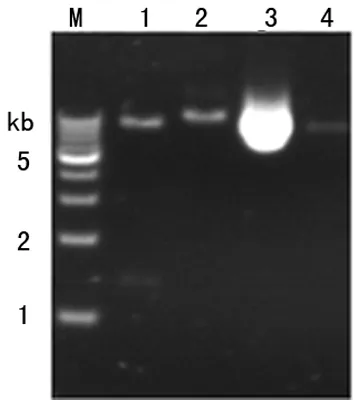
M:相对分子质量Marker;1:pUAS-Hey重组质粒EcoR Ⅰ和Xho Ⅰ双酶切;2:pUAS-Hey重组质粒Xho Ⅰ单酶切;3:未经酶切的pUAS-Hey重组质粒;4:pUAST质粒EcoR Ⅰ单酶切
图4 pUAS-Hey重组质粒的酶切鉴定
2.3显微注射和转基因果蝇平衡与定位 本实验显微注射了约1 000枚W1118果蝇胚胎,约10%孵化成幼虫,最终有60只发育至成虫。这些成虫分别与W1118品系杂交,根据复眼是否变红,在它们的子代中筛选出7个转基因红眼品系。分别与双平衡系杂交进行平衡与定位,结果发现6个转基因果蝇品系,其P[mini-white,UAS-Hey]整合入第3号染色体,另1个果蝇品系插入到第2号染色体,纯化后建立稳定遗传的品系。
2.4转基因果蝇的PCR分析结果 分别以W1118果蝇品系和转基因果蝇品系的基因组DNA,以及pUAS-Hey重组质粒为模板进行PCR扩增检测。以W1118品系的DNA为模板未扩增出产物,以转基因果蝇的基因组和pUAS-Hey重组质粒为模板均扩增出1.885 kb的目的片段(图5)。进一步测序发现该PCR产物包含了Hey基因的编码序列,且未发现点突变和移码突变。
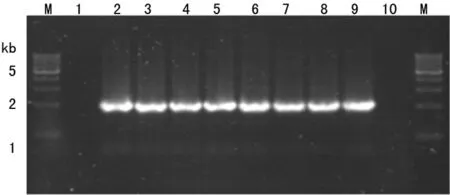
M:相对分子质量Marker;1:W1118野生型果蝇;2:pUAS-Hey重组质粒;3~9:转基因果蝇;10:无模板阴性对照
图5 UAS-Hey转基因果蝇品系的PCR分析
2.5Hey蛋白在果蝇脑组织的表达水平 分别提取UAS-Hey果蝇品系、elav-GAL4/UAS-Hey果蝇品系成虫脑组织总蛋白,通过Western blot检测Hey蛋白的表达水平,与UAS-Hey果蝇相比,elav-GAL4/UAS-Hey果蝇成虫脑组织中的Hey蛋白表达明显上调(P<0.05),见图6。
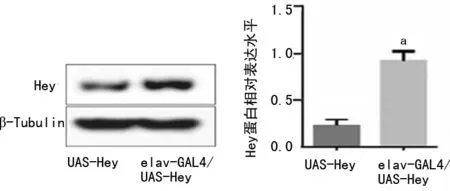
a:P<0.05,与UAS-Hey比较
图6 Hey蛋白在成虫脑组织的表达水平
3 讨 论
GAL4/UAS系统最早是在果蝇中建立的,GAL4基因与融合有UAS的靶基因分别位于不同的果蝇品系中,即GAL4表达品系和UAS-靶基因品系。当这两个品系杂交使二者处于子代的同一基因组时,GAL4蛋白才能特异结合UAS,促进其下游靶基因过表达。GAL4/UAS系统可用于基因过量表达、RNA干扰筛选、基因表达模式描绘、遗传突变挽救等,广泛应用于神经系统、心血管系统、视网膜和肌肉等组织的发育研究[8-10]。目前GAL4/UAS系统已应用到了多个生物类型,包括小鼠、斑马鱼、拟南芥等,被证明是高效的基因功能研究技术,对基因功能注释发挥着重要作用[11-12]。
果蝇Hey基因是基于小鼠Hey1基因的序列,通过检索表达序列标签(EST)数据库而鉴定出来。序列分析发现Hey具有bHLH结构域和Orange结构域,因此将Hey归类于bHLH超家族中的Hes/Hey亚家族。哺乳动物的Hey基因表达组织广泛,通常接受Notch通路的转导信息,作为转录抑制物结合在靶基因的启动子区抑制其转录活性,参与心脏发育、血管发生与重建、神经发生等过程[1,3,13]。原位杂交实验发现果蝇Hey基因的mRNA主要表达于中枢神经系统的脑和腹神经索;免疫染色表明Hey蛋白主要定位于有丝分裂后的新生神经元和神经胶质细胞,初步的功能分析发现果蝇Hey作为Notch信号的靶基因参与神经节母细胞的不对称细胞分裂,具体分子机制有待进一步阐明[7]。本实验结果表明,成功构建了pUAS-Hey重组质粒,与Δ2-3辅助质粒共同显微注射至野生型果蝇的胚胎,然后通过mini-white标记筛选出了UAS-Hey转基因红眼果蝇,并分别进行平衡与定位。pUAST载体包含5个串联的UAS序列,能够高效结合GAL4转录激活因子,其后依次为hsp70启动子,多克隆位点,SV40小T抗原内含子和SV40多聚腺苷酸加尾信号。这些特征序列被引入P因子,仅包含了P因子的3′末端和5′末端,因此不能编码转座酶,但是两末端含有转座酶结合位点。Δ2-3辅助质粒是改造的缺陷型果蝇P因子,能够编码转座酶,但是自身不能移动。在Δ2-3辅助质粒作用下,pUAS-Hey重组质粒中的P[mini-white,UAS-Hey]可以发生转座,并插入果蝇的基因组中。PCR扩增分析证实了P[mini-white,UAS-Hey]已整合入7个独立转基因品系的基因组,且处于可表达的区域,从而使果蝇的复眼表现为红色。另外,本课题组将构建好的UAS-Hey转基因品系与GAL4品系杂交,发现转基因品系在GAL4蛋白作用下能够促使Hey基因过表达,并且出现了异位刚毛感觉器官等异常表型,表明Hey的过量表达干扰了神经系统的正常发育,本课题组将继续探索该表型的具体机制。
综上所述,UAS-Hey转基因果蝇品系的成功构建为应用GAL4/UAS系统过量表达Hey基因,进一步研究Hey基因在发育过程中的功能及调控机制奠定了基础,也对哺乳动物Hey基因的相关研究提供参考和借鉴。
[1]WEBERD,WIESEC,GESSLERM.Chapter
eight-Hey bHLH transcription factors[J].Curr Top Dev Biol,2014(110):285-315.
[2]WEBER D,HEISIG J,KNEITZ S,et al.Mechanisms of epigenetic and cell-type specific regulation of Hey target genes in ES cells and cardiomyocytes[J].J Mol Cell Cardiol,2015,79(1):79-88.
[3]颜君,郭安源,贾海波,等.HEY转录因子的研究进展[J].现代生物医学进展,2013,13(4):763-768.
[4]HULLEMAN E,QUARTO M,VERNELL R,et al.A role for the transcription factor HEY1 in glioblastoma[J].J Cell Mol Med,2009,13(1):136-146.
[5]KOKUBO H,MIYAGAWA-TOMITA S,NAKAZAWA M,et al.Mouse hesr1 and hesr2 genes are redundantly required to mediate Notch signaling in the developing cardiovascular system[J].Dev Biol,2005,278(2):301-309.
[6]KOKUBO H,LUN Y,JOHNSON R L.Identification and expression of a novel family of bHLH cDNAs related to Drosophila hairy and enhancer of split[J].Biochem Biophys Res Commun,1999,260(2):459-465.
[7]MONASTIRIOTI M,GIAGTZOGLOU N,KOUMBANAKIS K A,et al.Drosophila hey is a target of notch in asymmetric divisions during embryonic and larval neurogenesis[J].Development,2010,137(2):191-201.
[8]ORFANOS Z.Transgenic tools for Drosophila muscle research[J].J Muscle Res Cell Motil,2008,29(6/8):185-188.
[9]JONES W D.The expanding reach of the GAL4/UAS system into the behavioral neurobiology of Drosophila[J].BMB Rep,2009,42(11):705-712.
[10]SUN M K,ZENG X K,XIE W.Temporal and spatial expression of Drosophila Neurexin during the Life cycle visualized using a DNRX-Gal4/UAS-reporter[J].Sci China Life Sci,2016,59(1):68-77.
[11]WAKI T,MIYASHIMA S,NAKANISHI M,et al.A GAL4-based targeted activation tagging system in Arabidopsis thaliana[J].Plant J,2013,73(3):357-367.
[12]KAWAKAMI K,ASAKAWA K,HIBI M,et al.Gal4 driver transgenic zebrafish:powerful tools to study developmental biology,organogenesis,and neuroscience[J].Adv Genet,2016,95(1):65-87.
[13]FISCHER A,GESSLER M.Delta-Notch——and then? protein interactions and proposed modes of repression by hes and hey bHLH factors[J].Nucleic Acids Res,2007,35(14):4583-4596.

