过表达miRNA-125b促进肺癌细胞A549的增殖、侵袭能力及其机制研究
张华勇,韩 强,李俏敏,钟北龙
(中山大学附属第五医院:1.胸心外科;2.麻醉科,广东珠海 519000)
近50年来许多国家都报道肺癌的发病率和病死率均明显升高,肺癌已经是我国死亡率第1位的恶性肿瘤,严重危害人民群众的身体健康[1]。肺癌患者早期诊断较为困难,故多数患者在就诊时已经处于肿瘤中晚期,预后较差。微小RNA(microRNAs,miRNA)是一类小分子的非编码单链RNA,长度为20~24个核苷酸,具有广泛的生物功能:人类约1/3的基因的表达受miRNA调节,过程包括早期发育、细胞增殖、细胞凋亡及脂肪酸的代谢[2-3]。越来越多的研究证明miRNA与多种肿瘤的发生、发展具有密切的相关性,其中miRNA-125b在口腔癌及子宫内膜癌等肿瘤组织中明显升高,并能通过多种机制影响肿瘤细胞的增殖、凋亡及侵袭性[4-5]。但miRNA-125b与肺癌的相关性研究较少。作者旨在探讨过表达miRNA-125b促进肺癌细胞A549的增殖、侵袭能力及其机制。
1 材料与方法
1.1材料 实验细胞:正常人支气管上皮细胞(human bronchial epithelial cells,HBECs)及人非小细胞肺癌(NSCLC)细胞A549购自上海天呈医疗科技股份有限公司。主要试剂及仪器:miRNA-125b模拟物、阴性对照(negative control,NC)模拟物购自上海伯豪生物技术有限公司,RPM2-1640培养液及胎牛血清购自美国Gibco公司,噻唑蓝(MTT)及二甲基亚砜(DMSO)购自美国Sigma公司,Gel DoxTM XR+凝胶成像系统购自美国Bio-RAD公司,Bcl-2 调节因子(BMF)及GAPDH抗体、BCA定量及Western blot试剂购自美国Invitrogen公司,RNA提取及PCR试剂购自瑞士Roche公司,PCR引物由宁波康贝生化有限公司合成(miRNA-125b上游引物:5′-GCU CCC UGA GAC CCU AAC-3′,下游引物:5′-CAG TGC AGG GTC CGA GGT-3′;GAPDH上游引物:5′-AGG TCG GTG TGA ACG GAT TTG-3′,下游引物:5′-GGG GTC GTT GAT GGC AAC A-3′);超净无菌工作台购自德国Spetec公司,细胞培养箱购自美国Thermo公司,低速离心机购自美国Beckman Coulter公司,倒置荧光显微镜购自日本Olympus公司,酶标仪购自美国Biotek公司,PCR仪购自美国Thermo公司。
1.2方法
1.2.1细胞培养 按3×105个/mL的密度将细胞悬液接种于96孔板培养,于37 ℃,5%CO2培养箱中培养,待细胞面积生长至70%~80%后传代。
1.2.2Q-PCR检测HBECs及A549细胞的miRNA-125b表达水平 按照TrizolTM试剂盒说明书提取HBECs及A549细胞总RNA,测定RNA浓度及纯度,取1 μg总RNA反转录合成cDNA,取5 μL cDNAxo稀释4倍后,取2 μL为模板,分别以目的基因及内参GAPDH的引物进行Q-PCR,反应条件:95 ℃预变性3 s;95 ℃变性10 s;60 ℃退火/延伸30 s,重复 40个循环;65~95 ℃每增加0.5 ℃进行5 s读板,形成溶解曲线。所有样本均设置3个平行管,基因表达量以平行管平均循环阈值(cycle-threshold,Ct)表示,应用2-ΔΔCt法计算并比较两种细胞miRNA-125b表达水平。
1.2.3细胞转染 操作按照miRVanaTmmiRNA步骤进行:将转染液以1∶30的比例加入RPM2-1640无血清培养基中混匀后静置10 min,将miRNA-125b模拟物及NC模拟物分别加入混有转染剂的培养基中混匀,静置10 min后以反应生成复合体。将配置好的复合体铺在96孔板并轻轻晃动,加入3×105个/mL的细胞悬液,混匀后置于培养箱中培养。将A549细胞分为3组:miRNA-125b组(加入miRNA-125b模拟物),NC组(加入NC模拟物)及空白组(同等体积的混有转染剂的胎牛血清),采用Q-PCR检测miRNA-125b的转染及表达效率。
1.2.4MTT检测细胞增殖能力 于细胞传代后3、6、12、24、48 h采用MTT检测A549细胞的增殖:各组细胞处理完后去除培养基,加入RPM2-1640培养液(每孔100 μL)及含0.5% MTT的培养液(每孔5 μL),于37 ℃,5%CO2培养箱中孵育4 h后弃培养液,加入100 μL DMSO原液,振荡10 min,待结晶完全溶解后用酶标仪于490 nm波长处测定吸光度(OD)值,实验重复3次。
1.2.5Transwell小室细胞检测细胞侵袭能力 采用小室法检测细胞侵袭力:使用PBS将50 mg/L的Matrigel胶按照1∶8的比例稀释后包被Transwell小室底部膜的上室面(每孔100 μL),4 ℃风干后吸出残存液体。按照每孔1×104的密度将3组A549细胞接种于处理好的上室中,在下室中加入500 μL 10%胎牛血清的培养基中培养24 h。用PBS洗去残留培养基,4%的多聚甲醛固定过夜后洗去甲醛,HE染色后洗去染色液。侵袭能力评价依照过膜细胞数:在300倍镜下选择小室中央区域,随机挑选5个视野并计数,求平均值。
1.2.6miRNA-125b靶基因检测 采用targetscan(http://www.targetscan.org)根据3′-UTR预测miRNA-125b的靶基因为BMF,Western blot检测3组A549细胞的BMF表达水平:按照说明书用蛋白裂解液(含磷酸酶抑制剂)裂解30~60 min,4 ℃,12 000×g离心5 min获取总蛋白,BCA法测浓度后各取30 μg蛋白在聚丙烯酰胺凝胶电泳,100 V恒压转膜60~90 min;5%脱脂奶粉/TBST室温封闭1~2 h,BMF(抗体1∶500)抗体4 ℃孵育过夜;1∶5 000 β-actin室温孵育90 min,TBST洗膜10 min×3次,辣根过氧化物酶标记的羊抗兔/鼠二抗室温孵育2 h,TBST洗膜10 min×2次,TBS洗膜5 min,ECL发光试剂盒色,显影,Gel DOXTM XR+凝胶成像系统成像,图像分析采用QuantityOne软件,取各条带透光体积与内参条带的比值作为目标蛋白相对表达量,实验重复3次。

2 结 果
2.1HBECs及A549细胞miRNA-125b的表达水平比较 HBECs、A549细胞miRNA-125b的表达水平分别为1.0±0.1、2.7±0.4,与HBECs细胞比较,A549细胞的miRNA-125b表达水平明显上升(t=5.925,P<0.05),见图1。
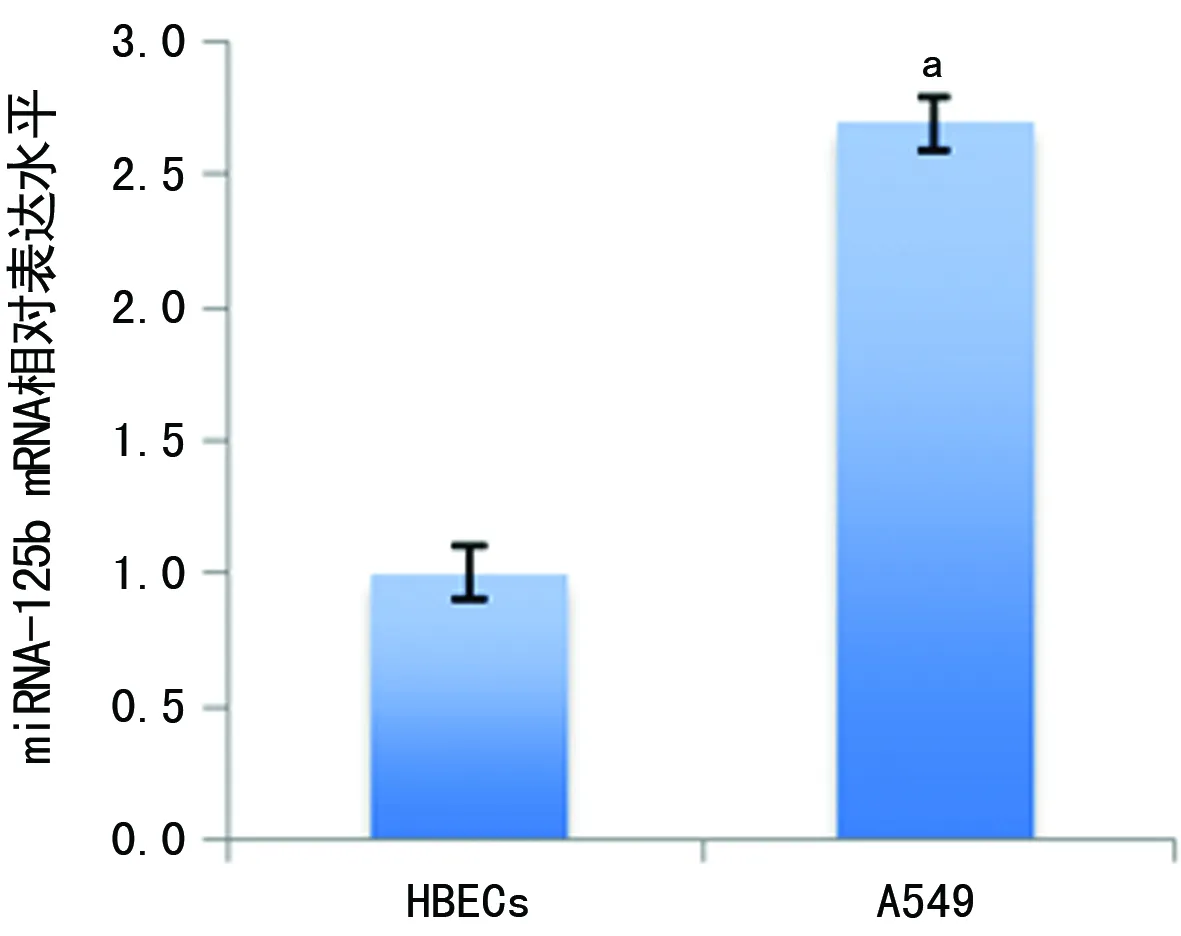
a:P<0.05,与HBECs细胞比较
图1两种细胞的miRNA-125b表达水平
2.2各组A549细胞的miRNA-125b表达水平比较 与空白组(1.0±0.2)比较,miRNA-125b组细胞的miRNA-125b(2.9±0.6)表达水平上升(t=6.249,P<0.05);NC组的miRNA-125b表达水平(1.0±0.1)无明显变化(t=0.172,P>0.05),见图2。
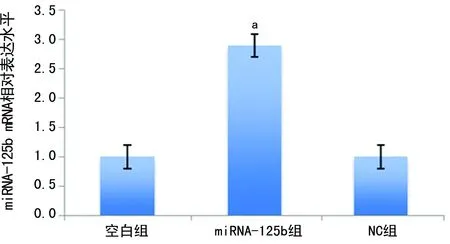
a:P<0.05,与空白组比较
图2各组细胞的miRNA-125b表达水平
2.3各组A549细胞增殖能力比较 与空白组及NC组细胞比较,miRNA-125b组细胞的增殖能力明显增加(P<0.05);NC组与空白组细胞的增殖能力比较,差异无统计学意义(P>0.05),见图3。
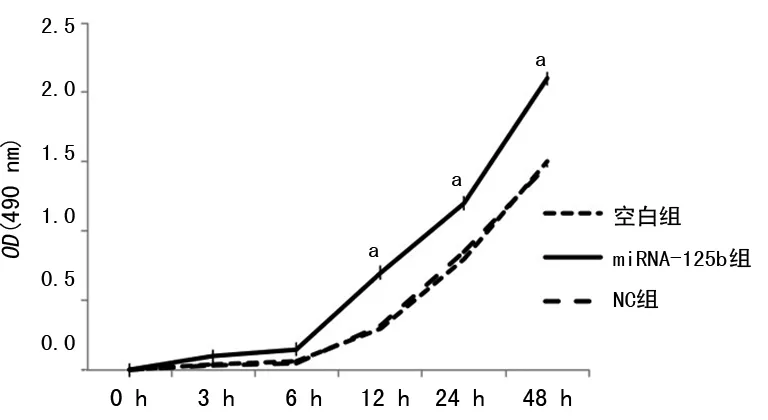
a:P<0.05,与空白组比较
图3各组细胞的增殖能力比较
2.4各组A549细胞侵袭能力比较 空白组、miRNA-125b组、NC组过膜细胞数分别为(21.0±4.0)、(28.0±5.0)、(22.0±5.0)个。与空白组比较,miRNA-125b组细胞的侵袭能力上升(t=2.984,P<0.05);NC组与空白组的侵袭能力比较,差异无统计学意义(t=0.357,P>0.05)。
2.5各组A549细胞的BMF表达水平 与空白组(1.0±0.1)比较,miRNA-125b组细胞的BMF(0.4±0.2)表达水平下降(t=5.921,P<0.05);NC组的BMF(0.9±0.1)表达水平无明显变化(t=0.285,P>0.05),见图4。
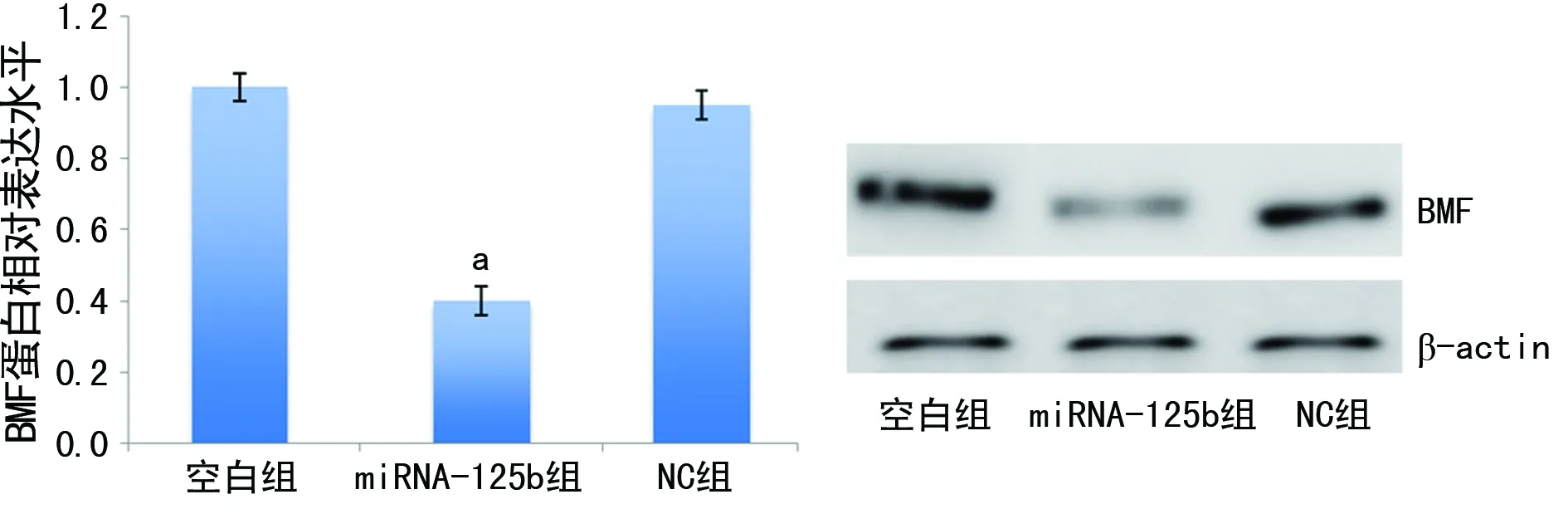
a:P<0.05,与空白组比较
图4各组细胞的BMF表达水平
3 讨 论
目前,我国肺癌的发生率呈现逐年上升的趋势,其中85%的患者为NSCLC。NSCLC的恶性程度较高,肿瘤进展较快,多数患者在确诊时已经出现转移,患者预后较差[6]。miRNA是一种内源性非编码单链RNA分子,参与转录后基因表达调控。目前为止,动植物及病毒中已经发现有超过20 000个miRNA分子[7]。既往研究发现,多种疾病(心血管疾病、糖尿病及多种恶性肿瘤)患者存在异常的miRNA表达谱系,且miRNA在外周血中的存在较为稳定,多种miRNA在疾病诊断中的价值引起临床上的关注。对miRNA生物学活性的深入了解,以miRNA作为疾病治疗潜在靶点的研究已引起广泛关注[8-9]。
miRNA-125b属于miRNA-125家族,在不同生物学过程中发挥重要作用。miRNA-125b与肿瘤的发生、发展具有密切相关性,miRNA-125b在多种肿瘤组织中表达水平升高,本研究中,与HBECs相比,肺癌细胞A549的表达水平明显上升。既往研究发现,化疗失败的的白血病患者的miRNA-125b水平明显上升,而高表达的miRNA-125b能够有效抑制多种化疗药物引起的白血病细胞凋亡,增强肿瘤细胞的耐药性[10];但miRNA-125b的过量表达后子宫内膜癌细胞的增殖能力下降,细胞周期停滞于G1期,细胞凋亡增加[11]。上述结果说明miRNA-125b的作用具有组织特异性,本研究旨在观察miRNA-125b对肺癌细胞A549的增殖及侵袭能力的影响,并探讨其机制。
本研究通过miRNA-125b模拟物转染的方式构建miRNA-125b的高表达模型,经过转染后,A549细胞的miRNA-125b表达水平明显上调,细胞的增殖能力及侵袭能力增加。miRNA-125b调节细胞生物活性的机制较为复杂,既往研究发现BMF是miRNA-125b的潜在靶基因。BMF属于Bcl-2家族,是常见的肿瘤促凋亡蛋白之一,人体BMF记忆位于15号染色体q14,在多种组织(肾脏、胰腺及造血系统等)中广泛表达[12]。在正常细胞中,BMF与动力蛋白复合物结合,处于静止状态;BMF与动力蛋白复合物解离后参与线粒体途径的细胞凋亡,BMF表达水平的下降或表达缺失导致细胞凋亡途径受阻,细胞的增殖能力增加[13-14]。
既往研究发现,miRNA主要通过两种机制调节靶向基因的表达:(1)miRNA与靶基因完全互补结合,切割靶基因的mRNA从而抑制其表达;(2)当miRNA与靶基因不完全互补时,miNAR主要抑制靶基因的翻译过程,而不影响mRNA的稳定性[15]。部分miRNA可以通过上述两种机制抑制靶基因的表达,而miRNA-125b对靶基因BMF的作用机制有待于进一步研究。
综上所述,miRNA-125b能通过抑制BMF的表达促进肺癌细胞A549的增殖及侵袭。
[1]ETTINGER D S,AKERLEY W,BEPLER G,et al.Non-small cell lung cancer[J].J Natl Compr Canc Netw,2010,8(7):740-801.
[2]陈劼.血液中microRNA-21对肺癌诊断价值的Meta分析[J].重庆医学,2015,44(17):2389-2391.
[3]郭迪,李宏云,杨华.miRNA-152表达与NSCLC对顺铂耐药的关系及其机制研究[J].重庆医学,2016,45(10):1297-1301.
[4]ZUBERI M,KHAN I,MIR R,et al.Utility of serum miR-125b as a diagnostic and prognostic indicator and its alliance with a panel of tumor suppressor genes in epithelial ovarian cancer[J].PLoS One,2016,11(4):e0153902.
[5]王淑芳,冯玉珍,霍新龙.microRNA在子宫内膜癌发生、发展及临床诊治中的研究[J].中国医药导报,2013,10(6):30-32.
[6]丁明建,王闻哲,王孝举.microRNA在肺癌中的表达及其临床意义[J].中国临床药理学杂志,2013,29(12):965-968.
[7]刘换新,郭琳琅.microRNA在肺癌早期诊断及预后中的应用[J].临床与实验病理学杂志,2013,29(11):1232-1234.
[8]常甜甜,刘东华.microRNA与肺癌侵袭转移、诊断、治疗、预后关系的研究现状[J].辽宁医学院学报,2016,37(2):96-100.
[9]吴传勇,薛剑,娄加陶.microRNA在肺癌诊断、治疗及预后判断中的作用[J].上海交通大学学报(医学版),2011,31(3):368-372.
[10]ZHOU L,BAI H,WANG C,et al.microRNA-125b promotes leukemia cell resistance to daunorubicin by inhibiting apoptosis[J].Mol Med Rep,2014,9(5):1909-1916.
[11]常军,刘玲芳,郑殊娟,等.过表达miR-125b对子宫内膜癌HEC-1B细胞周期、增殖和凋亡的影响及其可能的机制[J].中国肿瘤生物治疗杂志,2014,21(3):303-308.
[12]FIORI M E,BARBINI C,HAAS T L,et al.Antitumor effect of miR-197 targeting in p53 wild-type lung cancer[J].Cell Death Differ,2014,21(5):774-782.
[13]LIEW S H,VAITHIYANATHAN K,COOK M,et al.Loss of the proapoptotic BH3-only protein BCL-2 modifying factor prolongs the fertile Life span in female mice[J].Biol Reprod,2014,90(4):77-80.
[14]TAN B S,TIONG K H,CHOO H L,et al.Mutant p53-R273H mediates cancer cell survival and anoikis resistance through AKT-dependent suppression of BCL2-modifying factor(BMF)[J].Cell Death Dis,2015,6(7):e1826.
[15]申娴,张艳秋,王希恺,等.微小RNA-125b对肺癌细胞95D生物学功能的影响[J].环境与职业医学,2016,33(5):444-449.

