慢性缺血性脑白质脱髓鞘比格犬模型中Tau蛋白表达及可能原因
章洪智,刘 静,杨 树,王多姿,魏 本,郭富强△
(1.电子科技大学医学院生物医学工程,成都 610054;2.四川省医学科学院/四川省人民医院/电子科技大学附属医院神经内科,成都 610072;3.中国人民解放军成都军区总医院神经内科,成都 610083)
据世界卫生组织预测,到2050年中国将成为世界上老龄化最严重的国家之一,在老年患者中可常见侧脑室周围脑白质脱髓鞘病变,随着脱髓鞘病变的进展,可逐渐出现认知、运动、排尿等功能障碍。leukoaraiosis and disability study(LADIS)研究发现重度脑白质脱髓鞘病变患者出现生活能力下降的风险为轻度脑白质脱髓鞘病变患者的两倍[1]。而目前缺血性脑白质脱髓鞘病变病理机制尚未有学界共识。
脑白质主要由胶质细胞、轴突、髓鞘和血管组成。动脉病变引起的缺血缺氧性损伤是脑白质脱髓鞘病变主要原因之一[2]。缺血性脱髓鞘改变常伴有脑室周围白质区少突胶质细胞(OLs)变性死亡、髓鞘水平下降等病理改变[3]。有研究发现,缺血后神经元中Tau蛋白(脑内含量最多的微管相关蛋白)过度磷酸化与凋亡现象共存,Tau蛋白也可作为预测和诊断神经退行性疾病的标志[4-5],Tau蛋白在缺血缺氧后神经细胞的损伤与凋亡现象中扮演重要的角色。为探索Tau蛋白在慢性缺血性脑白质脱髓鞘病理改变中的影响及可能机制,本实验利用成年比格犬制备慢性缺血性脑白质脱髓鞘模型,苏木精-伊红(HE)染色、卢卡斯快蓝(luxol fast blue,LFB)染色后观察脑白质脱髓鞘病变及病变程度,免疫组织化学法(IHC)检测Tau、神经胶质抗原2(NG2)、2,3-环核苷3-磷酸二酯酶(CNPase)等表达水平,描述慢性脑缺血对OLs分化成熟的影响,分析Tau与NG2、CNPase表达水平之间的关系,探讨在慢性缺血性脑白质脱髓鞘病变中Tau蛋白表达水平的变化及可能的原因。
1 材料与方法
1.1材料 动物:健康成年比格犬16只,由四川省人民医院实验动物中心提供,年龄1.5~2.0岁,体质量为10~12 kg。主要试剂:LFB染色液购自Sigma-Aldrich(上海)贸易有限公司;兔多克隆Tau抗体购自北京博奥森生物技术有限公司;兔多克隆NG2抗体及兔多克隆CNPase抗体均购自英国abcam艾博抗(上海)贸易有限公司。
1.2方法
1.2.1实验动物分组及慢性脑白质缺血缺氧模型的制备 将16只比格犬按随机数字表法平均分为A组(假手术组)和B、C、D组(观察组),每组4只。参考文献[6]的方法经颅外制作脑缺血缺氧模型,对A组比格犬术前12 h禁食,4 h禁水,用30 mg/kg戊巴比妥钠腹腔注射麻醉,颈前部去毛消毒后正中切开皮肤5.0 cm左右,然后经颈前肌及筋膜,在胸锁乳突肌内侧钝性分离出颈总动脉,另一侧操作相同。B、C、D组采用两步手术法。第一步:将B、C、D组的12只比格犬双侧颈总动脉结扎。具体方法:参照假手术组,术后普通饲料喂养1个月。第二步:B组不结扎椎动脉,C组结扎右侧椎动脉,D组即结扎犬双侧椎动脉。具体方法:同上术前准备及麻醉后,颈部脱毛消毒,仰卧位固定,于5、6 颈椎间做一切口,正中略偏右,分离各层组织,在颈长肌内下放钝性分离出椎动脉,另一侧同此操作方法。术后16只比格犬全部存活,以普通饲料喂养1个月后处死。
1.2.2标本留取及HE染色、LFB髓鞘染色 将4组比格犬术后普通饲料喂养1个月后处死并留取脑组织,分别取左右两侧侧脑室边缘脑白质,用4%多聚甲醛固定液固定,石蜡包埋,做好编码。HE染色及FLB髓鞘染色均采用常规切片、脱蜡、染色、脱水、封固等方法步骤。
1.2.3IHC检测 防脱片处理:3-氨丙基三乙氧基硅烷(APES)浸泡,捞片后置烤箱60 ℃ 60 min使切片紧密黏附;切片常规脱蜡至水;30%过氧化氢1份+蒸馏水10份混合,室温10 min以灭活内源性过氧化物酶,蒸馏水洗3次;热修复抗原:将切片浸入0.01 mol/L柠檬酸盐缓冲液(pH 6.0),微波炉中高火加热至沸腾后断电,间隔5 min后,重复1次,冷却后,PBS(pH 7.2~7.4)洗2次;滴加山羊血清封闭液,室温20 min;滴加稀释的一抗(Tau抗体 1∶200、NG2抗体1∶100、CNPase抗体1∶200),4 ℃过夜,PBS洗3次;滴加生物素化山羊抗鼠/兔IgG二抗,37 ℃ 30 min,PBS洗3次;滴加辣根过氧化酶标记链霉素卵蛋白试剂 30 min(37 ℃),PBS洗4次;DAB显色:使用DAB显色试剂盒,取1 mL蒸馏水,加试剂盒A、B、C试剂各1滴,混匀后滴加到切片上,室温显色,镜下控制反映时间,一般2 min左右,蒸馏水洗涤;苏木精轻度复染,脱水,透明,中性树胶封片。
1.2.4采图及检测平均光密度(IOD)值 采用数码三目显微摄像系统对切片进行图像采集,每张切片先于100倍下观察全部组织,再根据组织大小及表达情况分别选取3个不重叠区域400倍下采集图像;后采用Image-Pro Plus 6.0图像分析系统测定所采集全部图像的IOD值,对每张切片采集的3张图像IOD取平均值。
1.2.5评价标准 脑组织脱髓鞘病变程度LFB染色后评分参照文献[7]的标准:正常神经纤维及髓鞘形态为0分;紊乱的神经纤维、髓鞘染色深浅不一为1分;髓鞘肿胀、断裂、明显的液泡形成为2分;有髓神经纤维消失、髓鞘彻底溃变并被吞噬细胞清除、不能再显示染色阳性表达为3分。Tau蛋白及NG2、CNPase阳性表达均为棕色。

2 结 果
2.1各组动物髓鞘LFB染色评分及HE染色比较 A、B、C、D组LFB染色评分分别为(0.75±0.71)、(1.38±0.06)、(1.63±0.52)、(1.88±0.64)分,与A组比较,各组动物脱髓鞘病变程度均明显加重(P<0.05)。HE染色可见慢性脑缺血后脑白质明显脱髓鞘病理改变, A组OLs髓鞘及OLs形态结构正常完整,OLs丰富;B、C、D组中则可见OLs明显减少及不同程度脱髓鞘表现,如髓鞘肿胀、髓鞘断裂,变性的髓鞘最后变为中性脂肪,被吞噬细胞吞噬后变成格子细胞,少数可见脂滴空泡或含铁血黄素沉积等,亦可见随着缺血程度加重OLS数量明显减少,见图1。
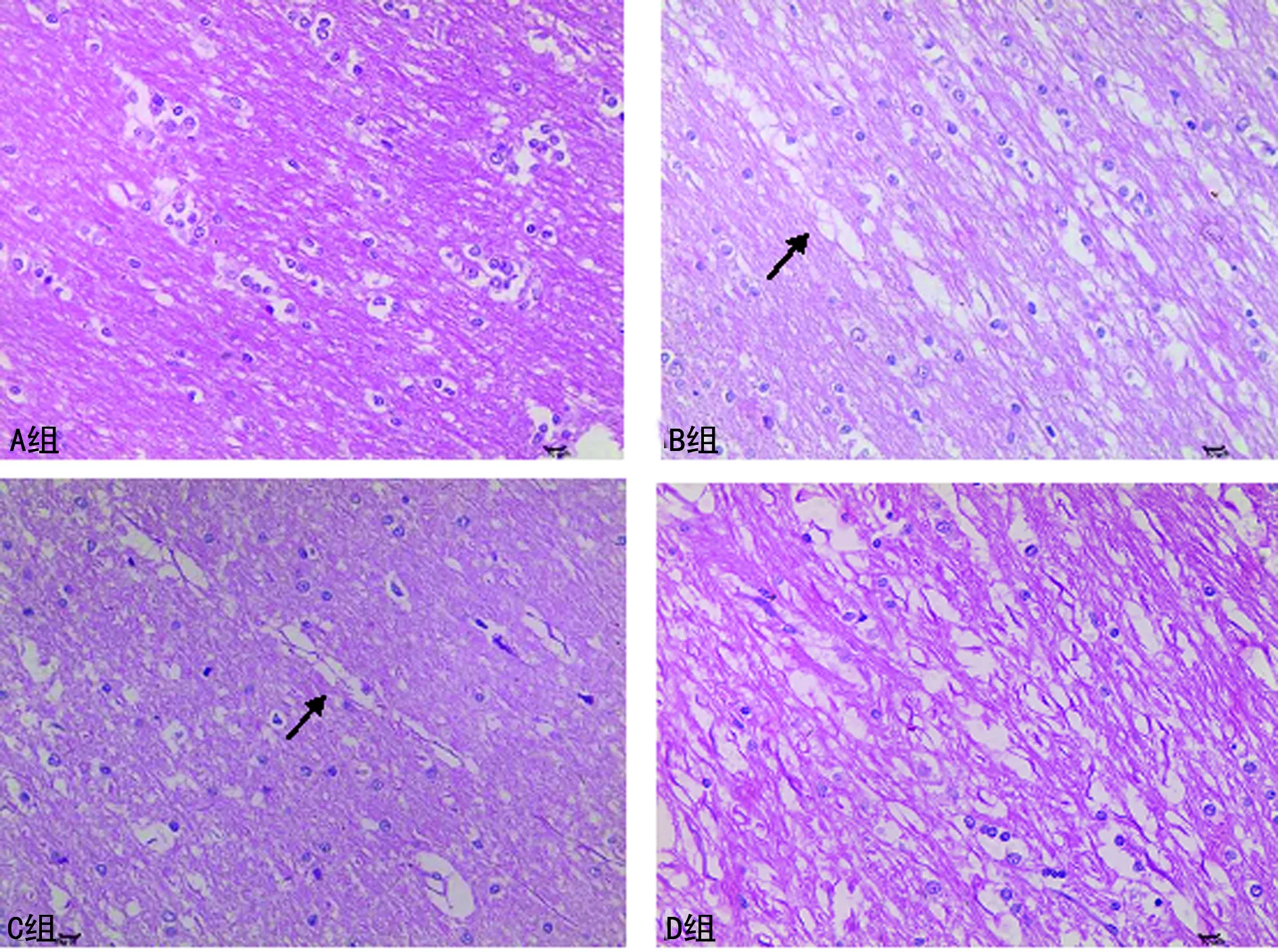
图1 各组动物髓鞘形态(HE,×400)
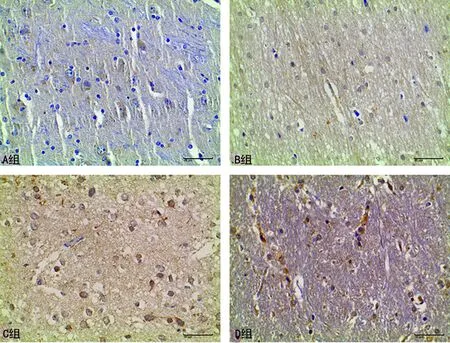
图2 各组动物脑白质Tau蛋白表达比较(IHC,×400)
2.2各组动物脑白质Tau蛋白及NG2、CNPase表达比较 与A组比较,B、C、D组Tau蛋白及NG2表达水平明显增高(P<0.05);CNPase表达水平明显降低(P<0.05),见图2~4及表1。
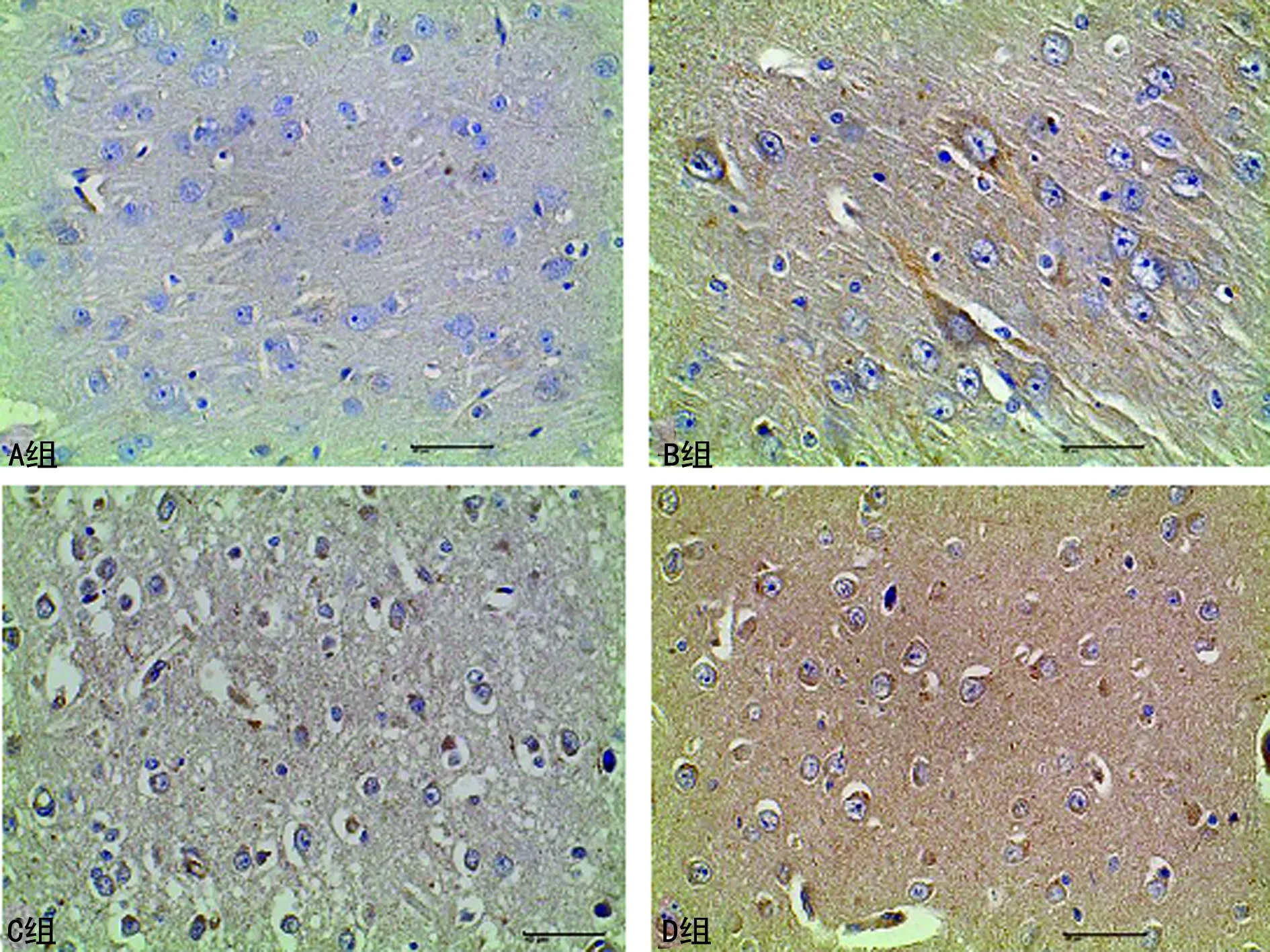
图3 各组动物脑白质NG2表达比较(IHC,×400)
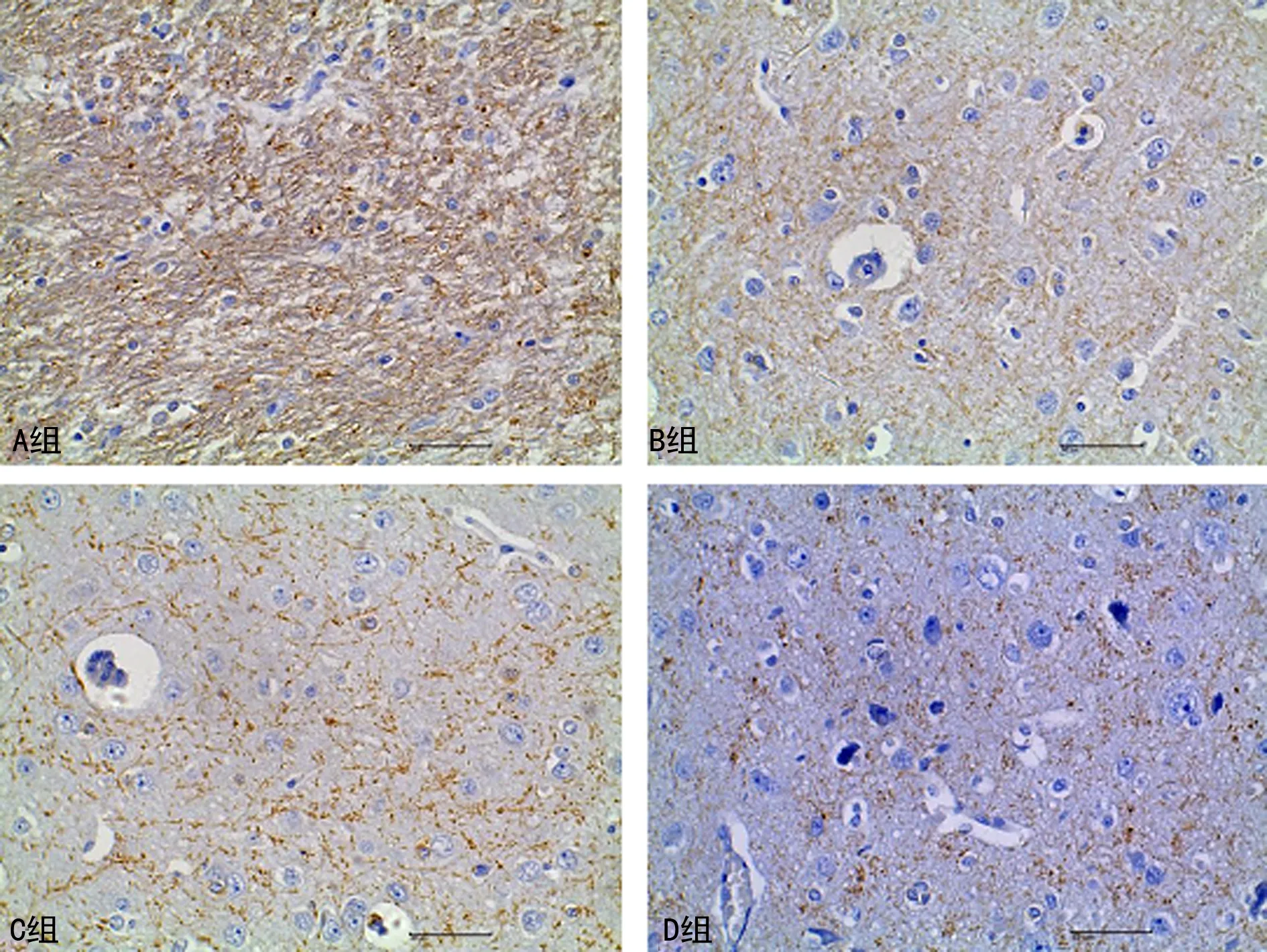
图4 各组动物脑白质CNPase表达比较(IHC,×400)
表1 各组动物脑白质Tau蛋白、NG2及CNPase表达比较
a:P<0.01,b:P<0.05,与A组比较
2.3Tau、NG2及CNPase表达水平相关性分析 对各指标两两进行相关性分析结果显示,Tau与NG2的表达水平呈正相关(r=0.277,P=0.006);Tau、NG2与CNPase的表达水平呈负相关(r=-0.303、-0.402,P=0.003、0.001)。
3 讨 论
从解剖学特点来看,脑室周围的深部白质主要通过穿支动脉供血,很少或者完全没有侧支循环可供代偿,这决定了其易受脑缺血缺氧的影响。有研究发现脑缺血患者较健康者在各个脑组织部位都有更多脑白质脱髓鞘改变[8]。本研究通过HE染色从病理形态学证实了慢性脑缺血缺氧会引起脑白质脱髓鞘病理改变,对LFB髓鞘染色后对脱髓鞘病变评分结果表明,B、C、D组中脱髓鞘病变程度均加重(P<0.05),说明慢性脑缺血缺氧可导致脑白质脱髓鞘。
有研究表明,缺血缺氧引起的脑白质病变可能为脑缺血引起OLs的损伤所致[9],OLs是中枢神经系统髓鞘形成细胞。Tau蛋白在窒息缺氧后新生儿血清中的表达水平可预测神经系统损伤预后[10],高灵敏度的Tau蛋白检测可对缺氧性脑损伤后的脑功能进行评估和预测[11]。
Tau蛋白在轴突的通信传导和神经系统的形成中有至关重要的作用,轴索延伸刺激Tau蛋白在髓鞘细胞中表达,其DNA通过转录翻译可促进髓鞘形成[12]。在大鼠大脑中动脉闭塞(MCAO)动物模型中,Tau蛋白在OLS中的阳性表达增强6~8倍[13]。本研究结果显示,B、C、D组中Tau蛋白的表达较A组表达明显增加(P<0.05),且随缺血程度加重Tau的表达水平亦明显升高。少突胶质前体细胞(OPCs)可分化为OLS、星状胶质细胞和小胶质细胞,NG2是分化早期OPCs重要的免疫性标记物。脑室周围白质OPCs中有NG2表达的细胞数量占大多数[14]。NG2细胞对缺氧缺血损伤高度敏感,通过使早产动物缺氧缺血建立脑室周围白质损伤(PWMID)模型,形成选择性脑白质损伤,发现NG2细胞加速形成,但多不分化为OLS,亦不形成髓鞘[15]。
目前认为Tau蛋白在OLs尤其是OPCs中表达,并参与调控髓鞘化进程,为进一步阐明Tau蛋白在OLS中的作用,VERONIKA等[16]通过下调Tau蛋白siRNA的技术,发现Tau蛋白的缺失导致了髓鞘碱性蛋白(MBP)的表达减少。有研究也发现MBP mRNA到远端细胞的扩展运输受损且细胞仍然维持在NG2阶段[17]。本研究在缺血缺氧的B、C、D组中NG2表达水平较A组明显增加(P<0.05),这说明慢性脑缺血损伤时OPCs表达水平增高。
CNPase为一种髓鞘形成相关蛋白,特异性地表达在OLs中,被广泛用于标记OLs。相较于MBP和蛋白脂质蛋白(PLP)等髓鞘蛋白,CNPase在OLs的表达更早出现,在病理状态下OPCs的分化成熟障碍、髓鞘形成减少均会导致CNPase的减少[17-18]。本研究中B、C、D组较A组CNPase的表达水平降低(P<0.05),结合NG2表达水平的变化,可以说明在慢性脑缺血时OPCs存在分化成熟障碍。通过对各组动物Tau、NG2、CNPase在侧脑室边缘白质表达水平进行Pearson线性相关性分析,Tau与NG2的表达水平呈正相关,NG2与CNPase的表达水平呈负相关,提示Tau蛋白在慢性脑缺血时的高表达可能与OPCs分化成熟障碍相关。SEIBERLICH等[19]研究也发现,Tau蛋白的平衡失调会导致OLS分化异常,以及神经胶质细胞的接触形成和髓鞘早期形成过程的异常。
综上所述,Tau蛋白在慢性缺血性脑白质脱髓鞘比格犬模型中的表达增加,可能与OPS分化成熟障碍相关。本研究结果为今后脱髓鞘病理机制研究提供了一定的参考和可能的方向。
[1]INZITARI D,PRACUCCI G,POGGESI A,et al.Changes in white matter as determinant of global functional decline in older independent outpatients:three year follow-up of LADIS(leukoaraiosis and disability) study cohor[J].BMJ,2009,339(7715):b2477.
[2]PANTONI L,GARCIA J H.Pathogenesis of leukoaraiosis:a review[J].Stroke,1997,28(3):652-659.
[3]BOWLER V.Editorial commet-The progression of leukoaraiosis[J].Stroke,2003,34(8):1916-1917.
[4]WEN Y,YANG S,LIU R.Transient cerebral ischemia induces aberrant neuronal cell cycle re-entry and Alzheimer′s disease-like tauopathy in female rats[J].Biol Chem,2004,279(21):22684-22692.
[5]SCHRAEN-MASCHKE S,SERGEANT N,DHAENENS C,et al.Tau as a biomarker of neurodegenerative diseases[J].Bio Med,2008,2(4):363-384.
[6]孙永明,郑祖根,沈忆新.经颅外制作犬后脑缺血模型[J].中华实验外科学杂志,1998,15(6):565.
[7]HIDEAKI W,HIDEKAZU T,AKIGUCHI I,et al.Axonal damage and demyelination in the white matter after chronic cerebral hypoperfusion in the rat[J].Brain Res,2002,924(1):63-70.
[8]TOMIMOTO H,IHARA M,WAKITA H,et al.Chronic cerebral hypoperfusion induces white matter lesions and loss of oligodendroglia with DNA fragmentation in the rat[J].Acta Neuropathol,2003,106(6):527-534.
[9]GABRIELLA M,CHRISTIAN Z,MUSCAT R,et al.Oligodendrocyte pathophysiology and treatment strategies in cerebral ischemia[J].CNS Neurosci Ther,2014,20(7):603-612.
[10]TAKAHASHI K,HASEGAWA S,MAEBA S,et al.Serum tau protein level serves as a predictive factor for neurological prognosis in neonatal asphyxia[J].Brain Dev,2014,36(8):670-675.
[11]RANDALL J,MÖRTBERG E,PROVUNCHER G,et al.Tau proteins in serum predict neurological outcome after hypoxic brain injury from cardiac arrest:Results of a pilot study[J].Resuscitation,2013,84(3):351-356.
[12]TATEBAYASHI Y,HAQUE N,TUNG Y C,et al.Role of tau phosphorylation by glycogen synthase kinase-3beta in the regulation of organelle transport[J].J Cell Sci,2004,117(Pt9):1653-1663.
[13]IRVING E A,YATSUSHIRO K,MCCULLOCH J,et al.Rapid alteration of tau in oligodendrocytes after focal ischemic injury in the rat:involvement of free radicals[J].J Cereb Blood Flow Metab,1997,17(6):612-622.
[14]DAWSON M R,POLITO A,LEVINE J,et al.NG2-expressing glial progenitor cells:an abundant and widespread population of cycling cells in the adult rat CNS[J].Mol Cell Neurosci,2003,24(2):476-488.
[15]AGUIRRE A,GALLO V.Postnatal neurogenesis and gliogenesis in the olfactory bulb fromNG2-expressing progenitors of the subventricular zone[J].J Neurosci,2004,24(46):10530-10541.
[16]VERONIKA S,BAUER N G,LISA S,et al.Downregulation of the microtubule associated protein Tau impairs process outgrowth and myelin basic protein mRNA transport in oligodendrocytes[J].Glia,2015,63(9):1621-1635.
[17]KURSULA P.Structural properties of proteins specific to the myelin sheath[J].Amino Acids,2008,34(2):175-185.
[18]JESERICH G,KLEMPAHN K,PFEIFFER M,et al.Features and functions of oligodendrocytes and myelin proteins of lower vertebrate species[J].J Mol Neurosci,2008,35(1):117-26.
[19]SEIBERLICH V,BAUER N G,SCHWARZ L,et al.Downregulation of the microtubule associated protein Tau impairs process outgrowth and myelin basic protein mRNA transport in oligodendrocytes[J].Glia,2015,3(9),1621-1635.

