PD-1、PD-L1在喉癌中的表达及临床意义
张再兴,周尚清
(华北理工大学附属医院耳鼻咽喉科,河北唐山 063000)
近年来程序性死亡因子1(programmed death 1,PD-1)与PD配体1(PD ligand 1,PD-L1)在恶性肿瘤中的高表达逐渐引起研究者的关注。PD-1是一种位于淋巴细胞表面的受体蛋白,主要位于T细胞表面,具有负向调节T细胞活性的功能[1]。PD-L1属于B7家族的成员之一,可以在活化的T淋巴细胞、B淋巴细胞及其他免疫细胞表面广泛表达。PD-1与其配体结合后,使下游的脾酪氨酸激酶(spleen tyrosine kinse,Syk)和磷脂酰肌醇3激酶(phosphatidyal inositol 3 kinase,PI3K)发生去磷酸化,从而传递抑制性信号,发挥负性调节作用[2-4]。近年来,以PD-1及其配体为靶点的免疫治疗显示出了较好的疗效,给晚期肺癌的治疗带来了新的希望[5]。本研究拟通过免疫组织化学(IHC)方法检测PD-1、PD-L1在喉癌及声带息肉组织中的表达情况,并分析两种蛋白与喉癌患者临床病理特征的关系,以期探讨喉癌发生、发展的可能机制,为进一步认识肿瘤免疫机制和肿瘤的免疫治疗提供理论基础。
1 资料与方法
1.1一般资料 收集本院耳鼻咽喉头颈外科行手术治疗并病理证实的初治喉癌患者手术切除组织标本45份(喉癌组),所有病例术前均未接受放疗及化疗,另选同期收治的声带息肉组织37份作为对照(息肉组)。所有标本均经4%多聚甲醛固定,自动脱水机脱水,石蜡包埋,以4 μm厚度组织切片,备用。
1.2方法
1.2.1实验方法 主要实验试剂:PD-1兔抗人单克隆抗体ab137132、PD-L1兔抗人单克隆抗体ab205921购自英国ABCAM公司。喉癌及声带息肉组织中PD1、PD-L1蛋白免疫组织化学染色:喉癌组织石蜡切片60 ℃干烤4 h后,常规脱蜡至水,3%过氧化氢浸泡10 min灭活内源性过氧化物酶,然后加入10 mmol/L pH 6.0枸橼酸钠缓冲液100 ℃煮沸10 min,进行抗原修复。室温自然冷却30 min后加入正常马血清室温下封闭20 min,加入一抗兔抗人PD-1、PD-L1单克隆抗体,按1∶100稀释,4 ℃过夜,PBS洗3次后加入生物素化二抗室温30 min,PBS洗3次后加入辣根过氧化物酶标记的链酶亲和素室温下30 min,PBS洗3次,DAB显色,苏木精复染,脱水透明,中性树胶封片后光镜下观察。声带息肉组织石蜡切片处理方法与喉癌组织相同。
1.2.2结果判定 PD-1和PD-L1在组织中阳性显色评定标准为在细胞膜或细胞质中出现淡黄色至棕褐色颗粒。最终判定PD-1和PD-L1表达结果需结合组织切片的染色强度和阳性细胞百分比来评定阳性表达。染色强度评分如下[2]:细胞膜或细胞质出现淡黄色颗粒为弱染色记1分,出现棕黄色颗粒为中等染色记2分,出现棕褐色颗粒为强染色记3分。随机选择5个高倍视野,每个视野100个肿瘤细胞或间质细胞中PD-1或PD-L1阳性显色强度大于或等于2分的、细胞数目大于或等于5%时,或者阳性显色强度与阳性细胞数目二者相乘结果大于或等于10%时,则判定为该组织切片PD-1或PD-L1阳性表达。
1.3统计学处理 采用SPSS17.0统计软件进行分析,PD-1与PD-L1二者之间表达相关性比较及其与临床病理特征关系分析采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1两组组织中PD-1的表达比较 喉癌组中PD-1的阳性率为57.78%(26/45),光镜下可见肿瘤细胞或肿瘤间质细胞的细胞膜或细胞质出现淡黄色至棕褐色颗粒;肿瘤细胞阳性率为37.78%(17/45),间质细胞阳性率为51.11%(23/45)。息肉组中PD-1阳性率为8.11%(3/37)。PD-1在喉癌组中阳性率明显高于息肉组(χ2=19.80,P<0.01),见图1。
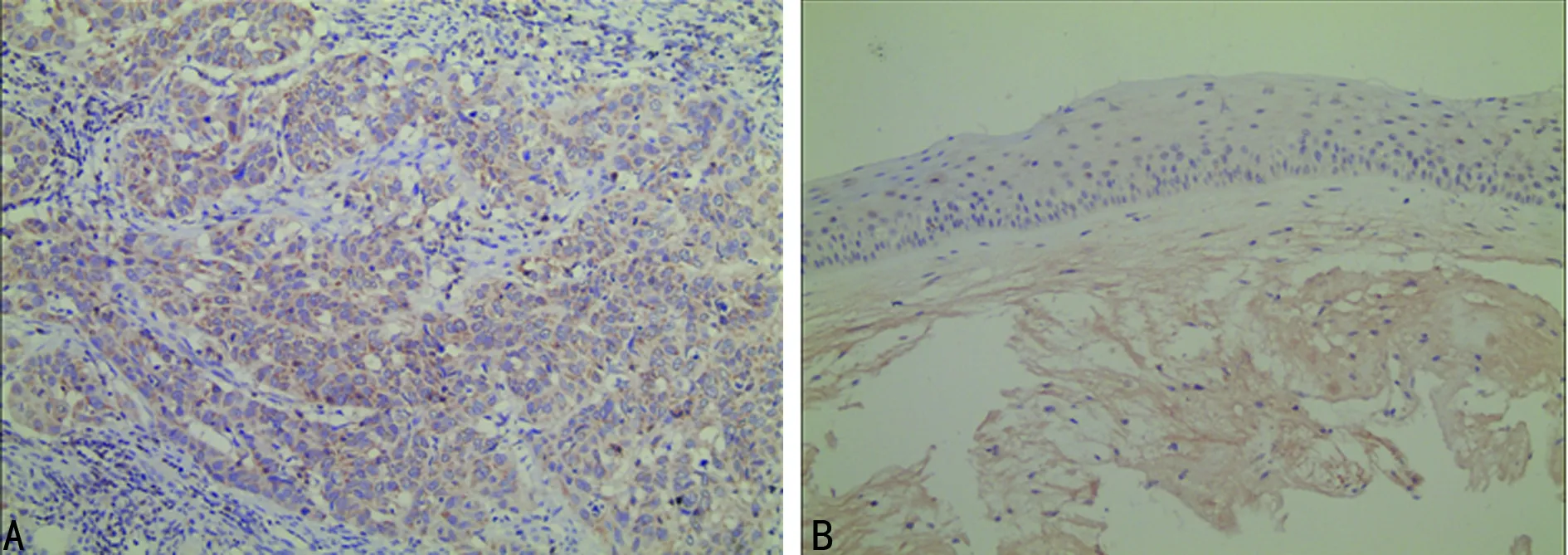
A:喉癌组织;B:声带息肉组织
图1 PD-1在两组组织中表达(IHC×200)
2.2两组组织中PD-L1的表达比较 喉癌组PD-L1的阳性率为66.67%(30/45),光镜下可见肿瘤细胞或间质细胞的细胞膜或细胞质出现淡黄色至棕褐色颗粒;肿瘤细胞阳性率为48.89%(22/45),间质细胞阳性率为42.22%(19/45)。息肉组中PD-L1阳性率为13.51%(5/37)。PD-L1在喉癌组中阳性率明显高于息肉组(χ2=21.33,P<0.01)。
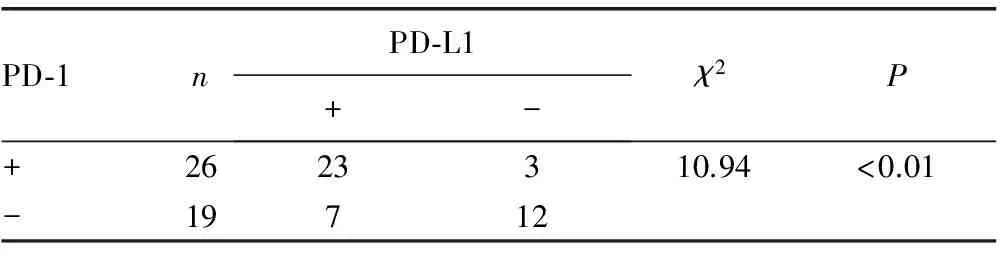
表1 喉癌组织中PD-1与PD-L1表达的相关性
2.3PD-1、PD-L1在喉癌组织中表达的相关性 45份喉癌组织有26例被判定为PD-1阳性表达,30例被判定为PD-L1阳性表达,26例PD-1阳性表达的喉癌组织有23例PD-L1为阳性表达,3例阴性表达,19例PD-1阴性表达的喉癌组织有7例PD-L1为阳性表达,12例阴性表达。PD-1、PD-L1在喉癌组织的阳性表达呈正相关(P<0.01),见表1。
2.4PD-1及PD-L1在喉癌组织中的表达与临床病理特征的相关性 PD-1、PD-L1在喉癌组织中的表达与临床分期和分化程度密切相关(P<0.05),但与患者年龄、性别、发生部位无关(P>0.05),见表2。
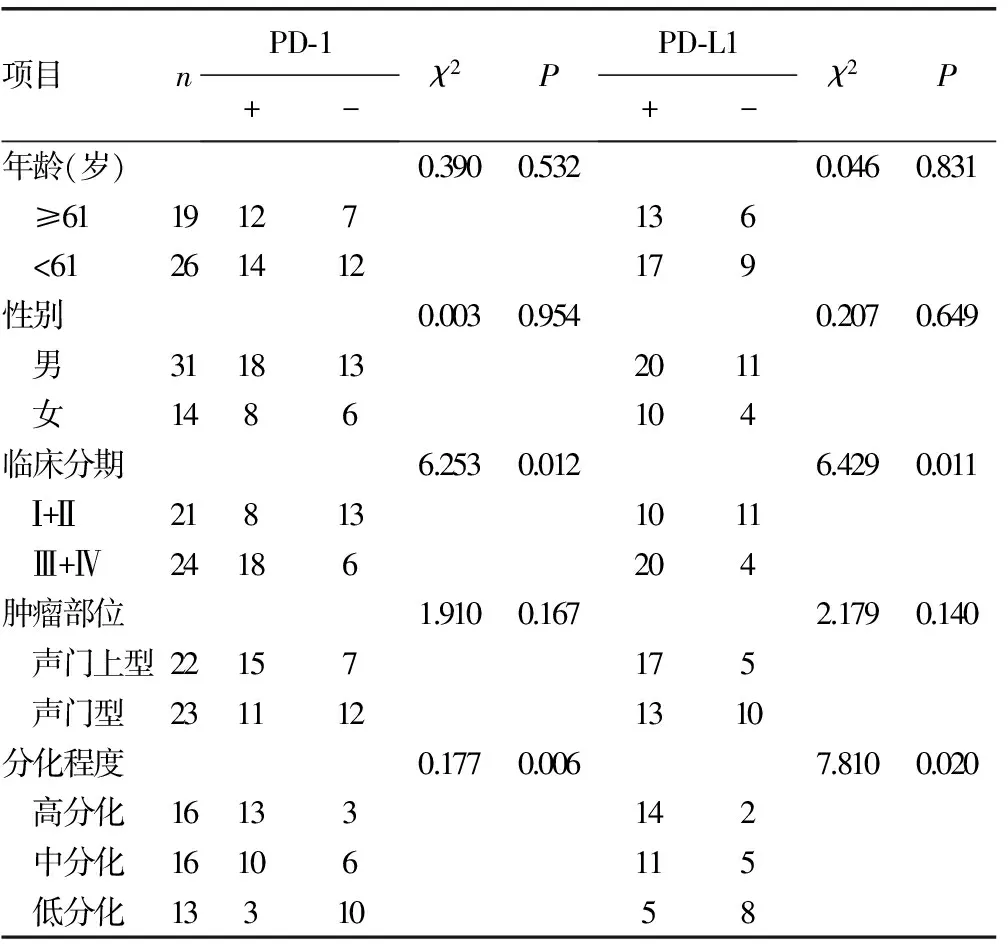
表2 喉癌组织中PD-1及PD-L1表达与临床病理特征的关系(n)
3 讨 论
PD-1具有抑制机体免疫系统的功能,属于Ⅰ型跨膜蛋白。PD-1有两种结合配体,分别为PD-L1和PD-L2。PD-L2主要表达在活化的树突状细胞、巨噬细胞上,其表达较为局限。PD-L1可以在活化的T淋巴细胞、B淋巴细胞及其他免疫细胞表面广泛表达,因此PD-L1在体内的作用要远远超过PD-L2[6]。研究发现,γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-4、IL-10和粒细胞刺激因子等多种细胞因子可以上调PD-L1的表达[7]。目前已有研究发现PD-1、PD-L1在胃癌、乳腺癌、肾细胞癌、肝癌、口腔鳞癌等肿瘤中表达率明显增高,部分与TNM分期及预后密切相关[8-11]。肿瘤微环境中PD-L1与PD-1结合后抑制机体的免疫反应,从而肿瘤细胞和其他细胞可以维持PD-L1在机体内较高水平的表达。PD-L1也可以作为保护肿瘤细胞的分子,可以避免肿瘤细胞被细胞毒性T淋巴细胞分解、破坏[12]。在肿瘤微环境中可能采用上调PD-L1在肿瘤细胞中的表达作为一种抑制宿主的免疫反应的方式,由此来逃脱免疫系统对肿瘤细胞的攻击。PD-1与癌症的预后关系并无明确的实验证实,但是,值得注意的是KIM等[13]发现PD-1在肺癌的肿瘤浸润性淋巴细胞的阳性表达率明显增高,且PD-1的表达与预后有关。已有相关文献证实PD-L1在乳腺癌、胃癌的表达与患者的预后不良密切相关[14-15]。
本实验研究发现喉癌组PD-1、PD-L1表达均高于息肉组,差异有统计学意义(P<0.01)。因此,可以考虑检测PD-1、PD-L1的表达,这将对于诊断喉癌具有辅助作用。本实验研究发现PD-1表达的肿瘤细胞及淋巴细胞区域PD-L1也多同样高表达,因此PD-1在喉癌组织中表达情况与PD-L1表达情况密切相关。通过对比喉癌的临床病理特征及PD-1、PD-L1在喉癌组织中的表达情况,发现PD-1、PD-L1在喉癌中的表达情况与喉癌的临床分期与组织分化程度密切相关。Ⅲ、Ⅳ期喉癌组织PD-1、PD-L1的阳性表达率明显高于Ⅰ、Ⅱ期(P<0.05),由此可以考虑随着肿瘤临床分期增高PD-1、PD-L1的阳性表达率也明显增高,这与文献报道基本相符[4,15]。高、中、低分化喉癌组织PD-1、PD-L1的阳性表达率有逐渐降低的趋势,且三者间比较差异有统计学意义(P<0.05),表明肿瘤的分化程度与PD-1、PD-L1的表达密切相关。
综上所述,PD-1与PD-L1可能在喉癌的发生、发展过程中发挥重要作用,两种蛋白表达与喉癌的临床分期及分化程度密切相关。有关PD-1/PD-L1分子通路在喉癌中的作用有待进一步研究。
[1]YANG W,SONG Y,LU Y L,et al.Increased expression of programmed death(PD)-1 and its ligand PD-L1 correlates with impaired cell-mediated immunity in high-risk human papillomavirus-related cervical intraepithelial neoplasia[J].Immunology,2013,139(4):513-522.
[2]RUSAK M,ELJASZEWICZ A,BOLKUN L,et al.Prognostic significance of PD-1 expression on peripheral blood CD4+T cells in patients with newly diagnosed chronic lymphocytic leukemia[J].Pol Arch Med Wewn,2015,125(7/8):553-559.
[3]ZHANG L,DU H,XIAO T W,et al.Prognostic value of PD-1 and TIM-3 on CD3+T cells from diffuse large B-cell lymphoma[J].Biomed Pharmacother,2015,75(10):83-87.
[4]TAMURA T,OHIRA M,TANAKA H,et al.Programmed death-1 ligand-1(PDL1) expression is associated with the prognosis of patients with stage Ⅱ/Ⅲ gastric cancer[J].Anticancer Res,2015,35(10):5369-5376.
[5]ANAGNOSTOU V K,BRAHMER J R.Cancer immunotherapy:a future paradigm shift in the treatment of non-small cell lung cancer[J].Clin Cancer Res,2015,21(5):976-984.
[6]TAUBE J M,KLEIN A,BRAHMER J R,et al.Association of PD-1,PD-1 ligands,and other features of the tumor immune microenvironment with response to anti-PD-1 therapy[J].Clin Cancer Res,2014,20(19):5064-5074.
[7]ACHLEITNER A,CLARK M E,BIENZLE D.T-regulatory cells infected with feline immunodeficiency virus up-regulate programmed death-1(PD-1)[J].Vet Immunol Immunopathol,2011,143(3/4):307-313.
[8]MUENST S,SOYSAL S D,GAO F,et al.The presence of programmed death 1(PD-1)-positive tumor-infiltrating lymphocytes is associated with poor prognosis in human breast cancer[J].Breast Cancer Res Treat,2013,139(3):667-676.
[9]SHIN S J,JEON Y K,CHO Y M,et al.The association between PD-L1 expression and the clinical outcomes to vascular endothelial growth factor-targeted therapy in patients with metastatic clear cell renal cell carcinoma[J].Oncologist,2015,20(11):1253-1260.
[10] MALASPINA T S,GASPAROTO T H,COSTA M R,et al.Enhanced programmed death 1(PD-1) and PD-1 ligand(PD-L1) expression in patients with actinic cheilitis and oral squamous cell carcinoma[J].Cancer Immunol Immunother,2011,60(7):965-974.
[11]BAYRAM S,AKKIZ H,ÜLGER Y,et al.Lack of an association of programmed cell death-1 PD1.3 polymorphism with risk of hepatocellular carcinoma susceptibility in Turkish population:a case-control study[J].Gene,2012,511(2):308-313.
[12]CHEN L,HAN X.Anti-PD-1/PD-L1 therapy of human cancer:past,present,and future[J].J Clin Invest,2015,125(9):3384-3391.
[13]KIM M Y,KOH J,KIM S,et al.Clinicopathological analysis of PD-L1 and PD-L2 expression in pulmonary squamous cell carcinoma:Comparison with tumor-infiltrating T cells and the status of oncogenic drivers[J].Lung Cancer,2015,88(1):24-33.
[14]MUENST S,SCHAERLI A R,GAO F,et al.Expression of programmed death ligand 1(PD-L1) is associated with poor prognosis in human breast cancer[J].Breast Cancer Res Treat,2014,146(1):15-24.
[15]QING Y,LI Q,REN T,et al.Upregulation of PD-L1 and APE1 is associated with tumorigenesis and poor prognosis of gastric cancer[J].Drug Des Dev Ther,2015,9(9):901-909.

