神经内镜辅助显微手术治疗囊性脑肿瘤的疗效分析
张百平,孙树凯,贾 栋
第四军医大学唐都医院 神经外科(西安 710038)
囊性脑肿瘤是临床上较少见的一种颅内囊性肿瘤病变,多发于胶质瘤、囊性脑膜瘤、转移瘤和血管细胞瘤等[1]。由于囊性脑肿瘤在影像学显影时特异度低,因此诊断较困难,如何提高诊断水平及治疗效果成了治疗该疾病的关键。常规显微神经外科手术是临床上治疗囊性脑肿瘤的主要方式,然而随着治疗理念的不断更新以及医疗技术的不断发展,神经内镜作为辅助显微神经外科治疗颅内病变的主要微创技术已开始应用于囊性脑肿瘤的治疗,具有微创、可视范围广、照明好等优势,可在内镜下对肿瘤结节进行切除[2]。本研究主要就神经内镜辅助显微手术治疗囊性脑肿瘤的疗效进行分析,旨在为此类临床手术方案的制定提供理论参考和实践依据。
1 资料与方法
1.1 临床资料
选择2013年1月至2016年5月在解放军第四军医大学唐都医院接受治疗的囊性肿瘤患者106例作为研究对象,所有患者均经过CT、MRI检查并经手术及病理证实为囊性脑肿瘤。囊性脑肿瘤患者行增强CT检查示肿瘤包膜全部或部分环形强化。肿瘤内部钙化或含有黏稠液体的患者在增强CT扫描时示肿瘤呈等密度、 略高密度或混杂密度影。MRI检查囊性脑肿瘤T1WI 以圆形均匀低信号影较多见,T2WI以较高信号影多见, 部分特殊肿瘤则以等高混杂信号影为特殊表现。采用随机数字表法将入组患者随机分为对照组与试验组,每组53例。其中试验组中男31例,女22例,年龄(38.4±11.7)岁(7~72岁),病程(2.8±1.1)年(0.5~6年),其中囊性脑膜瘤13例,囊性脑胶质瘤23例,囊性脑转移瘤8例,囊性室管膜瘤5例,血管网织细胞瘤4例;肿瘤主体所在部位:侧脑室6例,CPA区6例,鞍区3例,小脑半球11例,大脑实质内27例;幕上41例,幕下12例。对照组中男33例,女20例,年龄(39.8±12.1)岁(6~73岁),病程(3.0±1.4)年(0.5~5年),其中囊性脑膜瘤15例,囊性脑胶质瘤21例,囊性脑转移瘤9例,囊性室管膜瘤3例,血管网织细胞瘤5例;肿瘤主体所在部位:侧脑室7例,CPA区5例,鞍区4例,小脑半球10例,大脑实质内27例;幕上43例,幕下10例。两组患者年龄、性别、病程、囊性肿瘤类型、肿瘤主体所在部位等一般资料比较差异无统计学意义(P>0.05)(表1)。

表1 患者一般情况(n=53)
注:a为2检验;b为独立样本t检验;c为秩和检验
1.2 治疗方法
对照组患者接受显微镜下肿瘤切除手术,试验组患者接受神经内镜辅助显微手术。手术前根据患者的影像学检查结果和具体情况合理选择手术入路。对患者进行全身麻醉后行骨瓣开颅,若肿瘤范围较广则选择联合入路;若为鞍区肿瘤选择翼点入路;若为小脑肿瘤则选择后颅凹正中切口。手术医生在显微镜下降将囊液吸除,置入神经内镜,在神经内镜的帮助下观察肿瘤和肿瘤周围的情况,同时在显微镜下对肿瘤内部进行电凝,将肿瘤包膜和肿瘤结节分离,注意动作轻柔,观察仔细。当肿瘤周围的空间足够大时,将内镜再次置入其中,全面观察并了解肿瘤周围的解剖关系后在显微镜下对其进行切除,注意在切除过程中要保护好周围的血管、神经等重要组织,切除后借助神经内镜观察是否有肿瘤残留,若有则通过神经内镜将肿瘤包膜分离并切除,直至将观察到的肿瘤完全切除。切除肿瘤后使用温生理盐水将瘤床进行反复冲洗,直至无任何瘤内容物残留。之后将硬脑膜严密缝合,骨瓣还纳后将头皮逐层缝合。手术后观察两组患者手术切除情况,比较两组患者格拉斯哥评分差异以及并发症发生情况。随访0.5~5.0年,观察两组患者肿瘤复发率和病死率。
1.3 统计学方法
本研究所有数据采用SPSS 20.0统计软件分析,定性数据比较采用2检验,检验水准α设为0.05。
2 结果
2.1 两组患者手术及术后情况比较
试验组患者肿瘤全切率高于对照组,差异有统计学意义(88.7% vs 66.0%,P<0.05);两组患者神经功能损害、肿瘤复发、病死率比较差异无统计学意义(P>0.05)(表2)。
2.2 两组患者术后格拉斯哥评分情况比较
两组患者术后格拉斯哥评分情况比较,试验组低于对照组,差异有统计学意义(P<0.05)(表3)。
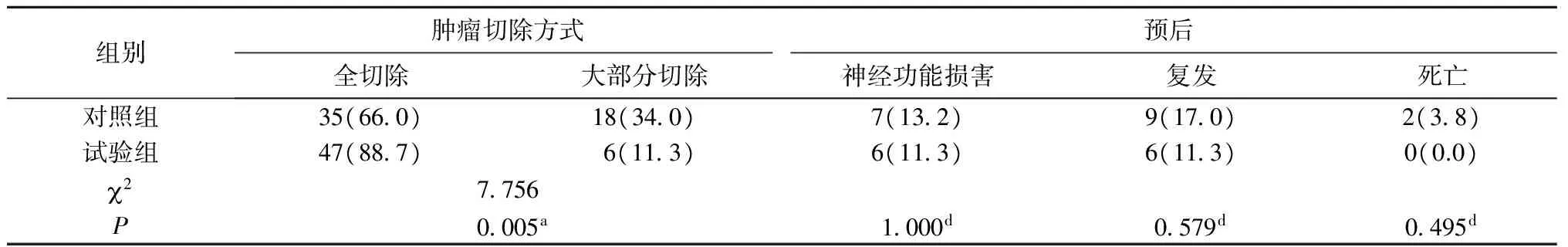
表2 两组患者手术及术后情况比较[n(%),n=53]
注:a为2检验;d为确切概率法

表3 两组患者术后格拉斯哥评分情况比较[n(%),n=53]
3 讨论
颅内囊性肿瘤病变在临床上较少见,而有关病变形成的原因尚不十分清楚。囊性脑肿瘤可见于胶质瘤、囊性脑膜瘤、转移瘤和血管细胞瘤等多种不同类型的肿瘤,其中胶质瘤是常见的颅内恶性肿瘤,其囊变的发生原因可能为: 1)肿瘤细胞本身分泌作用形成囊性脑肿瘤,或由瘤细胞分泌性质改变以及小囊变性融合等因素造成;2)肿瘤内部出现小动脉破溃出血,或微血管病变和坏死,或组织急性坏死导致肿瘤坏死,而肿瘤坏死融合成囊,之后在囊内发生液化,成为囊液进而形成囊性肿瘤[3-4]。
囊性脑肿瘤在影像学的诊断方面具有一定难度,主要是囊性血管母细胞瘤、囊性星形细胞瘤、囊性室管膜瘤、囊性脑转移瘤之间的鉴别诊断较困难[5]。因此,在诊断时需要通过患者影像学检查结果中的大小、血供、钙化、密度或信号强度、肿瘤周围强度以及患者年龄等综合情况进行判断。在治疗方面,临床主要采用手术切除囊性脑肿瘤的方式,其目标在于最大限度地切除肿瘤,同时保护周围神经和血管不受损伤。传统的手术方式主要是单纯的显微镜外科手术,其操作时存在较大的手术视野死角,导致手术全切率较低,有较多肿瘤残留[6-8]。神经内镜辅助显微手术方式能够同时发挥二者的优势,弥补单个方式的缺点,具有照明好、手术视野广泛且清晰、微创等特点,可明显提高肿瘤的全切率。本研究把106例囊性肿瘤患者分为试验组和对照组进行观察,结果显示试验组肿瘤全切率高于对照组,差异有统计学意义(88.7% vs 66.0%,P<0.05);两组患者在神经功能损害、肿瘤复发、病死率比较差异无统计学意义(P>0.05);试验组患者术后格拉斯哥评分低于对照组,差异有统计学意义(P<0.05),说明采用神经内镜辅助治疗能有效提高手术治疗效果。究其原因主要为,神经内镜可显示出显微镜的盲区,术者视野更清楚,可减少手术过程中对患者脑组织的牵拉,减少操作过程中引起的损伤;可减小颅骨手术窗口,降低手术损伤;可有效缩短手术时间,从而提高手术治疗效果。
综上所述,神经内镜辅助显微手术治疗囊性脑肿瘤可弥补单纯显微镜手术和神经内镜手术的不足,避免单纯显微外科手术中因视角观察不全造成全切困难,从而残留肿瘤的缺点,明显提高手术治疗效果,值得临床推广应用。
[1]王彪. 神经内镜辅助显微手术治疗囊性脑肿瘤的疗效观察[J]. 中国实用医药, 2015, 10(31): 57-58.
[2]岑茂良, 宁立金, 杨永海, 等. 16例囊性脑肿瘤的临床诊断及显微手术治疗的效果评价[J]. 吉林医学, 2014, 35(6): 1228.
[3]黄常坚, 黄玮. 85例中枢神经系统血管母细胞瘤的手术治疗[J]. 中国临床神经外科杂志, 2016, 21(11): 694-696.
[4]练伙林. 神经内镜辅助显微手术治疗囊性脑肿瘤的临床疗效分析[J]. 数理医药学杂志, 2016, 29(1): 47-48.
[5]蒋霖, 高广忠, 刘泽昊, 等. 神经内镜辅助下显微手术治疗颅内前交通动脉动脉瘤33例分析[J]. 江苏医药, 2015, 41(9): 1044-1046.
[6]Kim M, Cheok S, Chung L K,etal. Characteristics and Treatments of Large Cystic Brain Metastasis: Radiosurgery and Stereotactic Aspiration[J]. Brain Tumor Res Treat, 2015, 3(1): 1-7.
[7]吴先良, 黄俏, 姜洪, 等. 显微手术联合神经内镜治疗囊性脑肿瘤的临床疗效分析[J]. 疑难病杂志, 2017, 16(2): 137-140.
[8]周庆九, 付强, 更·党木仁加甫, 等. 神经内镜辅助切除岩斜区脑膜瘤[J]. 中外医学研究, 2013, 11(16): 30.

