我国川东北地区男性原发性痛风患者中不同原因高尿酸血症者危险因素及临床特点分析*
朱 丹,青玉凤Δ,李 青,易 婷,王 霞,彭春梅,何泳龙,张全波,周京国
1.川北医学院附属医院 风湿免疫科(南充 637000);2.川北医学院附属医院 老年科(南充 637000);3.成都医学院(成都 610500)
尿酸是人类嘌呤代谢的终产物,主要由细胞代谢分解核酸和其他嘌呤化合物及食物中的嘌呤经酶分解而来,大部分经肾脏排泄。人体的尿酸主要有两个来源:由体内合成或核酸分解代谢产生的尿酸约占80%;由含嘌呤或核蛋白的食物分解而来的约占20%。嘌呤的代谢受5-磷酸核糖焦磷酸(PRPP)及次黄嘌呤核苷酸(GMP)、腺嘌呤核苷酸(AMP)和次黄嘌呤核苷酸(IMP)对酶的负反馈抑制的调节。PRPP合成酶、次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HGPRT)、磷酸核糖焦磷酸酰胺转移酶(PRPPAT)、黄嘌呤氧化酶(XO)为尿酸生成重要的酶,其中PRPPAT为限速反应酶。正常人体每日产生尿酸约600 mg,70%尿酸经肾脏排泄,30%经胆道和肠道排泄[1]。高尿酸血症的形成主要与尿酸排泄减少和生成增多相关[2]。80%~90%高尿酸血症具有尿酸排泄障碍,以肾小管分泌减少为主[3-5]。近年研究[6-9]表明,高尿酸血症与代谢综合征如肥胖、血脂异常、高血压和胰岛素抵抗等相关,且高尿酸血症可能是代谢综合征、心脑血管疾病及慢性肾病的独立危险因素[10]。但关于不同原因所致高尿酸血症患者发病危险因素及临床特点差异鲜有文献报道。因此,本研究对川东北地区580例男性原发性痛风患者因不同原因导致的高尿酸血症发病危险因素及临床特点进行了调查分析,旨在为痛风的诊治提供理论依据。
1 资料与方法
1.1 临床资料
选取2015年1月至2017年4月在川北医学院附属医院风湿免疫科门诊就诊,行24 h尿尿酸检测的580例男性原发性痛风患者为研究对象,年龄12~84(45.9±15.2)岁。纳入标准:均符合1977年美国风湿学会制定的痛风诊断标准[11]。排除标准:由骨髓增殖性疾病、放疗、肾脏原发疾病和药物等所致继发性痛风。符合纳入标准的580例男性原发性痛风患者均排尿1 500~2 500 mL/d,禁食高嘌呤饮食5 d后检测24 h尿尿酸。将24 h尿尿酸≤3.57 mmol/24 h视为尿酸排泄障碍,24 h尿尿酸>3.57 mmol/24 h视为尿酸生成增多[12]。本研究得到川北医学院附属医院伦理委员会批准,受检者均知情同意。
1.2 方法
1.2.1 资料采集 统一收集580例痛风患者的病史和其临床资料,包括年龄、身高、体质量、病程、发病诱因、吸烟和饮酒情况,并询问其是否合并高血压、糖尿病,有无痛风石及痛风家族史情况等。BMI指数为体质量(kg)/身高(m2)。
1.2.2 生化指标检测 采用LH750血细胞分析仪(美国Beckman公司)、DxC800全自动生化分析仪(美国Beckman公司)检测患者血细胞计数、血尿酸(sUA)、C反应蛋白(CRP)、血红蛋白(HGB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、球蛋白(GLOB)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDLC)、低密度脂蛋白(LDLC)、极低密度脂蛋白(VDLC)、尿素氮(Urea)和肌酐(Crea)等。
1.2.3 B超检查结果 收集患者全腹部B超检查结果,明确患者患脂肪肝与肾结石情况。
1.3 统计学方法
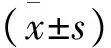
2 结果
2.1 患者临床特点
纳入研究的580例男性原发性痛风患者:404例24 h尿尿酸≤3.57 mmol/24 h(排泄障碍组);176例24 h尿尿酸>3.57 mmol/24 h(生成增多组)。结果显示,男性原发性痛风患者仍以尿酸排泄障碍为主。排泄障碍组发病年龄较生成增多组大,差异有统计学意义(P<0.001);生成增多组BMI指数较排泄障碍组高,差异有统计学意义(P<0.001);排泄障碍组病程较生成增多组长,差异有统计学意义(P<0.05)。
将580例男性原发性痛风患者中367例收集有急性痛风发作诱因、是否吸烟、饮酒以及是否合并痛风石以上临床资料进行统计分析,结果显示,生成增多组有急性痛风关节炎发作诱因(发病前进食高脂、海鲜)比例较排泄障碍组高,差异有统计学意义(P<0.05)。生成增多组吸烟比例较排泄障碍组高,但差异无统计学意义(P>0.05)。生成增多组饮酒比例较排泄障碍组高,差异有统计学意义(P<0.05)。排泄障碍组患者患痛风石比例较生成增多组高,但差异无统计学意义(P>0.05)(表1)。

表1 尿酸排泄障碍组及生成增多组临床特点比较
2.2 两组实验室检查指标比较
生成增多组HGB、ALT、ALB水平较排泄障碍组高,差异有统计学意义(P<0.05)。排泄障碍组GLOB、HDLC、Crea水平较生成增多组高,差异有统计学意义(P<0.05),两组sUA、白细胞计数(WBC)、中性粒细胞计数(GR)、淋巴细胞计数(LY)、单核细胞计数(MO)、AST、TC、TG、LDLC、VDLC、Urea指标比较,差异无统计学意义(P>0.05)。行全腹部B超患者总计191例,排泄障碍组123例,其中脂肪肝患者60例,肾结石患者38例;生成增多组68例,其中脂肪肝患者38例,肾结石患者14例。两组患者脂肪肝及肾结石患病比例比较,差异无统计学意义(P>0.05)(表2)。
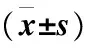
表2 两组实验室检查指标比较
2.3 24 h尿尿酸排泄量与实验室检查指标相关性分析
将580例痛风患者24 h尿尿酸与其实验室检查指标作Spearman分析,结果显示,24 h尿尿酸排泄量与ALT、ALB呈正相关,与GLOB、Urea、Crea呈负相关。本研究中24 h尿尿酸与sUA、C反应蛋白(CRP)、WBC、GR、MO、LY、AST、TC、TG、HDLC、LDLC、VDLC无相关性(表3)。
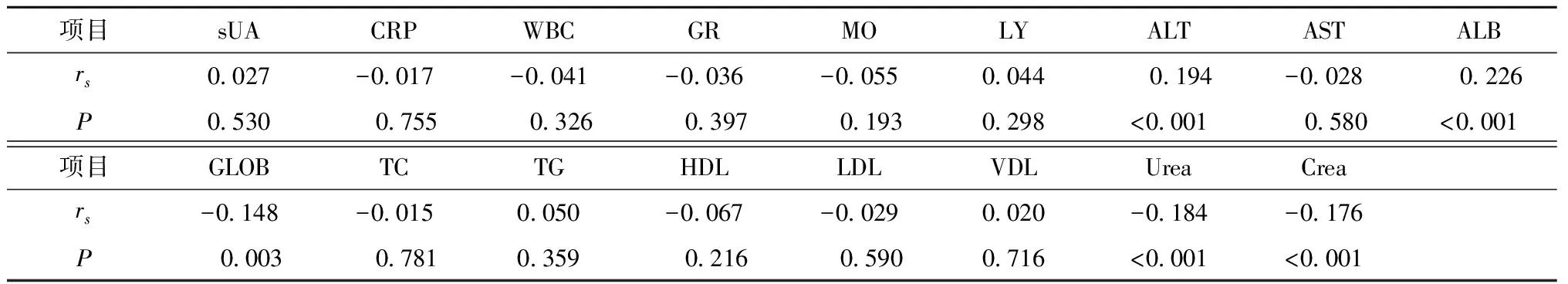
表3 高尿酸血症患者24 h尿尿酸浓度与各实验室检查指标相关性分析
2.4 引起高尿酸血症不同发病原因相关因素分析
将不同原因高尿酸血症发病(1:尿酸排泄障碍;0:尿酸生成增多)设定作为因变量,将年龄、BMI指数、病程、是否合并痛风石、高血压和吸烟等6个项目作为自变量引入logistic回归模型,分析高尿酸血症不同发病原因(尿酸排泄障碍及尿酸生成增多)的危险因素。结果表明,年龄、BMI指数均与尿酸排泄障碍及生成增多相关(表4)。

表4 高尿酸血症发病原因的危险因素logistic分析结果
3 讨 论
痛风的发病基础是高尿酸血症,高尿酸血症的形成机制主要为尿酸排泄障碍与尿酸生成增多。本研究以川东北地区男性原发性痛风患者为研究对象,对不同原因引起的高尿酸血症者进行分析,探讨临床由以上两种原因引起的高尿酸血症患者的临床特点。本研究提示,我国川东北地区男性原发性高尿酸血症发病原因中,因尿酸生成增多引起高尿酸血症因素比例高于全国水平。尿酸排泄障碍导致的高尿酸血症患者年龄偏大,病程较长,肌酐水平较尿酸生成增多导致的高尿酸血症患者高。高尿酸血症可能导致肾脏慢性损害从而引起尿酸排泄功能受损,进一步加剧高尿酸血症的发生,血Crea水平可能作为尿酸排泄障碍风险评估指标。Toprak等[13]研究发现,在266例高尿酸血症中,肾病发生率为15.11%,而正常人群肾病发生率仅为2.19%。高尿酸血症患者可能通过尿酸盐结晶损害、Rass系统激活、尿酸盐晶体刺激组织发生炎症反应等机制引起肾脏损害[14]。本研究发现,尿酸生成增多引起高尿酸血症患者中,BMI指数偏大、肝功能受损、HDLC水平降低,提示尿酸生成增多引起的高尿酸血症可能与代谢综合征相关。本研究还发现,sUA浓度与血Crea、LDLC及VDLC水平呈正相关,相关研究[15]发现,在嘌呤代谢过程中,尿酸的生成可以产生大量自由基,促进LDLC的氧化和脂质的过氧化,导致脂代谢紊乱。在对不同原因导致的高尿酸血症危险因素分析时发现,BMI指数、病程、痛风石形成和高血压为尿酸排泄障碍及生成增多的危险因素。
综上所述,痛风的发病与生活、饮食习惯密切相关,且早期控制高尿酸血症可减少痛风并发症的发生,减少机体远期损害。故作为临床医生,应对患者进行健康教育,包括合理饮食、改善生活方式和积极锻炼减轻体质量等内容。同时,积极控制患者高尿酸血症,阻止高尿酸血症对患者造成的多系统损害,延缓病情进展。
[1]Cameron M A, Sakhaee K. Uric acid nephrolithiasis[J]. Urol Clin North Am, 2007, 34(3): 335-346.
[2]de Oliveira E P, Burini R C. High plasma uric acid concentration: causes and consequences[J]. Diabetol Metab Syndr, 2012, 4: 12.
[3]Anzai N, Enomoto A, Endou H. Renal urate handling: clinical relevance of recent advances[J]. Curr Rheumatol Rep, 2005, 7(3): 227-234.
[4]Hediger M A, Johnson R J, Miyazaki H,etal. Molecular physiology of urate transport[J]. Physiology (Bethesda), 2005, 20: 125-133.
[5]Levinson D J, Sorensen L B. Renal handling of uric acid in normal and gouty subject: evidence for a 4-component system[J]. Ann Rheum Dis, 1980, 39(2): 173-179.
[6]Weiner I M. Urate transport in the nephron[J]. Am J Physiol, 1979, 237(2): F85-F92.
[7]Ye Y, Bao Y, Hou X,etal. Identification of waist circumference cutoffs for abdominal obesity in the Chinese population: a 7.8-year follow-up study in the Shanghai urban area[J]. Int J Obes (Lond), 2009, 33(9): 1058-1062.
[8]Fox C S, Massaro J M, Hoffmann U,etal. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham Heart Study[J]. Circulation, 2007, 116(1): 39-48.
[9]Liu J, Fox C S, Hickson D A,etal. Impact of abdominal visceral and subcutaneous adipose tissue on cardiometabolic risk factors: the Jackson Heart Study[J]. J Clin Endocrinol Metab, 2010, 95(12): 5419-5426.
[10] Mlinar B, Marc J, Janez A,etal. Molecular mechanisms of insulin resistance and associated diseases[J]. Clin Chim Acta, 2007, 375(1/2): 20-35.
[11] Wallace S L, Robinson H, Masi A T,etal. Preliminary criteria for the classification of the acute arthritis of primary gout[J]. Arthritis Rheum, 1977, 20(3): 895-900.
[12] 葛均波, 徐永健, 梅长林,等. 内科学[M]. 第8版.北京:人民卫生出版社,2013: 856-857.
[13] Toprak O, Cirit M, Esi E,etal. Hyperuricemia as a risk factor for contrast-induced nephropathy in patients with chronic kidney disease[J]. Catheter Cardiovasc Interv, 2006, 67(2): 227-235.
[14] 黄胜华. 高尿酸血症及其肾损伤的研究进展[J]. 医学研究生学报, 2010, 23(11): 1217-1221.
[15] Sautin Y Y, Nakagawa T, Zharikov S,etal. Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress[J]. Am J Physiol, Cell Physiol, 2007, 293(2): C584-C596.

