闭合性肾损伤早期肾脏组织中转化生长因子β1的表达及意义
杨 琦,王养民,常德辉,张 斌,康菲斐
(解放军兰州总医院,甘肃 兰州 730050)
肾损伤多见于男性青壮年,在所有外伤中占1%~5%,在腹部损伤中占8%~10%,在泌尿系损伤中最为常见[1],其中以闭合性肾损伤多见,常伴有其他脏器合并伤,严重者可威胁患者生命。肾损伤经保守或微创介入治疗后,部分血管再通,但存在缺血再灌注后损伤,是创伤领域亟待解决和研究的课题。肾脏组织中细胞因子的表达及相关治疗药物的研究日益受到人们的关注。转化生长因子β1(TGF-β1)可通过细胞表面复杂的信号转导途径发挥多种生物学功能,在创伤愈合、胚胎发育、细胞外基质(ECM)形成、骨改建、免疫调节、神经系统的发育、器官纤维化以及肿瘤的发生、发展等过程中发挥重要作用[2]。本研究观察了闭合性肾损伤新西兰兔肾脏组织的组织学表现及肾脏组织中TGF-β1的表达情况,旨在探讨肾脏组织中TGF-β1表达情况与早期闭合性肾损伤的关系,为闭合性肾损伤的治疗提供新的理论依据。
1 实验资料
1.1 实验动物 健康新西兰兔36只,雌雄不限,兔龄12~16周,体质量1.81~2.60(2.11±0.24)kg,由我院动物实验科提供。将36只新西兰兔随机分为正常组4只和创伤组32只,创伤组再根据不同撞击高度(30 cm、40 cm、50 cm、60 cm)随机分为4个亚组,每组8只。
1.2 试剂 免疫组织化学试剂购自武汉博士德生物工程有限公司。BA0290即用型Rabbit anti-TGF-β16 mL;SA1022即用型SABC免疫组化染色试剂盒:5%BSA封闭液12 mL,山羊抗兔IgG亲和纯化抗体12 mL,SABC 12 mL;AR1022 DAB显色试剂盒:显色剂A(DAB×20倍浓缩液)3 mL,显色剂B(H2O2×20倍浓缩液)3 mL,显色剂C(TBS缓冲液×20倍浓缩液)3 mL。
1.3 仪器与设备 小型生物撞击器,参照BIM-Ⅳ型生物撞击机[3](第三军医大学大坪医院野战外科研究所研制)自制,主要由200 g砝码、联塑管、支撑架及动物实验台等组成。
1.4 实验方法
1.4.1 动物模型建立 创伤组32只进行造模,用3%戊巴比妥钠注射液(1 mL/kg)经实验兔耳缘静脉注射,麻醉满意后用脱毛剂脱去肾区体毛,将其俯卧位固定于动物实验台上,季肋部垫长方形硬物,根据不同分组用200 g砝码(直径3.0 cm)分别从30 cm、40 cm、50 cm、60 cm高处(以相应长度的联塑管作为轨道,管道内径3.5 cm)自由落体垂直撞击实验兔左、右侧肾区,建立不同程度的闭合性肾损伤模型,最后62个肾脏造模成功(有2个肾脏病理检查未见明确肾损伤),损伤分级Ⅰ级8个、Ⅱ级11个、Ⅲ级15个、Ⅳ级21个、Ⅴ级7个。
1.4.2 肾脏组织的组织学观察 取兔肾脏组织标本,HE染色,由同一病理医师采用盲法在Olympus光学显微镜下观察肾脏组织的组织学表现,病变严重处用高倍镜观察。
1.4.3 肾脏组织中TGF-β1表达观察 兔肾脏组织标本进行免疫组织化学染色,以大鼠肝脏标本石蜡切片作为TGF-β1阳性表达对照,以PBS液代替一抗染色作为阴性对照。TGF-β1阳性表达为细胞质呈棕褐色颗粒着色,每张切片随机选取5个高倍视野计数阳性细胞数,取其平均值作为每张切片的最后判定结果,并分析创伤组TGF-β1表达情况与肾损伤分级的关系。结果判定标准:组织完全不着色或阳性细胞数≤25%为阴性(-),阳性细胞数26%~50%为弱阳性(+),阳性细胞数51%~75%为中等阳性(),阳性细胞数>75%为强阳性()。
1.5 统计学方法 所有数据采用SPSS 16.0软件包进行分析。等级资料的两个独立样本比较采用Mann-WhitneyU检验,多个独立样本比较采用Kruskal-WallisH检验。P<0.05为差异有统计学意义。
2 结 果
2.1 肾脏组织的组织学表现 正常组肾包膜完整,肾小球、肾小管结构正常。创伤组肾包膜下可见大量红细胞聚集,部分肾包膜破裂;肾内可见片状出血灶并伴炎细胞渗出,肾小球及肾小管内可见红细胞增多;多数肾小管上皮细胞扁平,胞浆疏松,部分肾小管上皮细胞呈空泡样改变,刷状缘损伤或脱落;多数肾小管腔内可见淡红色絮状物质;以上病变均随着肾损伤分级的升高而加重。
2.2 肾脏组织中TGF-β1表达情况 正常组肾脏组织中可见少数肾小管上皮细胞胞浆呈淡黄色颗粒着色,TGF-β1阳性表达率为25.00%(2/8);创伤组肾脏组织中可见肾小管上皮细胞胞浆呈棕褐色颗粒着色,TGF-β1阳性表达率为91.94%(57/62)。创伤组肾脏组织中TGF-β1阳性表达率明显高于正常组(Z=3.84,P<0.05)。见表1。

表1 2组肾脏组织中TGF-β1表达情况 个(%)
2.3 创伤组肾脏组织中TGF-β1表达情况与肾损伤分级的关系 肾脏组织中TGF-β1阳性表达率随着肾损伤程度的加重而升高(H=27.92,P<0.05)。见表2。
3 讨 论
Shiozuru等[4]在叶酸诱导的小鼠急性肾损伤(AKI)模型中观察到肾远端小管和近端小管损伤显著加重,肾小管扩张与萎缩同时存在,而在细针穿刺引起的创伤性肾损伤模型中可见穿刺区域出现管状坏死斑和纤维化进展。付刚等[5]在新西兰兔闭合性肾损伤模型大体标本中见肾包膜破裂、肾包膜下血肿、肾实质挫裂伤并血肿形成,光镜下见肾细胞发生不同程度损伤,肾毛细血管充血,肾小管内可见红细胞管型和蛋白管型。本实验于创伤组肾脏组织中可见近被膜层、肾小球密集区近皮质侧、肾小球密集区近髓质侧的肾小管上皮细胞病变主要为空泡变性,其中以近被膜层肾小管上皮细胞病变最为显著,近髓质区近曲小管上皮细胞病变主要为颗粒变性,病变较轻,远曲小管及直小管病变最轻,同时以上各处病变随着肾损伤分级的升高而加重,考虑发生上述变化的原因可能与肾动脉主干由肾门处逐渐分支至近被膜层毛细血管网呈树枝状分布的特点以及损伤发生后肾脏血流的重新分布密切相关。
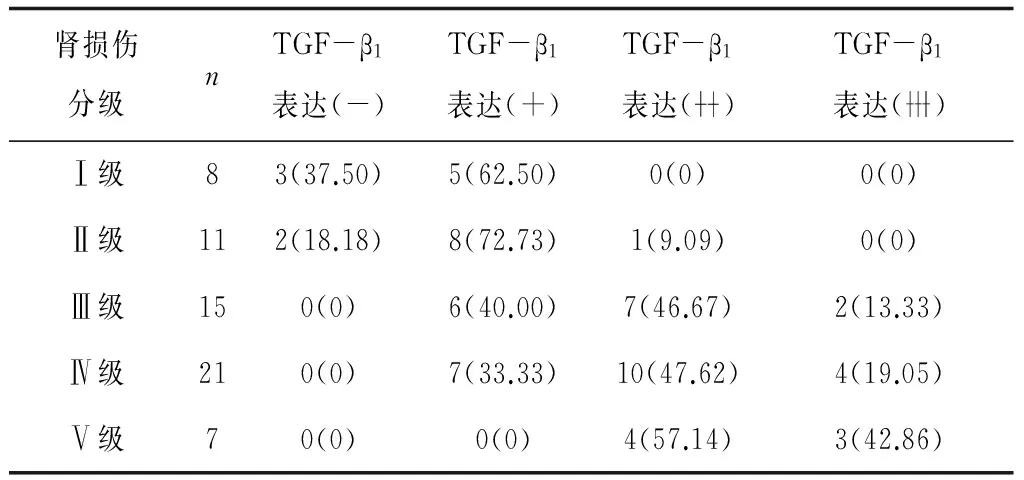
表2 创伤组肾脏组织中TGF-β1表达情况与肾损伤分级的关系 个(%)
TGF-β1是由2个结构相同或相近、分子量分别为12.5 kD的亚单位借二硫键连接形成的双体,是一种多功能细胞因子,在细胞增殖、分化、创面愈合和肿瘤生成转移等过程中均发挥重要调控作用[6]。起初对TGF-β1的生物学功能研究主要在炎症、组织修复和胚胎发育等方面,近年来发现TGF-β1对细胞的生长、分化和免疫功能都具有重要的调节作用[7-9]。一般TGF-β1对间充质起源的细胞起刺激作用,而对上皮或神经外胚层来源的细胞则起着抑制作用。近年研究表明,TGF-β1可通过多种信号通路诱导上皮间质转化(EMT),包括Smad通路和非Smad通路,而Smad信号通路是TGF-β1诱导EMT的主要途径,TGF-β1与其Ⅰ、Ⅱ型受体相结合引起Smad 2和Smad 3磷酸化,磷酸化的Smads 2/3与细胞质内的Smad 4配对并转移至细胞核内,通过与特定基因调节区域结合调控靶基因的转录[10-11]。
TGF-β1是目前公认的最为重要的促进肾间质纤维化的细胞因子之一,而肾间质纤维化又是各种肾脏疾病最终进展到肾衰竭的共同途径和主要病理基础,涉及多种细胞、细胞因子及ECM的相互作用,TGF-β1在这一复杂过程中发挥关键作用,可促进成纤维细胞分泌胶原蛋白,引起肾间质ECM成分沉积,导致肾间质纤维化[12-13]。本实验中创伤组肾脏组织中TGF-β1阳性表达率明显高于正常组,且TGF-β1阳性表达率随着肾损伤程度的加重而升高。提示在闭合性肾损伤发生后,TGF-β1作为一种损伤因子,对肾脏组织的损伤修复具有重要影响,有望为临床上寻找减轻肾损伤后组织和细胞损害的有效干预手段提供新的理论依据。
[1] Bryk DJ,Zhao LC. Guideline of guidelines:A review of urologic trauma guidelines[J]. BJU Int,2016,117(2):226-234
[2] Pan B,Liu G,Jiang Z,et al. Regulation of renal fibrosis by macrophage polarization[J]. Cell Physiol Biochem,2015,35(3):1062-1069
[3] 麻晓林,杨志焕,王正国,等. 实验性肝脏撞击伤的生物力学机制研究[J]. 创伤外科杂志,2007,9(4):351-354
[4] Shiozuru D,Ichii O,Kimura J,et al. MRL/MpJ mice show unique pathological features after experimental kidney injury[J]. Histol Histopathol,2016,31(2):189-204
[5] 付刚,那桂萍,徐亚明,等. B-flow能量模式对兔闭合性肾损伤后血流灌注的动态观察[J]. 华南国防医学杂志,2013,27(11):777-779
[6] 王秋实,李平. TGF-β1受体1和2在TGF-β1调节细胞增殖中的作用[J]. 中国生物化学与分子生物学报,2017,33(2):122-127
[7] Ma FY,Tesch GH,Ozols E,et al. TGF-β1-activated kinase-1 regulates inflammation and fibrosis in the obstructed kidney[J]. Am J Physiol Renal Physiol,2011,300(6):1410-1420
[8] Perera M,Tsang CS,Distel RJ,et al. TGF-beta1 interactome:metastasis and beyond[J]. Cancer Genomics Proteomics,2010,7(4):217-229
[9] Hadaschik EN,Enk AH. TGF-β1-induced regulatory T cells[J]. Hum Immunol,2015,76(8):561-564
[10] 危志强,涂卫平,房向东. 促肾小管上皮细胞转分化诱导剂的研究进展[J]. 中国现代医学杂志,2012,22(2):59-64
[11] Lan HY,Chung AC. TGF-β/Smad signaling in kidney disease[J]. Semin Nephrol,2012,32(3):236-243
[12] Shen B,Liu X,Fan Y,et al. Macrophages regulate renal fibrosis through modulating TGFβ superfamily signaling[J]. Inflammation,2014,37(6):2076-2084
[13] Meng XM,Nikolic-Paterson DJ,Lan HY. TGF-β:the master regulator of fibrosis[J]. Nat Rev Nephrol,2016,12(6):325-338

