新辅助化疗联合平消胶囊治疗口腔鳞状细胞癌的临床效果及microRNA的表达变化
王立臣 陈 珍 汤文兵 陈江平 白东海
口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)是目前最常见的头颈部恶性肿瘤之一,约占所有口腔癌的90%以上。尽管化疗药物和手术治疗在近十多年中取得了很大的进步,但口腔鳞状细胞癌患者的预后依然很差,能达到5年的生存率仍不足50%[1],原位复发、颈部转移复发率高以及远处转移是造成患者预后差、生存率低的主要原因[2-3]。
近年来,microRNA(miRNA)在癌症发生中的作用已成为研究热点,有研究表明microRNA 在肿瘤的发生发展过程中起着重要的调控作用[4-11]。microRNA 参与调控肿瘤的多个方面,包括转录、细胞周期调节、细胞凋亡、血管生成、肿瘤的浸润和转移。microRNA既可以作为诱癌基因参与恶性肿瘤的发生和发育,又可作为抑癌基因参与控制恶性肿瘤的形成[12]。因此,microRNA 作为分子生物学指标在临床判断口腔癌的发生及预后方面具有一定的指导意义。就目前而言,针对与OSCC发生的相关microRNA的研究已有部分报道,且表明miR-186,miR-494和miR-3651等microRNA在口腔鳞状细胞癌患者中均有高表达[13],且在一定程度上,可以作为诊断口腔鳞状细胞癌的一个生化指标。
目前针对口腔鳞状细胞癌的治疗,依旧采用手术为主,放化疗为辅的治疗手段[14],然而临床上众多患者由于分期高、肿瘤瘤体体积大等原因在诊断之初就已经失去了手术的条件,生存质量严重下降,生存期明显缩短[15]。新辅助化疗即针对术前诊断肿瘤分期高、瘤体体积大,导致手术条件丧失或手术难度大而无法进行手术的患者,通过术前相应疗程的化疗,达到降低肿瘤分期,减小肿瘤瘤体体积,以达到手术进行条件[16]。此外,由于化疗药物对患者带来的毒副作用较强,临床上有研究将新辅助化疗联合中药进行抗癌的治疗,为口腔鳞状细胞癌的治疗提供了新的思路和治疗途径。
虽然新辅助化疗已在口腔鳞状细胞癌治疗过程中取得了一定研究进展[17-18],但对于新辅助化疗联合中药治疗口腔鳞状细胞癌,以及治疗前后microRNA表达水平的变化的研究无文献报道,因此笔者希望通过比较单一的新辅助化疗及联合平消胶囊的新辅助化疗来治疗口腔鳞状细胞癌的临床效果,评价联合用药的意义;并选择了14个与口腔鳞状细胞癌相关性较强的microRNA作为研究目标,比较化疗前后口腔鳞状细胞癌患者组织中microRNA表达水平的变化,并以期将microRNA表达水平的变化为预后的疗效指标。
1 材料和方法
1.1 临床资料
选取2016年1月—2017年1月在我院口腔科住院治疗的口腔鳞状细胞癌癌患者98例,住院前均未进行放、化疗及其他治疗,所有患者均经组织病理学诊断确证。其中,男54例,女44例,平均年龄(58.1±6.9)岁。患者肿瘤位置:牙龈部16例,唇部24例,腭部28例,舌部23例,颊黏膜部7例。淋巴结转移:发生淋巴结转32例,无转移66 例。根据TNM肿瘤等级分类标准,Ⅰ期20例,Ⅱ期37例,Ⅲ期22例,Ⅳ期19例。分别对所有患者治疗前后的口腔鳞状细胞癌组织进行留取,放置于液氮中进行保存以备检。同时,留取在口腔科进行治疗的非肿瘤患者黏膜组织标本50例,作为样本的对照组,其中,男24例,女26例,平均年龄(60.2±5.7)岁,与口腔鳞癌患者在性别、年龄等一般情况无差异。
1.2 治疗方案
对以上口腔鳞状细胞癌患者随机分成两组,各49例。单一的新辅助化疗组即TPF(多西他赛+顺铂+ 5-氟尿嘧啶)组,TPF联合平消胶囊治疗组(以下简称TPF+PX组),两组患者在性别、年龄及分期等方面无显著性差异(P>0.05)。本研究经过医院伦理委员会的批准后实施。
TPF组:第1天静脉滴注多西他赛(75 mg/m2);第1~2天静脉滴注顺铂(75 mg/m2);第2~6天静脉滴注5-氟尿嘧啶(1000 mg/m2);3周为一个疗程,应用2~4个疗程。化疗过程根据患者情况可减少输液量和止吐药用量。
TPF+PX组:在TPF给药方案的基础上,根据患者病灶大小,口服平消胶囊每日2~3次,每次4~8粒,1个月为一个疗程,应用1~3个疗程.
1.3 RNA的提取及检测
将保存于液氮中的口腔鳞状细胞癌组织及非肿瘤患者黏膜组织标本研磨至粉末, 按照Trizol RNA抽提试剂盒(miRNeasy mini kit,Qiagen)操作说明进行提取。随后按照反转录试剂盒(RevertAid®,Takara)操作说明进行cDNA的反转录,再以此cDNA为模板,利用 SYBR Green PCR 试剂盒(SYBR® Premix Ex TaqTM,Roche)进行 Q-PCR仪器分析。采用96孔板,各样本做3复孔。PCR程序为:95℃预热10 min;95℃,15 s,60℃,1 min,共40个循环。采用线虫的 cel-miR-39 作为参比,记录样本的Ct值,ΔΔCt法计算microRNA的相对表达量。
1.4 疗效评价指标
疗效评价原则按照世界卫生组织标准评定为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),总有效以CR+PR计。
1.5 统计学方法
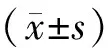
2 结果
2.1 新辅助化疗后临床有效率情况
新辅助化疗后,通过临床观察及患者出院后回访发现,TPF组完全缓解的口腔鳞状细胞癌患者10例(20.41%),部分缓解的口腔鳞状细胞癌患者21例(42.86%),平稳的口腔鳞状细胞癌患者12例(22.49%),进展的口腔鳞状细胞癌患者6例(12.24%),临床总有效率63.26 %(31/49)。TPF+PX组完全缓解的口腔鳞状细胞癌患者13例(26.53%),部分缓解的口腔鳞状细胞癌患者27例(55.10%),平稳的口腔鳞状细胞癌患者5例(10.20%),进展的口腔鳞状细胞癌患者4例(8.16%),临床总有效率81.63 %(40/49)。

表1 新辅助化疗后口腔鳞状细胞癌患者的临床效果评价 (n)
2.2 对照组与口腔鳞状细胞癌组microRNA表达水平的比较
根据文献报道,我们挑选了14个与OSCC极为密切相关的miRAN,其中有9个microRNA(miR-489,miR-129,miR-23a,miR-214,miR-210,miR-92,miR-21,miR-515-3,miR-338)在口腔鳞状细胞癌组织或血清中均表现为高表达的趋势,5个(miR-135b,miR-34a,miR-520h,miR-197,miR-378)表现为低表达的趋势[2]。根据对我院收录的98例口腔鳞状细胞癌患者的肿瘤部位病变组织的RNA表达水平与未患口腔鳞状细胞癌患者组织的RNA表达水平的比较,发现12个microRNA(miR-489,miR-129,miR-23a,miR-214,miR-210,miR-92,miR-515-3,miR-135b,miR-34a,miR-520h,miR-197,miR-378)的表达水平与文献报道基本一致,结果如图1,图2所示;另外,本研究发现miR-21,miR-338在口腔鳞状细胞癌患者组织中的表达水平与对照组无显著性差异(P>0.05),这可能是因为种族差异或者检测手段或仪器上的差异所造成。因此,为了将microRNA的表达水平与口腔鳞状细胞癌的发病及预后评价跟更准确的关联,我们选取了本研究中与文献报道一致的7个(miR-489,miR-129,miR-23a,miR-214,miR-210,miR-92,miR-515-3)表达上调的和5个(miR-135b,miR-34a,miR-520h,miR-197,miR-378)表达下调的microRNA作为新辅助化疗后的检测指标。

与对照组比,*P< 0.05,有差异;**P< 0.01,有显著性差异
图1对照组与口腔鳞状细胞癌组相关microRNA表达水平上调的比较

注:与对照组比,*P< 0.05,有差异;**P<0..01,有显著性差异
图2对照组与口腔鳞状细胞癌组中相关microRNA表达水平下调的比较
2.3 TPF和TPF+PX治疗后口腔鳞状细胞癌患者microRNA的表达水平变化
与治疗前相比,7个高表达的microRNA(miR-489,miR-129,miR-23a,miR-214,miR-210,miR-92,miR-515-3)通过新辅助TPF化疗及TPF联合平消胶囊化疗后,在一定程度上均出现了表达水平的下调,且逐步接近于正常的表达水平;恰恰相反,5个低表达的microRNA(miR-135b,miR-34a,miR-520h,miR-197,miR-378)在一定程度上均出现了表达水平的上调。另外,虽然TPF化疗能够明显使肿瘤组织中的microRNA表达趋向于正常化,但较于TPF联合平消胶囊化疗而言,其效果略于TPF联合平消胶囊化组,如图3所示,7个高表达的microRNA中除了miRNA-92外,其余6个的microRNA的表达水平均有显著性差异(P<0.01),而5个下调microRNA的表达水平,两组之间并没有表现出显著差异(P>0.05)。
3 讨论

注:TPF组或TPF+PX组与治疗前相比,*P<0.05,有差异;**P<0.01,有显著性差异。TPF组与TPF+PX组相比,#P<0.05,有差异;##P<0.01,有显著性差异
图3 TPF及TPF+PX新辅助化疗前后口腔鳞状细胞癌患者miRNA的表达水平
口腔癌的发生是一个从正常组织-低级别瘤变-中级别瘤变-高级别瘤变-原位癌-浸润癌的逐渐进展的过程。在临床上众多患者由于分期高、肿瘤瘤体体积大等原因在诊断之初就已经失去了手术的条件,因此临床上常用新辅助化疗的方法进行治疗,以期达到手术的治疗。由于化疗药物对患者带来的毒副作用较强,临床上新辅助化疗联合中药进行抗癌的治疗的方案成为一种新的治疗途径。而本研究所联用的平消胶囊为纯中药抗肿瘤制剂,主要成分为郁金、马钱子粉、仙鹤草、五灵脂、白矾、火硝、干漆(制)、枳壳(麸炒) 等[19],在临床上应用已有40余年的历史,具有扶正祛邪,活血化瘀,清热解毒,止痛散结等疗效,能提高机体的细胞免疫和体液免疫功能,缓解肿瘤患者的痛苦,提高生存质量和延长生存期,起到了积极作用;且现代研究表明平消胶囊对鼻咽癌[20],肺癌[21],乳腺癌[22],肝癌[23],胃癌[24]等恶性肿瘤均有较好的抑制作用,联合其他化疗药物进行治疗,能明显的改善患者的病痛及减少不良反应的发生率,为中西医结合治疗肿瘤提供了有效途径[25-27]。
microRNA是人类体内重要的转录后调控因子,参与细胞分化、增殖以及凋亡等多个细胞生物学过程。microRNA介导的基因调控是人类体内的一种基本转录后调控途径,能够调控超过50%的细胞基因,参与调控包括分化、增殖以及凋亡在内的多个细胞生物学过程[28]。因此,microRNA表达的失调与多种疾病有关,其中也包括肿瘤。肿瘤具有十大生物学特征,分别为持续的增殖信号、逃避生长抑制信号、抵抗细胞凋亡、无限的复制能力、诱导血管生成、激活侵袭和转移、异常的能量代谢、基因不稳定性和突变、肿瘤促进的炎症以及免疫逃逸[29],这些生物学行为不同程度地涉及microRNA的调控。而microRNA 既可以是癌基因,也可以是抑癌基因。此外,microRNA 在肿瘤组织中的表达水平的变化十分复杂,但其癌变后表达水平与与正常机体表达水平有一定的差异性[30-32],其很可能成为肿瘤临床诊断和预后判断的一种新手段。
目前,microRNA在口腔癌的发生、发展中具有重要的指示作用,在口腔癌的进展过程中microRNA的表达水平随之改变,该变化有利于口腔癌的早期诊断以及疾病进展的监测。Scapoli[2]发现口腔鳞状细胞癌患者中有13个microRNA (miR-489, miR-129, miR-23a, miR-214, miR-23b, miR-92, miR-25, miR-210, miR-212, miR-515, miR-146b,miR-21, miR-338)发生了高表达,6 microRNA(miR-520h, miR-197, miR-378, miR-135b, miR-224, miR-34a)发生了低表达,这与本研究的结论基本一致。同样,Shiiba等[25]发现口腔癌、黏膜白斑、正常组织中 microRNA 的表达水平与细胞病理学特征相关,miR-21、miR-345和miR-181b在口腔癌中的表达显著高于口腔黏膜白斑和正常黏膜组织;而在有丝分裂象增多、核质比高、染色深的口腔黏膜白斑细胞中miR-21、miR-181b的表达增高[20]。口腔鳞状细胞癌患者通过TPF化疗和TPF联合平消胶囊的新辅助治疗,在一定范围内使高表达的microRNA及过低表达的microRNA的表达水平趋于正常化,从侧面说明了本研究所筛选的相关microRNA与口腔鳞状细胞癌是密切相关的,为口腔鳞状细胞癌的产生机理提供了一个新的研究思路;此外,本研究所筛选的microRNA亦有望成为一种新的生化指标,来诊断口腔鳞状细胞癌的进展程度以及预后评价标准。
此外,本研究发现,两种治疗手段在其临床效果评价上,单一TPF的化疗效果不及与TPF联合平消胶囊的化疗效果,一定程度上说明,平消胶囊能够明显改善患者的化疗效果;另外,从临床反映的不良反应而言,平消胶囊亦能减轻TPF所带来的不良反应的症状。虽然目前还不明确平消胶囊在本联合应用中所发挥作用的具体机理,但该研究作用与平消胶囊在其他肿瘤的治疗方面[19],有一定的契合性,其作用机理还待深入研究。
[1] BRINKMAN B M N, WONG D T W. Disease mechanism and biomarkers of oral squamous cell carcinoma[J]. Current opinion in oncology, 2006, 18(3): 228-233.
[2] SCAPOLI L, PALMIERI A, MUZIO L L, et al. MicroRNA expression profiling of oral carcinoma identifies new markers of tumor progression[J]. International journal of immunopathology and pharmacology, 2010, 23(4): 1229-1234.
[3] SUMIOKA S, SAWAI N Y, KISHINO M, et al. Risk factors for distant metastasis in squamous cell carcinoma of the oral cavity[J]. Journal of Oral and Maxillofacial Surgery, 2013, 71(7): 1291-1297.
[4] CALIN G A, SEVIGNANI C, DUMITRU C D, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proceedings of the National academy of Sciences of the United States of America, 2004, 101(9): 2999-3004.
[5] VOLINIA S, CALIN G A, LIU C G, et al. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(7):2257-2261.
[6] LEE Y S, KIM H K, CHUNG S, et al. Depletion of human micro-RNA miR-125b reveals that it is critical for the proliferation of differentiated cells but not for the down-regulation of putative targets during differentiation[J]. Journal of Biological Chemistry, 2005, 280(17):16635.
[7] ROLDO C, MISSIAGLIA E, HAGAN J P, et al. MicroRNA expression abnormalities in pancreatic endocrine and acinar tumors are associated with distinctive pathologic features and clinical behavior[J]. Journal of Clinical Oncology, 2006, 24(29):4677-84.
[8] CHANG T C, WENTZEL E A, KENT O A, et al. Transactivation of miR-34a by p53 Broadly Influences Gene Expression and Promotes Apoptosis[J]. Molecular Cell, 2007, 26(5):745.
[9] LODYGIN D, TARASOV V, EPANCHINTSEV A, et al. Inactivation of miR-34a by aberrant CpG methylation in multiple types of cancer[J]. Cell Cycle, 2008, 7(16):2591.
[10] NAKAJIMA G, HAYASHI K, XI Y, et al. Non-coding MicroRNAs hsa-let-7g and hsa-miR-181b are Associated with Chemoresponse to S-1 in Colon Cancer.[J]. Cancer Genomics Proteomics, 2006, 3(5):317.
[11] 刘芳腾,欧阳喜,张官平,等.循环miRNA在结直肠癌诊断中的应用价值[J].实用医学杂志,2016,32(13):2241-2243.
[12] ZHANG B, PAN X, COBB G P, et al. microRNAs as oncogenes and tumor suppressors[J]. Developmental biology, 2007, 302(1): 1-12.
[13] RIES J, VAIRAKTARIS E, KINTOPP R, et al. Alterations in miRNA expression patterns in whole blood of OSCC patients[J]. Vivo, 2014, 28(5):851.
[14] 曹雨庵. 我国口腔鳞癌的治疗现状[J].实用肿瘤杂志,2012, 27(2): 109-112.
[15] 孙传政, 陈福进, 曾宗渊, 等. 92例晚期舌鳞状细胞癌的治疗及预后分析[J].中华口腔医学杂志, 2006, 41(11): 650-653.
[16] 管卫华,龙 英, 郁宝铭. 新辅助化疗研究进展[J].国外医学(肿瘤学分册), 2001, 28(3): 233-235.
[17] 胡欣欣, 张勤华, 齐 聪. 晚期卵巢癌新辅助化疗研究进展[J].中国实用妇科与产科杂志, 2011, 27(1): 77-80.
[18] ZHONG LP, ZHANG CP, REN GX, et al. Randomized phase III trial of induction chemotherapy with docetaxel, cisplatin,and fluorouracil followed by surgery versus up- front surgery in locally advanced resectable oral squamous cell carcinoma[J]. J Clin Oncol, 2013, 31(6): 744-751.
[19] 刘 非, 刘 健. 平消胶囊治疗恶性肿瘤研究概况[J].现代肿瘤医学, 2007, 15(1):142-143.
[20] 邱荣良, 吴 慧, 张景伟,等. 平消胶囊对鼻咽癌放疗增效减毒作用的临床观察[J].现代肿瘤医学, 2005, 13(3):415-416.
[21] 谷牧人. 平消胶囊联合常规放化疗治疗肺癌疗效观察[J].新中医, 2015(12):179-180.
[22] 常庆龙, 冯爱强, 贾国丛,等.平消胶囊减轻乳腺癌术后化疗的不良反应[J].现代肿瘤医学, 2010, 18(5):908-909.
[23] 孙秋实, 曹传华, 张凌云.平消胶囊联合肝动脉栓塞化疗治疗中晚期肝癌60例的临床分析[J].现代肿瘤医学, 2012, 20(2):322-324.
[24] 范志刚,王小华, 贺启华,等. 平消胶囊联合化疗治疗进展期胃癌47例[J].陕西中医, 2011, 32(1):6-7.
[25] SHIIBA M, SHINOZUKA K, SAITO K, et al. MicroRNA-125b regulates proliferation and radioresistance of oral squamous cell carcinoma[J]. British Journal of Cancer, 2013, 108(9):1817-21.
[26] 刘晓楠, 张文超.口腔癌相关microRNA研究进展[J].天津医药, 2015, 43(5):570-572.
[27] 宋晓萌. NOTCH1通路在口腔鳞癌中改变及临床意义的研究[D].上海交通大学, 2013.
[28] 单保恩,刘丽华. MicroRNA:癌症诊治新靶点[J].中国肿瘤生物治疗杂志, 2014, 21(6):603-609.
[29] HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. cell, 2011, 144(5): 646-674.
[30] 张贤兰, 黎少琴, 苏 宁,等. 晚期非小细胞肺癌组织中BRCA1、RAP80的表达与化疗疗效的关系[J]. 现代医院, 2015(6):11-13.
[31] 周 毅, 任国敏, 杨聪慧,等. 慢性淋巴细胞性白血病患者miR-9-3甲基化异常及其意义[J]. 现代医院, 2014, 14(10):11-14.
[32] 杨群芳, 严伟玲. 卵巢恶性肿瘤组织中微小 RNA 的检测及其临床意义[J].现代医院, 2014(7):72-75.

