分离膜在转移因子生产中的应用
曹占平 ,宋晓绪 ,范云双 ,,王尚尚 ,苏建东 ,刘恩华
(1.天津工业大学 环境与化学工程学院,天津 300387;2.天津工业大学 分离膜与膜过程国家重点实验室/分离膜科学与技术国家级国际合作研究中心,天津 300387;3.天津瑞普生物技术股份有限公司,天津 300308)
转移因子(transfer factor,TF)作为一种特定的淋巴细胞因子参与机体的免疫反应,具有传递免疫信息、激发免疫细胞活性、增强机体特异性和非特异性免疫功能等作用.目前,常见的有牛转移因子、猪转移因子、鸡转移因子,并且转移因子逐渐应用于动物疾病的防治上,如对牛[1]、猪[2]、鸡[3]和犬[4]均有明显的效果;鸡转移因子在畜禽病的治疗方面也有不少报道[5-7].
目前,制备TF的原料大部分使用猪、鸡等动物的脾脏,经典的TF生产方法是Laurence法(透析法),此方法操作简单,但生产周期长,成本高,不适合规模化生产[8-10].文献[11]报道,两步 pH调节+超滤工艺,适于转移因子的工业化生产.但是脾脏经匀浆、冻融后呈稀薄的糊状,如何去除细胞残渣是超滤的关键.而管式微滤膜组件的宽流道具有良好的流动状态,不易堵塞,膜管可以拆装和重复使用,适合脾脏匀浆液生产转移因子的超滤工艺的预处理[12-14].
本次实验将新鲜猪脾脏经去血、去脂和去筋膜等杂质后再进行初绞、精绞、灭活、冻融、离心,取上清液;用管式微滤膜进行过滤,去除上清液中的悬浮物、胶体等较大颗粒的杂质,得到澄清透明的料液;然后用截留分子质量为6 ku的超滤膜进行进一步纯化,去除料液中大分子蛋白等杂质,保留小分子的有效成分,即制得畜禽用转移因子半成品,再经除菌、检验、包装即得产品.本实验目的是在最大限度保持产物活性、提高得率,同时适应规模化生产需求的基础上,探索出一条新的生产工艺流程.
1 实验部分
1.1 实验材料和设备
猪脾脏均质液:将新鲜猪脾脏经去血、去脂和去筋膜等杂质后再进行初绞、精绞、灭活、反复冻融、离心分离取上清液.
管式微滤设备:由天津海普尔科技股份有限公司提供,管式微滤膜选用孔径为0.03 μm、外径为12mm、内径10 mm、长2 m的7根管式微滤膜构成的管式膜组件,膜组件过滤面积约0.5 m2.
中空纤维超滤设备:由天津膜天膜科技股份有限公司提供,超滤膜截留分子质量为6 ku,膜组件的过滤面积为2 m2.
其他材料和仪器:分析纯氢氧化钠、洁净塑料桶(100 L、75 L、25 L、5 L)、量杯(1 000 mL、500 mL、250 mL)、秒表等,均为市售.
1.2 转移因子生产工艺流程
TF分离膜生产工艺流程如图1所示.
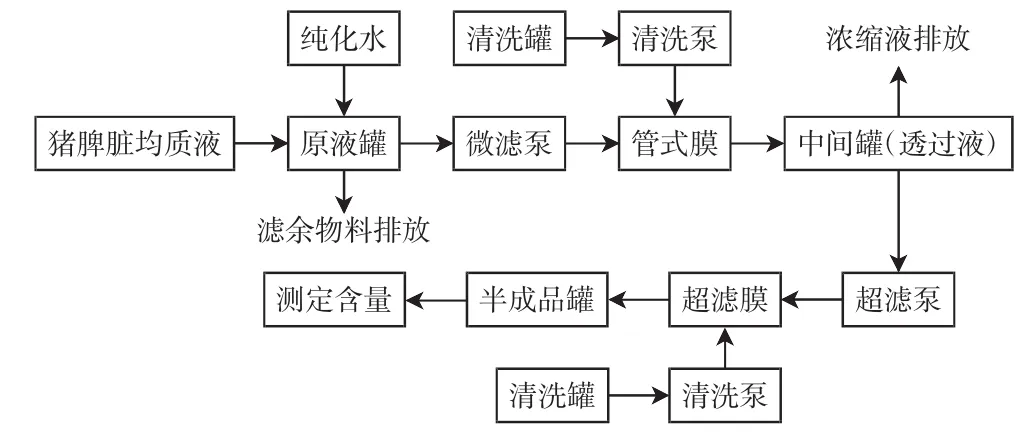
图1 TF分离膜生产工艺流程Fig.1 Flow chart of TF production process bymembrane technology
分离膜生产工艺主要处理设备包括2部分,即管式微滤设备和中空纤维超滤设备.管式微滤设备作用是去除原料物料中的悬浮物、胶体等较大颗粒的杂质,得到澄清透明的料液;经过管式微滤膜设备生产的澄清料液再经过中空纤维超滤处理纯化,去除料液中大分子蛋白等杂质,保留6 ku分子质量下的小分子物质有效成分,即制得半成品.
1.3 实验方案
1.3.1 管式膜微滤实验
按实验要求安装管式膜组件,纯水循环冲洗3次,测定在0.05 MPa压力下的纯水透水量;用纯水将猪脾脏均质液稀释,开泵,选择低进膜流量和低膜压力下运行,当均质液进入系统循环,控制操作压力在0.05 MPa左右,收集微滤透过液,记录每升透过液的所用时间,每隔15 min记录脾脏均质液和微滤透过液的温度;透过液收集结束后,处理脾脏均质液的浓缩循环液;微滤系统进行系统清洗,记录清洗后的纯水透过量.
1.3.2 超滤组件超滤实验
安装超滤装置,纯水循环冲洗3次,测定在0.05 MPa压力下的纯水透水量;将管式微滤设备收集到的微滤透过液作为超滤系统的待过滤料液,混匀,开泵,在0.05 MPa压力下收集超滤透过液,记录收集1 L滤液所需时间.超滤透过液收集结束后,超滤透过液即作为TF半成品;超滤系统进行系统清洗,记录清洗后的纯水透过量.超滤透过液混匀,留样测定多肽、核糖含量及TF活性.
1.3.3 膜清洗工艺
管式膜组件和超滤装置清洗步骤大体相同,视实际情况具体操作.先向微滤原水罐中加入纯水,加热到30~40℃,冲洗管式膜及管路至出水基本无色.排尽装置中的水,加入氢氧化钠溶液进行碱洗,系统循环20~30 min;再次加入纯水进行水洗,冲洗到出水口与进水口pH值接近时,继续加入纯水冲洗,直至浓缩口与进水口pH值接近;膜组件经过纯化水冲洗完毕后,再注入质量分数为0.5%甲醛溶液,循环15~30 min,将膜组件用0.5%的甲醛保存起来,再次使用前用纯化水洗净.
膜过滤结束后,以清洗后纯水透过速率为考察指标,比较管式微滤膜和超滤膜的恢复情况.
1.3.4 多肽及核糖含量测定
采用Lowery(福林酚)法对超滤透过液的多肽含量进行检测,用二羟基甲苯法测定超滤透过液核糖含量,用E玫瑰花环法测定超滤透过液活性.
2 结果与讨论
2.1 管式微滤实验中脾脏均质液稀释方法的确定
管式膜组件的宽流道具有良好的流动状态,不易堵塞,膜管可以拆装和重复使用,适合具有一定粘度的高固含量的液体物料过滤除杂和提纯.本工艺选用管式微滤膜装置对反复冻融3次的脾脏均质液进行第一次过滤,去除脾脏均质液的细胞碎片以及胶体物质等,对料液进行澄清;由于均质液固含量高、粘稠,不适于管式膜直接过滤,因此需要对均质液进行稀释.
实验中用纯化水稀释猪脾脏均质液有2种稀释方法.方法①:按照体积比为1∶2的比例用纯水直接把25 L均质液稀释至75 L;方法②:按照体积比为1∶1的比例用纯水把25 L均质液稀释至50 L,在过滤过程中,随着微滤透过液被收集10 L后,向均质液中不间断加入纯水25 L,加入纯水速率与过滤速率基本平衡,直至收集透过液50 L过滤操作结束.本实验研究稀释方法对微滤和超滤的工作效率、微滤操作温度、微滤和超滤的透过速率的影响以及半成品中多肽、核糖以及活性的影响,从而确定微滤实验中均质液的稀释方法.
2.1.1 微滤、超滤装置透过效率
微滤、超滤装置透过效率结果如表1和表2所示.
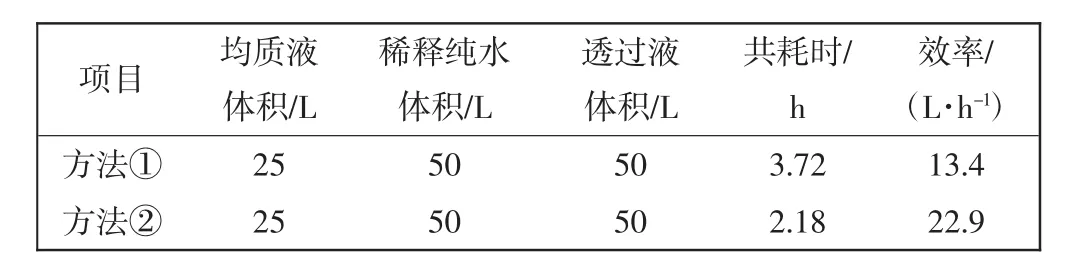
表1 2种稀释方法的微滤过滤效率Tab.1 MF efficiency of two kinds of dilution methods
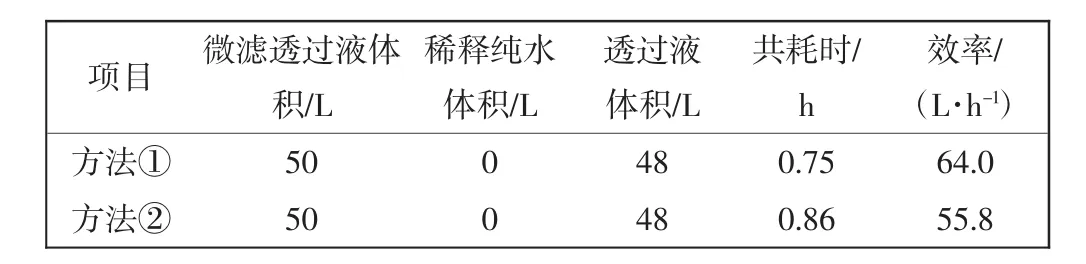
表2 2种稀释方法的超滤过滤效率Tab.2 Ultrafiltration efficiency of two kinds of dilution methods
由表1和表2可见,同样的待过滤料液体积75 L,透过体积50 L,采用稀释方法①微滤耗时3.72 h,超滤耗时0.75 h,合计4.47 h.而方法②微滤耗时2.18 h,超滤耗时0.86 h,合计3.04 h;显然方法②过滤效率更高.因为随着膜过滤的进行,包含转移因子在内的小分子物质透过微滤膜被收集,均质液原液不断被浓缩,因此在管式膜待过滤物中不断补加纯化水,可以起到稀释、冲洗、提高过滤效果的作用.管式膜组件(0.5 m2)每 1 h透过量可达约 20 L,超滤膜组件(2 m2)每1 h透过量可达约50 L以上,过滤效率高、耗时短,可以明显缩短生产周期,更适合规模化生产.
2.1.2 2种稀释方法中溶液温度变化情况
TF是一类具有多种生物学活性的生物反应调节剂,人们普遍认为TF在低温下维持其生物活性,在高温下活性会短时间内消失[15],因此为了保证TF的活性,需要控制膜过滤过程中的温度.如果温度超过37℃,应尽快停止操作,对均质液进行降温处理.微滤设备由于错流流速高,液体循环量大,所以温度变化比较大,如表3所示.而超滤设备在运行期间温度变化较小,基本恒定在13~16℃.
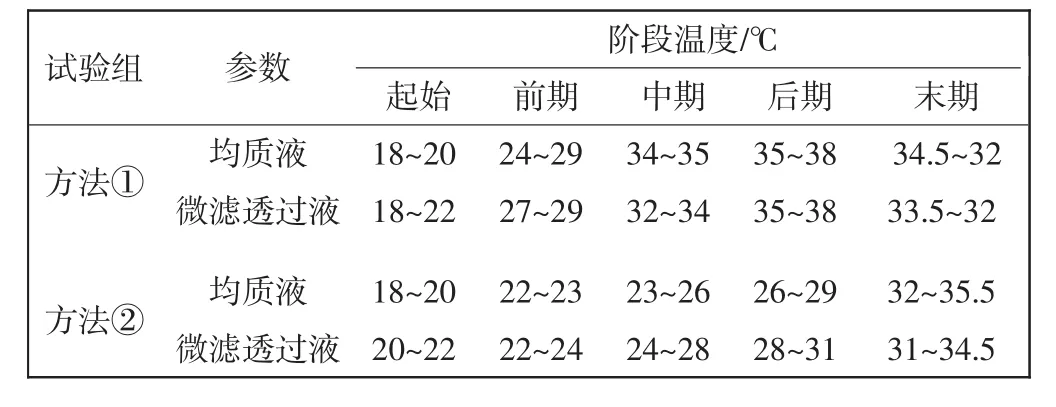
表3 2种稀释方法的微滤过滤过程中均质液温度变化情况Tab.3 Changes of solution temperaturein tube MF process by two dilution methods
由表3可见,显示稀释方法②在整个连续的过滤过程中,稀释均质液的温度在18~35.5℃.而稀释方法①在连续工作过程中,稀释液的温度升高较快,在运行后期达到38℃,为了保证膜在正常温度下工作,需要对稀释液进行桶外冰水降温,以防稀释液温度继续升高,也保证生产的连续性.方法①的温度上升较快与过滤体积有关.由于微滤膜的错流过滤,料液不断循环使料液温度不断上升,而①组实验的料液体积不断减少,温度上升速度也较快.而方法②在管式膜待过滤物中不断补加温度较低纯化水(15℃),可以维持料液温度处于适宜范围.
2.1.3 2种稀释方法对管式微滤液透过速率的影响
以累计收集的透过液体积为横坐标,每升微滤透过液的透过速率为纵坐标,绘制两者的关系如图2所示.

图2 2种不同稀释方法对微滤液透过速率的影响Fig.2 Effects of dilution methods on MF permeate rate
由图2可见,方法①组在整个过程中膜透过量逐步降低,主要是由于料液浓度及黏度不断增大,膜表面的形成凝胶层以及膜孔阻塞造成的.而微滤②组在整个过程中膜通量相对稳定,刚开始膜通量较低,是由于相对于①组固含量高,在收集10 L透过液后,开始加入纯水,透过速率与加纯水速度基本恒定,待过滤料液的浓度和温度相对恒定,因此过滤速率也比较稳定.而且由于料液小分子量物质被析出,粘度也相对在降低,微滤透过速率在前期甚至略有上升趋势.在过滤后期,料液固含量增加,膜污染造成透过速率下降.
2.1.4 2种稀释方法对超滤透过速率的影响
以累计收集的透过液体积为横坐标,每升超滤透过液的透过速率为纵坐标,绘制两者的关系如图3所示.
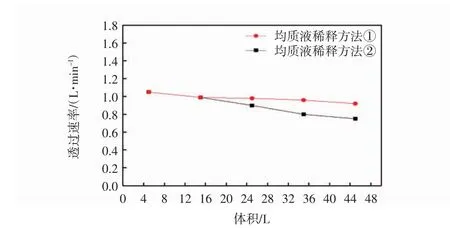
图3 2种不同稀释方法对超滤液透过速率的影响Fig.3 Effects of dilution methods on UF permeaterate
由图3可见,微滤透过液采用超滤设备进行转移因子进一步提纯,50 L料液在45 min内即可完成,操作温度稳定在13~16℃,超滤透过液可达48 L,回收率达到96%.第1次超滤过程中,透过率下降明显,而第2次超滤过程中,全程的透过速率变化较小,可能由于按照稀释方法①收集到的微滤透过液浓度较高造成的,这也与该组生产的TF原液的多肽和核糖含量较高的结果一致.
2.1.5 2种稀释方法收集的超滤液活性成分分析
将2种稀释方法收集的超滤液进行活性成分分析,结果如表4所示.
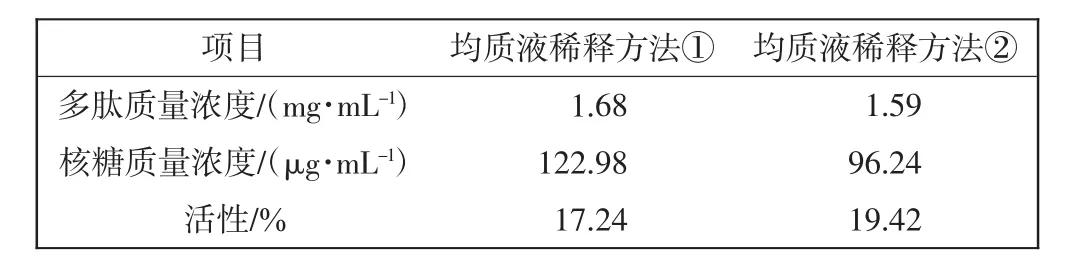
表4 均质液2种不同稀释方法的比较Tab.4 Comparison of two dilution methods for homogenate
由表4可知,稀释方法①的多肽和核糖成分浓度也略高,由于滤过时间较长的原因,而活性略低.在TF半成品中,要求多肽含量每1 mL应不小于1.5 mg,核糖含量每1 mL应不小于50 μg.因此2种稀释方法均能达到此标准.
2.2 反复冻融次数对管式微滤和超滤透过速率的影响
匀浆液反复冻融次数对产品的收率和质量有很大的影响.反复冻融促使细胞完全破碎,使TF充分释放出来,从而提高产品的收率.匀浆液冻融次数越多,TF溶液中多肽的浓度就越高.但冻融次数并非越多越好,冻融次数越多,核糖降解的越多,其产品中核糖与多肽的比值就越低.另外,匀浆液反复冻融次数与管式微滤和超滤的过滤效率也有关.
对匀浆液反复冻融3次与反复冻融8次的管式微滤透过速率的变化进行比较,如图4所示.
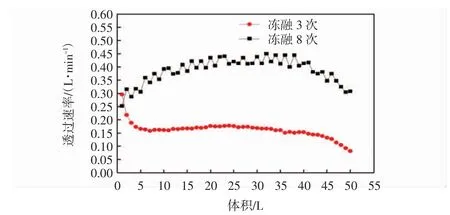
图4 不同冻融次数对微滤液透过液速率的影响Fig.4 Effect of different freezing and thawing times on microfiltration rate
由图4可见,匀浆液冻融8次的微滤实验的透过速率较冻融3次明显降低.采用同样的均质液稀释方法②,冻融8次工艺微滤操作需要5.22 h,而冻融3次微滤需要2.18 h.冻融次数增多,脾细胞破碎率提高,细胞内肽类等有效成份溶出率提高,但是细胞残渣碎片含量也增多,这些细胞残渣碎片加剧了微滤膜浓差极化的阻力造成透过速率下降.冻融8次的微滤透过液50 L用超滤设备提纯,可回收48 L超滤透过液,而且超滤操作在42 min内完成.超滤设备的过滤速率如图5所示.

图5 不同冻融次数对超滤液透过速率的影响Fig.5 UF permeate rate in different freezing and thawing times for homogenate
由图5可知,冻融8次的超滤速率比冻融3次的有所提升,这主要是由于本次试验操作温度为25℃,而冻融3次的超滤过滤温度为13~16℃.
不同冻融次数工艺的比较如表5所示.
从表5可以看出,在规模化生产中冻融次数要根据产品活性成分含量和生产效率综合确定.反复冻融3次比较合适,既能满足产品质量要求,又能提高生产效率.

表5 不同冻融次数工艺的比较Tab.5 Comparison of different freeze-thaw times processes
2.3 管式微滤设备和超滤设备的清洗恢复情况
分别以清洗方法和清洗次数为横坐标,以纯水透过速率为纵坐标,绘制微滤设备、超滤设备纯水透过速率变化图如图6和图7所示.

图6 清洗方法对微滤膜纯水透过速率的影响Fig.6 Effect of cleaning method on pure water transmission rate of MF

图7 清洗次数对膜纯水透过速率的影响Fig.7 Effect of cleaning method on membrane pure water transmission rate
由图6和图7可知,每一批均质液经管式微滤膜和超滤设备过滤结束后,微滤膜和超滤膜都要尽快进行清洗.微滤膜和超滤膜清洗工艺基本相同.清洗方法为纯水冲洗和氢氧化钠溶液浸泡或低流量循环清洗.清洗后的纯水透过速率作为考察指标比较管式微滤膜和超滤膜的恢复情况.管式微滤膜在第1次使用后,使用0.1%氢氧化钠清洗后,膜的纯水透过速率分别恢复到新膜的43.3%;而用1.0%氢氧化钠清洗后,膜的纯水透过速率分别恢复到新膜的46.3%,纯水通量的变化是新膜第1次使用造成的膜的不可逆污染造成的.0.1%和1.0%氢氧化钠在恢复膜透过速率的清洗浓度上,差异不明显,低浓度碱液足以进行膜的清洗.因此,在每次试验结束后,微滤和超滤膜都采用纯水冲洗和0.1%氢氧化钠溶液浸泡或低流量循环的清洗方式.图7表示经过6批次过滤后的微滤膜和超滤膜纯水透过速率的恢复情况.第1次使用后,微滤膜纯水透过速率陡降至新膜的43.3%,以后5次使用并清洗后的纯水透过速率下降很缓慢,基本都能恢复到第2次的90%左右.因此,恰当的清洗方式基本能保证分离膜工艺在TF生产中的连续性.
2.4 分离膜工艺与传统工艺比较
采用分离膜工艺运行3批,与传统工艺对比,测定结果如表6所示.

表6 分离膜工艺与传统工艺的比较Tab.6 Membrane technology compared with traditional process
由表6可知,传统工艺透析法(Laurence法),即直接将离心上清液置于透析袋中,于4℃用等体积的注射用水透析24 h,换注射用水再透析24 h,收集合并透析液.通过对传统工艺与分离膜工艺对比可发现采用膜过滤技术生产TF,缩短了原液生产周期,TF的收率、含量及活性等都有明显提高,可以作为TF规模化生产的一种方法.
3 结 论
(1)脾脏均质液采用纯水1∶1(体积比)稀释,在过滤过程中不断添加纯水以降低操作温度、并提高过滤效率.微滤和超滤操作可以在约3 h完成,操作温度始终低于37℃,更适宜TF的生产,超滤透过液中多肽、核糖的含量也符合半成品的要求.
(2)在大规模生产中冻融次数要根据产品活性成分含量和生产效率综合确定.反复冻融3次比较合适,更适宜分离膜工艺操作.
(3)每一批均质液经管式微滤膜和超滤设备过滤结束后,微滤膜和超滤膜都要尽快进行清洗.6批次过滤后的膜通量恢复情况良好,可用于连续生产.
(4)采用膜过滤技术生产TF,缩短了原液生产周期,TF的收率、含量及活性等都有明显提高,可以作为TF规模化生产的一种方式.
[1]KLESIUS P H,FUDENBERG H H.Bovine transfer factor:In vivo,transfer of cell-mediated immunity to cattle with alcohol precipitates[J].Clinical Immunology&Immunopathology,1977,8(2):238-246.
[2]JAMKAR A V.Immunotherapy of advanced carcinoma maxilla with immunosensitised porcine mesentric lymph node cells with immunospecific xenogenic lymphnode cell transfer factor[J].Indian Journal of Cancer,1980,17(1):25-30.
[3]KLESIUS P H,GIAMBRONE J J.Adoptive transfer of delayed hypersensitivity and protective immunity to eimeriatenella with chicken-derived transfer factor[J].Poultry Science,1984,63(7):1333-1337.
[4]SIMON M R,JR S J,FREIER D,et al.Tuberculin-specific transfer factor in dogs[J].Infection&Immunity,1977,18(1):73-77.
[5]张广英,徐可利,王玉茂,等.兽用转移因子的应用[J].中国畜禽传染病,1991,60(5):68-69.ZHANG G Y,XU K L,WANG Y M,et al.The application of the transfer factor in veterinary use[J].Chinese Animal and Poultry Infectious Diseases,1991,60(5):68-69(in Chinese).
[6]MADDISON S E,HICKLIN M D,CONWAY B P,et al.Transfer factor:Delayed hypersensitivity to Schistoso mamansoni and tuberculin in Macacamulatta[J].Science,1972,178(4062):757-759.
[7]MISHRA S S,JAISWAL T N.Transfer of delayed hypersensitivity by dialysable lymphocyte extract from Listeriamonocytogenes sensitized rabbits[J].Indian Vet,1992,69(1):1-4.
[8]成杰,栾业俊,仲亚娜,等.转移因子的研究进展 [J].山东畜牧兽医,2017,38(8):55-57.CHENG J,LUAN Y J,ZHONG Y N,et al.Advances in transfer factors[J].Shandong Animal Husbandry and Veterinary Medicine,2017,38(8):55-57(in Chinese).
[9]顾平,陈德有.猪脾转移因子生产工艺的改进[J].中国生化药物杂志,2001,22(2):94-95.GU P,CHEN D Y.Improvement of pig spleen transfer factor production process[J].Chinese Journal of BiochemicalMedicine,2001,22(2):94-95(in Chinese).
[10]张立武,万星,孔建平,等.猪脾转移因子的规模化生产工艺研究[J].畜牧与兽医,2011,43(5):61-63.ZHANG L W,WAN X,KONG J P,et al.Study on large scale production process of pig spleen transfer factor[J].Journal of Animal Husbandry and Veterinary Medicine,2011,43(5):61-63(in Chinese).
[11]朱天新,任晚琼,袁彩君.猪脾转移因子生产方法的比较[J].中国生化药物杂志,2005,26(1):44-45.ZHU T X,REN W Q,YUAN C J.Comparison of production methods of pig spleen transfer factor[J].Chinese Journal of BiochemicalPharmaceutics,2005,26(1):44-45(inChinese).
[12]刘达玉,钟世荣.管式膜超滤生黄酒的研究 [J].食品科学,2004,25(3):110-112.LIU D Y,ZHONG S R.Study on ultrafiltration of rice film by tubefilm[J].Food Science,2004,25(3):110-112(inChinese).
[13]王尚尚,苏建东,杨燚,等.一种猪脾转移因子纯化方法:中国,CN103724419A[P].2014-04-16.WANG S S,SU J D,YANG Y,et al.A method for purification of porcine splenic transfer factor:China,CN103724419A[P].2014-04-16(in Chinese).
[14]王甜,苏建东,王尚尚,等.一种猪脾转移因子制备方法:中国,CN103705539A[P].2014-04-09.WANG T,SU J D,WANG S S,et al.A method for preparing pigspleen and transfer factor:China,CN103705539A[P].2014-04-09(in Chinese).
[15]王彦宏,冷南,王树宽,等.不同温度贮存的转移因子对淋巴细胞增殖反应的影响[J].第四军医大学学报,1996,17(3):240.WANG Y H,LENG N,WANG S K,et al.Effects of different temperature storage transfer factors on lymphocyte proliferation response[J].Journal of the Fourth Military Medical University,1996,17(3):240(in Chinese).

