全长与成熟形式IL-37b的真核表达载体的构建与研究
李梦媛,韦荣飞,杨星九,朱瑞敏,高 苒
(中国医学科学院医学实验动物研究所,北京 100121)
IL-37是IL-1家族细胞因子,曾经被命名为IL-1F7[1],在人体多种组织、器官中都有表达;在多种人源细胞系中也能够检测到IL-37,如THP-1、U937、A431、IMTLH、KG -1、HL60、HPBMC、HPT4和NHDC细胞等[2-4]。小鼠体内并未发现IL-37同类细胞因子的表达[5],因此小鼠及其来源的细胞系能够排除背景干扰,作为较理想的对象应用于IL-37的研究。IL-37共有6个外显子,IL-37b是IL-37五种亚型a~e中序列最长的一个,全长的IL-37b共有218个氨基酸,含有外显子1、2、4、5、6[6],并在1号外显子处有caspase-1酶切位点,能够经其切割转变为成熟形式的IL-37b[7],下文中分别将二者命名为FL-IL-37b(full-length-IL37b)与M-IL-37b(mature-IL-37b)。目前,大量研究已证明IL-37b具备生物学活性,能够作为炎症抑制因子在多种炎症性疾病中发挥功能,同时,这些疾病引起的炎症反应也能够上调IL-37b的表达[8-12]。本实验中构建的IL-37b真核表达载体旨在为人类炎症性疾病病理机制的研究提供基础,并为疾病的治疗方案提供潜在的新方法。
1 材料和方法
1.1 材料
含有全长IL-37b编码区基因的质粒pUBC 2(+)以及载体质粒pEGFP N1由本实验室制备保存。
T4连接酶、限制性内切酶购自NEB公司;DNA分子量marker、PCR Premix Taq购自TaKaRa公司;RAW 264.7细胞购自中国医学科学院基础医学研究所;IL-37抗体购自Abcam公司;HRP标记的山羊抗兔IgG购自中杉金桥生物公司;LPS(Lipopolysaccharide)购自Sigma公司;转染试剂Lipofectamine 2000、TRIzol试剂购自Invitrogen公司;预染蛋白分子量marker、反转录试剂盒、8孔腔室载玻片等购自Thermo公司;质粒提取试剂盒购自Qiagen公司;SYBR green real-time PCR Master Mix购自Toyobo公司;荧光定量PCR仪专用96孔板与封板膜购自ABI公司;实时荧光定量PCR仪为ABI Step One Plus Real-Time PCR System;共聚焦显微镜为Leica Microsystems;引物合成与DNA测序服务由英潍捷基(上海)公司提供。
1.2 实验方法
1.2.1 IL-37b基因的克隆与pEGFP N1/IL-37b真核表达载体的构建
全长与成熟形式的IL-37b基因模板来自本实验室制备的含IL-37b全长编码区基因的质粒pUBC/IL-37b。以该质粒为模板,通过PCR技术对FL-IL-37b与M-IL-37b编码区基因进行扩增。上、下游引物序列见表1,下划线为EcoR I和Xho I酶切位点,PCR反应条件为:95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 45 s,扩增30个循环;72℃延伸10 min,预计目的基因片段大小分别为654 bp、519 bp。采用琼脂糖凝胶电泳鉴定PCR产物,并对目的条带DNA进行回收,用于连接构建真核表达载体。用限制性内切酶EcoR I和Xho I分别对目的基因的PCR产物与表达载体pEGFP N1进行双酶切,再次进行琼脂糖凝胶电泳,通过胶回收纯化收集酶切产物,于16℃环境过夜连接,构建表达载体。次日,将连接产物转化大肠杆菌DH5α,吸取约200 μL转化液均匀涂布于具有卡那霉素抗性的LB平板上,在37℃培养箱中倒置培养过夜。次日,挑选若干菌落进行PCR,通过琼脂糖凝胶电泳鉴定结果后,将阳性克隆进行DNA测序,鉴定IL-37b基因片段是否正确插入,阳性克隆质粒命名为pEGFP N1/IL37b。

表1 IL-37b基因引物序列
1.2.2 RAW 264.7细胞的培养与表达载体的转染
将RAW 264.7细胞制成浓度为每毫升5×104个的细胞悬液,分别接种于8孔腔室载玻片与12孔细胞培养板,37℃培养至细胞贴壁。按照转染试剂Lipofectamine2000说明书步骤将pEGFP N1/IL-37b质粒转染至8孔腔室载玻片与培养板的细胞中。转染完毕更换培养基后加入工作浓度为500 ng/mL的LPS,继续培养16~18 h。
1.2.3 Western blot检测转染后细胞中IL-37b蛋白的表达
收集12孔培养板中的细胞,用RIPA裂解液裂解并提取蛋白。配制浓度为12%~15%的分离胶,将细胞裂解液进行SDS-PAGE电泳。电泳结束后进行转膜,将蛋白条带电转至PVDF膜上。用5%脱脂奶粉溶液室温封闭1 h,减少非特异性结合后,按1∶1000的比例用IL-37抗体4℃孵育过夜。次日,用0.1%的PBST洗膜,加入按1∶5000比例稀释的HRP标记的山羊抗兔IgG,室温作用1 h。洗膜后加显影液,观测蛋白条带。
1.2.4 共聚焦显微镜检测转染后细胞中IL-37b的表达与定位
弃去8孔腔室载玻片中的培养基,用PBS洗涤细胞后,用4%多聚甲醛溶液固定细胞10 min。洗去多余的固定液,用0.2%的Triton X-100冰上通透细胞10 min。再次洗涤细胞后,用DAPI避光孵育细胞10 min,对细胞核进行染色。染色后用PBS洗涤细胞一次,除去8孔腔室,留下下方有细胞贴附的载玻片,用中性树脂封片。待中性树脂晾干后,在Leica共聚焦显微镜下观察细胞中FL-IL-37b与M-IL-37b的表达情况并拍照记录。
1.2.5 Real-time PCR检测转染细胞中IL-37b的抑制作用
收集12孔细胞培养板中的细胞,按照TRIzol说明书与Thermo反转录试剂盒说明书的步骤提取细胞总RNA,并对RNA进行反转录,获得cDNA。通过real-time PCR检测细胞中IL-6的相对表达量。GAPDH与IL-6基因的引物序列如表2所示,real-time PCR的反应体系如表3所示,反应条件为:保温,95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,扩增40个循环;熔解曲线为60℃~95℃升温。

表2 Real-time PCR引物序列

表3 Real-time PCR反应体系
1.3 统计学方法
应用GraphPad Prism V.5.0软件对数据进行t检验及统计学分析,计量资料以平均数±标准差(x±s)表示,以P< 0.05为差异有显著性。
2 结果
2.1 IL-37b基因的PCR扩增产物与重组质粒的鉴定
M-IL-37b与FL-IL-37b基因的PCR扩增产物的琼脂糖凝胶电泳结果如图1所示,在500~750 bp之间有两条明亮的条带,一条接近500 bp,为M-IL-37b基因扩增的产物;另一条约在650 bp附近,为FL-IL-37b基因扩增的产物,与预期的目的基因大小相符。重组质粒单克隆菌落PCR产物琼脂糖凝胶电泳结果显示,阳性的菌落在与M-IL-37b与FL-IL-37b基因相近的位置各有一条明亮的特异性条带。对阳性克隆菌落进行DNA测序,结果显示IL-37b基因片段正确插入pEGFP N1质粒,碱基无突变,可进行下一步的转染实验。

注:M:Marker;1:成熟IL-37b;2:全长IL-37b;3:阴性对照;4:成熟IL-37b阳性克隆菌落;5:全长IL-37b阳性克隆菌落。图1 PCR产物的琼脂糖凝胶电泳Note.M:Marker.1:M-IL-37b.2:FL-IL-37b.3:Negative control. 4: Positive colony of M-IL-37b. 5: Positive colony of FL-IL-37b.Fig.1 Agarose gel electrophoresis of the PCR products
2.2 重组表达载体在细胞中的表达
2.2.1 Western blot检测转染后细胞中IL-37b蛋白的表达
如图2所示,给予LPS刺激后,转染的RAW 264.7细胞裂解液的Western blot结果显示,有两条特异性的蛋白条带,位置分别在25 kDa与15 kDa附近,分别为FL-IL-37b与M-IL-37b,条带大小与预期结果相符[8,13]。证实转染后的RAW 264.7细胞中有M-IL-37b与FL-IL-37b的表达。
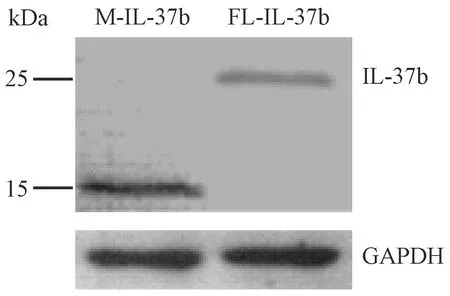
图2 转染的RAW 264.7细胞中IL-37b的表达Fig.2 Expression of IL-37b protein in the transfected RAW 264.7 cells
2.2.2 共聚焦显微镜检测转染后细胞中IL-37b的表达与定位
如图3所示,绿色为融合了绿色荧光蛋白(green fluorescent protein,GFP)的IL-37b,蓝色为DAPI染色的细胞核。转染后,M-IL-37b主要在细胞核中表达,FL-IL-37b则在细胞质、细胞核中都有表达;LPS能够在一定程度上诱导IL-37b表达上调。
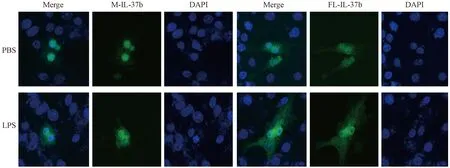
图3 带GFP标签的IL-37b在RAW 264.7细胞中的表达Fig.3 Expression of IL-37b with GFP tag in the transfected RAW 264.7 cells
2.3 Real time-PCR检测转染后的RAW 264.7细胞对于LPS刺激的抑制作用
如图4所示,real-time PCR结果显示转染pEGFP N1/IL-37b质粒的RAW 264.7细胞对于LPS刺激引起的促炎性细胞因子IL-6的表达有抑制作用,与转染空质粒载体的对照组相比差异显著,并且FL-IL-37b对于IL-6的抑制作用稍强于M-IL-37b。证实转染的IL-37b能够稳定表达并在细胞内发挥炎症抑制作用。

注:与LPS组比较,*P<0.05,**P<0.01。图4 LPS刺激转染的RAW 264.7细胞中IL-6的表达(n=3)Note.Compared with the LPS group,*P<0.05;**P<0.01.Fig.4 Expression of IL-6 mRNA in the transfected RAW 264.7 cells stimulated by LPS
3 讨论
Bulau等[7]研究发现,IL-37b的1号外显子能够编码caspase-1酶切位点,IL-37b前体分子需要caspase-1切割修饰才能成为成熟分子移入细胞核参与转录调控;突变导致caspase-1失活后,IL-37b不能进入细胞核,并且对炎症反应的抑制作用降低。成熟形式的IL-37b进入细胞核后,能够与Smad 3 (mothers against decapentaplegic homolog 3)结合形成功能性复合物影响基因转录,并抑制Toll样受体(Toll-like receptor, TLR)诱导表达促炎症性细胞因子,从而抑制树突状细胞的活化以及相应的免疫应答反应[8,14]。成熟形式的IL-37b的向细胞外分泌同样需要caspase-1的作用,但LPS诱导的巨噬细胞分泌IL-37b前体分子的过程不依赖caspase-1[7,14]。用相应的中和抗体中和IL-37b转基因小鼠体内的IL-37b,并注射LPS诱导感染性休克,小鼠血清中IL-6的表达显著升高,表明IL-37b的作用受到抗体拮抗,因而证实IL-37b能够分泌到细胞外发挥作用,说明其在细胞内外环境中具有双向功能[7]。
同为IL-1家族细胞因子的IL-18与其受体IL-18R结合形成的复合物能够诱导IFN-γ表达。IL-37b与IL-18有很高的同源序列,无论是全长还是成熟形式的IL-37b都能够与IL-18R的α链产生结合,且成熟形式IL-37b的结合能力较全长形式更强。但IL-18与IL-18Rα的结合能力比IL-37b成熟分子更强,因此IL-37b不能拮抗IL-18的功能。IL-18BP(IL-18 binding protein)是IL-18的天然抑制剂,能够抑制IL-18与IL-18R的结合;成熟形式的IL-37b可以与IL-18BP结合,增强IL-18BP对IL-18信号转导的抑制,从而抑制IFN-γ的表达[15-16]。近年来也有研究显示IL-37b发挥作用需要IL-1家族细胞因子受体IL-1R8参与,IL-1R8可能与IL-18Rα一样作为IL-37b的受体参与免疫应答。此外,IL-37b还能够通过抑制STAT1-4、c-Jun、p38 MARK、ERK等信号分子的磷酸化来调控促炎信号的传导[17]。
本实验中构建的真核表达载体pEGFP N1/IL-37b含有SV40和CMV启动子及GFP标签,能够稳定表达外源基因并有利于检测基因的转染效率。同时,GFP有利于检测全长与成熟形式的IL-37b在不同细胞器中的定位。实验中采用的RAW 264.7细胞系小鼠来源的单核巨噬细胞,自身并无IL-37表达,能够排除以人源细胞系作为研究对象产生的背景干扰。LPS在体内与体外都能够诱导大量促炎性细胞因子的表达[8],同时,在LPS刺激细胞后,IL-37b mRNA和蛋白的表达水平上调,表明LPS能够使IL-37b mRNA趋于稳定[16]。Western blot与共聚焦显微镜观测结果显示构建的FL-IL-37b与M-IL-37b的真核表达载体转染后经LPS诱导均可表达FL-IL-37b与M-IL-37b,其中M-IL-37b主要在定位于细胞核中,FL-IL-37b则在细胞质、细胞核中都有表达。Real-time PCR结果显示转染后的细胞中LPS诱导的IL-6的表达降低,表明转染后FL-IL-37b与M-IL-37b能够在细胞中发挥炎症抑制作用。上述结果与已报导的文献中的数据相符,证实构建的pEGFP N1/IL-37b能够稳定的表达相应的IL-37b,为进一步研究IL-37b在炎症反应中的发挥的作用及其细胞内外机制提供了便利。
[1] Dinarello C, Arend W, Sims J, et al. IL-1 family nomenclature [J]. Nat Immunol,2010,11(11): 973.
[2] Akdis M, Burgler S, Crameri R, et al. Interleukins,1 to 37,and interferon-γ:Receptors,functions,and roles in disease[J].J Allergy Clin Immunol,2011,127(3):701-721.
[3] Gao W, Kumar S, Lotze MT, et al. Innate immunity mediated by the cytokine IL-1 homologue 4 (IL-1H4/IL-1F7) induces IL-12-dependent adaptive and profound antitumor immunity [J]. J Immunol, 2003, 170(1): 107-113.
[4] Kumar S, Hanning CR, Brigham-Burke MR, et al. Interleukin-1F7B (IL-1H4/IL-1F7) is processed by caspase-1 and mature IL-1F7B binds to the IL-18 receptor but does not induce IFN-gamma production [J]. Cytokine,2002,18(2): 61-71.
[5] Boraschi D, Lucchesi D, Hainzl S, et al. IL-37: a new anti-inflammatory cytokine of the IL-1 family [J].Eur Cytokine Netw, 2011, 22(3): 127-147.
[6] Kumar S, McDonnell PC, Lehr R, et al. Identification and initial characterization of four novel members of the interleukin-1 family [J]. J Biol Chem, 2000, 275(14): 10308-10314.
[7] Bulau AM, Nold MF, Li S, et al. Role of caspase-1 in nuclear translocation of IL-37, release of the cytokine, and IL-37 inhibition of innate immune responses [J].Proc Natl Acad Sci U S A, 2014, 111(7): 2650-2655.
[8] Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamental inhibitor of innate- immunity [J]. Nat Immunol, 2010, 11(11): 1014-1022.
[9] McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37 expression protects mice from colitis [J]. Proc Natl Acad Sci U S A, 2011, 108(40): 16711-16716.
[10] Zhao PW, Jiang WG, Wang L, et al. Plasma levels of IL-37 and correlation with TNF-a, IL-17A, and disease activity during DMARD treatment of rheumatoid arthritis [J]. PLoS One, 2014, 9(5): e95346.
[11] Bulau AM, Fink M, Maucksch C, et al. In vivo expression of interleukin-37 reduces local and systemic inflammation in concanavalin A-induced hepatitis [J]. Sci World J, 2011, 11: 2480-2490.
[12] Lunding L,Webering S, Vock C, et al. IL-37 requires IL-18Ra and SIGIRR/IL-1R8 to diminish allergic airway inflammation in mice [J]. Allergy, 2015, 70(4): 366-373.
[13] Smith DE, Renshaw BR, Ketchem RR, et al. Four new members expand the interleukin-1 superfamily [J]. J Biol Chem, 2000, 275(2): 1169-1175.
[14] Sharma S, Kulk N, Nold MF, et al. The IL-1 family member 7b translocates to the nucleus and down-regulates proinflammatory cytokines [J]. J Immunol, 2008, 180(8): 5477-5482.
[15] Bufler P, Azam T, Gamboni-Robertson F, et al. A complex of the IL-1 homologue IL-1F7b and IL-18-binding protein reduces IL-18 activity [J]. Proc Natl Acad Sci U S A, 2002, 99(21): 13723-13728.
[16] Bufler P, Gamboni-Robertson F, Azam T, et al. Interleukin-1 homologues IL-1F7b and IL-18 contain functional mRNA instability elements within the coding region responsive to lipopolysaccharide [J]. Biochem J, 2004, 381(Pt2): 503-510.
[17] Li S, Neff CP, Barber K, et al. Extracellular forms of IL-37 inhibit innate inflammation in vitro and in vivo but require the IL-1 family decoy receptor IL-1R8 [J]. Proc Natl Acad Sci U S A, 2015, 112(8): 2497-2502.

